中级质量工程师论文第十篇
摘要:目的 建立藏药五味金色丸的定性定量检测方法,为其质量标准的提高提供依据。方法 采用显微鉴别方法,对制剂中诃子、波棱瓜子、木香、石榴子进行鉴别。采用薄层色谱法 (TLC) ,对制剂中诃子、波棱瓜子、木香、石榴子进行定性鉴别。采用HPLC多波长同时测定没食子酸、鞣花酸、herpetrione和herpetotriol的含量。结果 显微鉴别特征明显;TLC定性鉴别方法专属性强,各色谱斑点清晰且分离度较好,且阴性对照均无干扰;HPLC含量测定结果显示,没食子酸在0.092 0~1.840 4mg (r=0.998 8) 、鞣花酸在0.237 4~4.747 2mg (r=0.999 1) 、herpetrione在0.013 6~0.272 2mg (r=0.998 1) 、herpetotriol在0.002 1~0.041 0mg (r=0.996 3) 内与峰面积均呈良好线性关系,平均回收率 (n=9) 分别为99.32% (RSD=1.69%) , 99.25% (RSD=1.42%) , 98.49% (RSD=1.67%) 和97.50% (RSD=1.83%) .结论 本方法操作简便,重现性好,结果准确可靠,可用于五味金色丸的质量控制。
关键词:五味金色丸; 质量标准; 显微鉴别; 薄层色谱法; 高效液相色谱法;
五味金色丸[1]由诃子、波棱瓜子、石榴子、黑冰片、木香等5味药材组成[2],其制法为以上5味,粉碎成细粉,过筛,混匀,用水泛丸,干燥,即得,是藏医治疗黄疸性肝炎的常用方剂。其藏药名为涩多阿巴日布,具清热、利胆、消食之功效;对于治疗黄疸型肝炎、胆区痛、胃痛疗效确切,可以有效减轻恶心呕吐、口苦等症状。现行质量标准为中国卫生部颁藏药标准 (第1册) ,其定性鉴别过于简单,且没有含量测定,已远远不能满足藏药现代化质量控制的要求,为了保障药品质量,课题组对其标准进行研究,在查阅了相关文献的基础上[1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16],建立了诃子、波棱瓜子、石榴子和木香的显微鉴别及薄层色谱鉴别,同时建立诃子、石榴子和波棱瓜子3味药材中4个特征成分 (没食子酸、鞣花酸、herpetrione和herpetotriol) 的HPLC含量测定方法,为藏药五味金色丸标准的提高提供参考。
1 仪器与试药
1.1 仪器
BX53显微镜 (日本奥林巴斯株式会社) ;Waters2695高效液相色谱仪 (美国Waters公司) ;KQ3200V型超声波清洗机 (昆山市超声仪器有限公司) ;HH-4数显恒温水浴锅 (江苏佳美仪器制造有限公司) ;XS205分析天平 (瑞士梅特勒-托利多集团) .
1.2 试药
没食子酸 (批号:110831-201204;含量89.9%) 、鞣花酸 (批号:111684-201602;含量89.3%) 、诃子 (批号:121015-201605) 、木香烃内酯 (批号:111524-201710;含量99.5%) 、去氢木香内酯 (批号:111525-201711;含量99.8%) 、木香 (批号:120921-201309) 、波棱瓜子 (批号:121233-200301) 、石榴子 (批号:121431-201002) 均购于中国食品药品检定研究院;herpetrione和herpetotriol对照品由藏学研究中心藏医药研究所自制,含量均>98%;五味金色丸 (批号:20171201, 20171202, 20171203;规格:每10丸重2.5 g) 、阴性样品均由中国藏学研究中心藏医药研究所委托西藏甘露藏药股份有限公司制得;甲醇 (色谱纯,德国Merck公司) ;无水乙醇、三氯甲烷等 (分析纯,国药集团化学试剂北京有限公司) ;水为超纯水。
2 方法与结果
2.1 显微鉴别
诃子:石细胞成群,呈类圆形、长卵形、长方形或长条形,孔沟细密而明显。波棱瓜子:石细胞形大,壁厚,细胞形状不规则,长约120μm,直径23~76μm,层纹清晰,孔沟不明显。木香:菊糖团块形状不规则,有时可见微细放射状纹理,加热后溶解。石榴子:石细胞无色,椭圆形或类圆形,壁厚,孔沟细密。结果见图1.
2.2 定性鉴别
2.2.1 诃子的薄层色谱 (TLC) 鉴别
取本品2 g,研细,加无水乙醇20 mL,超声处理10 min,滤过,滤液蒸干,残渣加无水乙醇1 mL使溶解,作为供试品溶液。按处方制备不含诃子药材的阴性样品,取该阴性样品粉末2 g,同法制成阴性样品溶液。另取诃子对照药材0.5 g,同法制备对照药材溶液。吸取上述3种溶液各10μL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲酸 (3∶2∶1) 为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,105℃加热至斑点显色清晰,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。阴性样品在相应的位置上无斑点,阴性无干扰,结果见图2.
图1 显微特征图
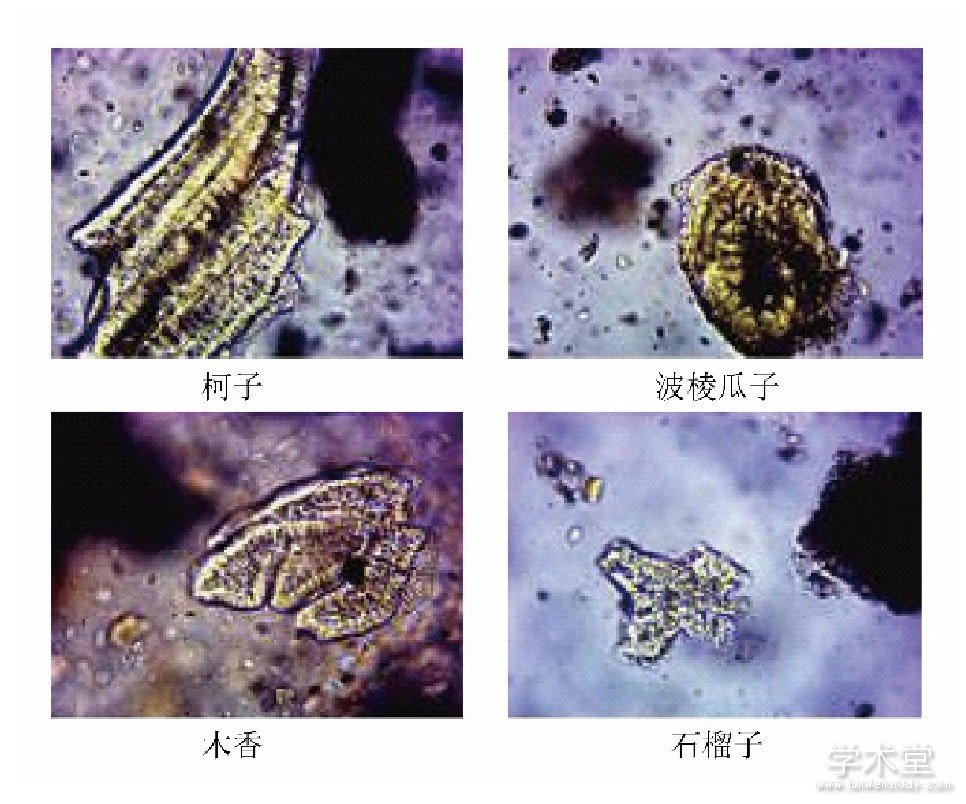
图2 诃子的薄层色谱图
2.2.2 木香的TLC鉴别
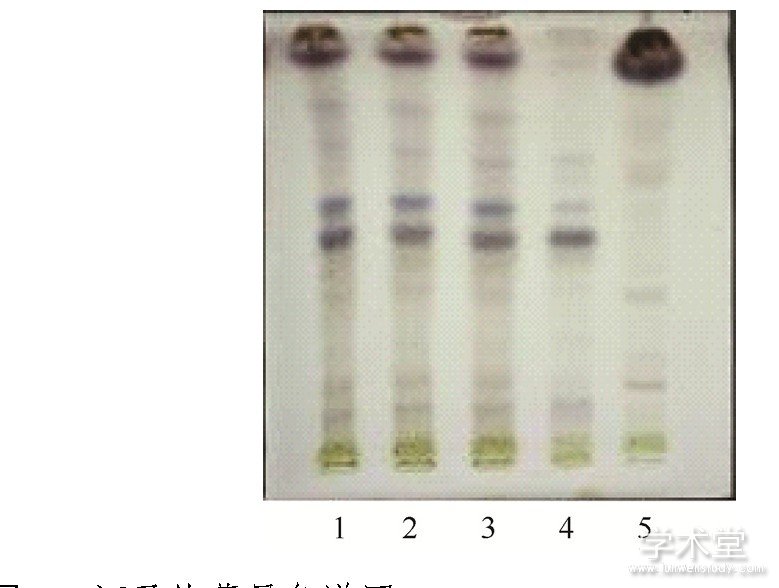
取本品5 g,研细,加石油醚 (60~90℃) 20 mL,超声处理30 min,滤过,滤液浓缩至1 mL,作为供试品溶液。取按处方制备不含木香药材的阴性样品粉末5 g,同法制成阴性样品溶液。取木香对照药材0.5 g,同法制备对照药材溶液。另取木香烃内酯、去氢木香内酯对照品对照品,加甲醇分别制成每1 mL含0.5 mg的溶液,作为对照品溶液。吸取上述4种溶液各5μL,分别点于同一硅胶G薄层板上,以石油醚 (60~90℃) -乙酸乙酯 (9∶1) 为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,加热至斑点显色清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。阴性样品在相应的位置上无斑点,阴性无干扰。结果见图3.
图3 木香的薄层色谱图
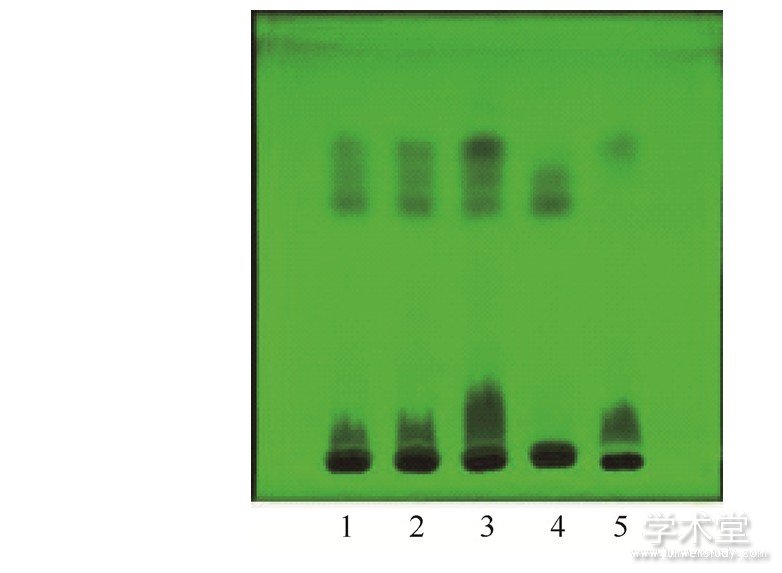
2.2.3 波棱瓜子的TLC鉴别
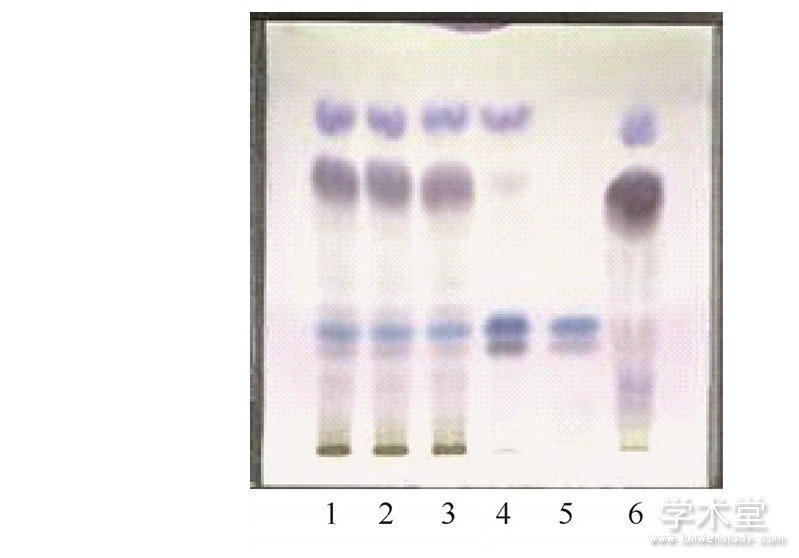
取本品4 g,研细,加甲醇40 mL,超声处理1 h,过滤,滤液挥至约1 m L,作为供试品溶液。按处方制备不含波棱瓜子药材的阴性样品粉末4 g,同法制成阴性样品溶液。取波棱瓜子对照药材1 g,同法制备对照药材溶液。另取herpetrione对照品加甲醇分别制成每1 mL含1 mg的溶液,作为对照品溶液。吸取上述4种溶液各10μL,分别点于同一硅胶G薄层板上,以三氯甲烷-丙酮-甲酸 (8∶4∶1) 为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,加热至斑点显色清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。阴性样品在相应的位置上无斑点,阴性无干扰。结果见图4.
2.2.4 石榴子的TLC鉴别
取本品2 g,研细,加乙醇10 mL,超声处理30 min,滤过,滤液浓缩至1 m L,作为供试品溶液。按处方制备不含石榴子药材的阴性样品,取该阴性样品粉末2 g,同法制成阴性样品溶液。另取石榴子对照药材0.5 g,同法制备对照药材溶液。吸取上述3种溶液各10μL,分别点于同一硅胶GF254薄层板上,以石油醚 (60~90℃) -乙酸乙酯 (9∶1) 为展开剂,展开,取出,晾干,置紫外灯 (254 nm) 下检视,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光猝灭斑点。阴性样品在相应的位置上无荧光猝灭斑点,阴性无干扰。结果见图5.
2.3 定量测定
2.3.1 混合对照品溶液制备
分别精密称取没食子酸、Herpetrione和Herpetotriol对照品各34.12, 13.61, 10.26 mg,各置于20, 20, 100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得没食子酸、Herpetrione和Herpetotriol质量浓度分别为1.533 7, 0.680 5, 0.102 6 mg·mL-1的对照品储备溶液。精密称取鞣花酸88.60 mg,置于20 m L量瓶中,加二甲亚枫溶解并稀释至刻度,摇匀,即得鞣花酸质量浓度为3.956 mg·mL-1的对照品储备溶液。再精密吸取没食子酸、鞣花酸、Herpetrione和Herpetotriol对照品储备液各3, 3, 1, 1 m L,置于50 m L量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得质量浓度分别为92.021 6, 237.359 4, 13.610 0, 2.052 0μg·mL-1混合对照品溶液。
图4 波棱瓜子的薄层色谱图
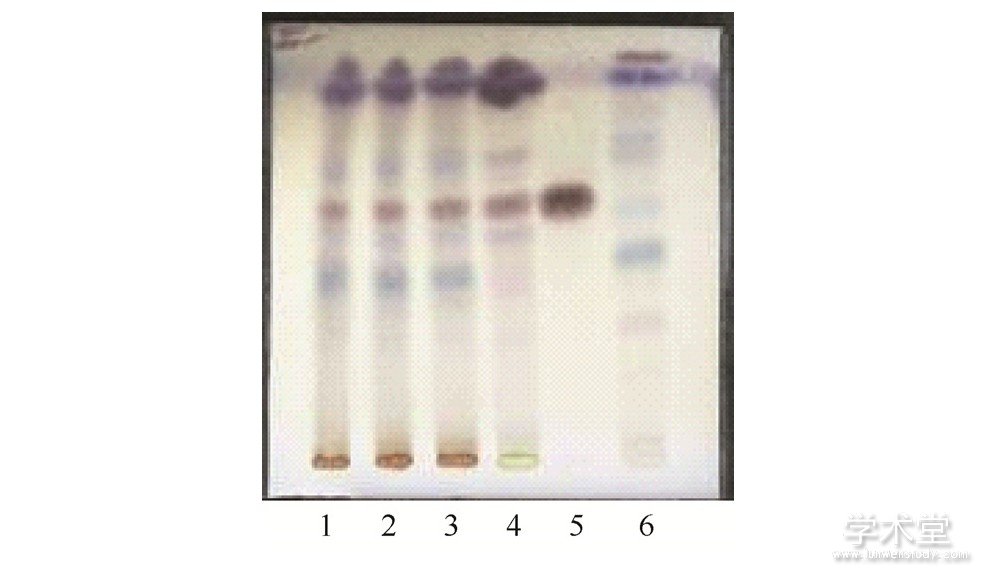
图5 石榴子的薄层色谱图
2.3.2 供试品溶液制备
取本品 (批号:20171201) 粉末1 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇溶液25 mL,密塞,称定质量,水浴回流80 min,放冷,再称定质量,用80%甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
2.3.3 阴性样品溶液制备
分别按处方制得不含诃子、石榴子的样品和不含波棱瓜子的样品,照“2.3.2”项下方法分别制成缺诃子、石榴子的阴性样品溶液1和缺波棱瓜子的阴性样品溶液2.
2.3.4色谱条件
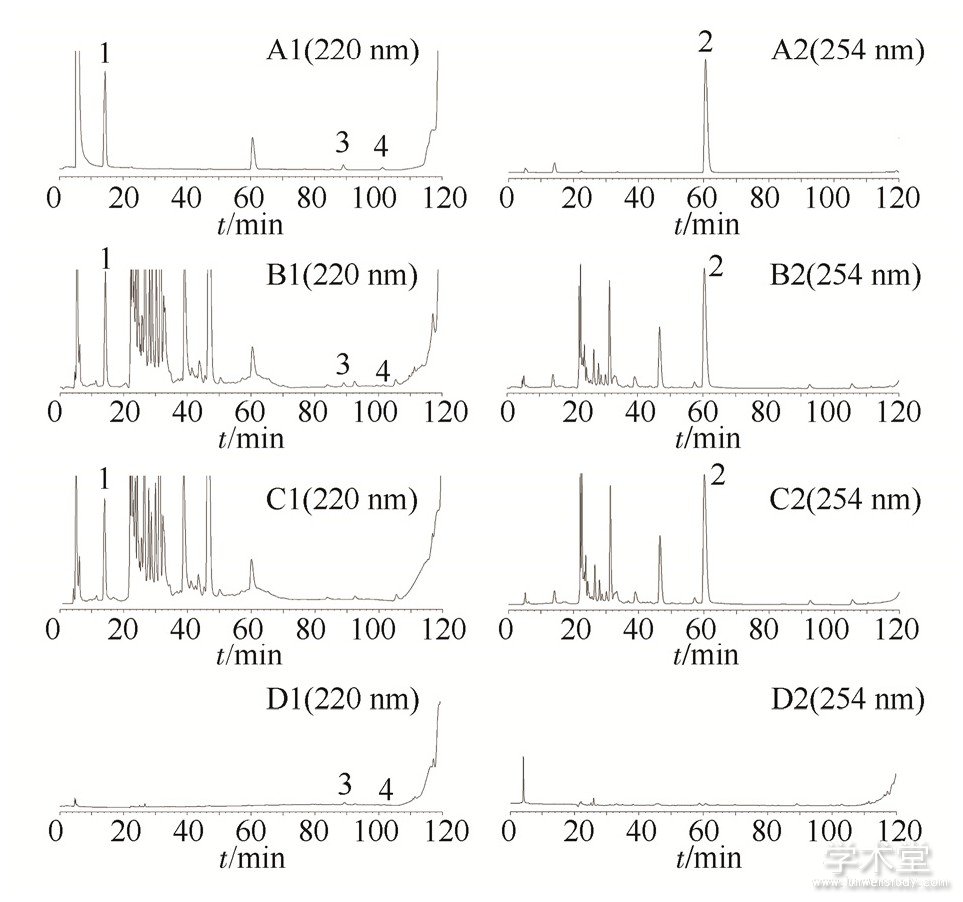
色谱柱为Welchrom–UltimateXB-C18 (250 mm×4.6 mm, 5μm) , 甲醇 (A) -0.05 mol·L-1磷酸二氢钾溶液 (pH=3.0) (B) , 梯度洗脱 (0~15 min, 5%A;15~16 min, 5%→30%A;16~60 min, 30%→38%A;60~100 min, 38%→45%A;100~115 min, 45%→80%A;115~116 min, 80%→5%A;116~120 min, 5%A) ;体积流量0.5 mL·min-1, 柱温30℃, 没食子酸、herpetrione和herpetotriol检测波长220 nm, 鞣花酸检测波长254 nm, 进样量为10μL.在上述条件下, 没食子酸、鞣花酸、herpetrione和herpetotriol的色谱峰保留时间分别为12.2, 60.7, 89.4, 101.3 min左右, 且分离度均>1.5, 理论板数均>4 000, 阴性样品溶液对测定无干扰。结果见图6.
图6 高效液相色谱图
2.3.5 线性关系考察
精密吸取没食子酸、鞣花酸、herpetrione和herpetotriol对照品储备液各6, 6, 2, 2 m L,置于50 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为溶液A,再精密吸取溶液A各15, 10, 5, 1 mL分别置于20 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为溶液B、溶液C、溶液D、溶液E.按“2.3.4”项下色谱条件,分别进样10μL,记录峰面积。以组分质量为横坐标 (X) ,峰面积为纵坐标 (Y) ,绘制成标准曲线,得各自线性方程。结果见表1.
表1 线性试验结果

2.3.6 仪器精密度试验
精密吸取混合对照品溶液,按“2.3.4”项下色谱条件重复进样6次,测得没食子酸、鞣花酸、herpetrione和herpetotriol的峰面积及其保留时间,计算RSD,其峰面积RSD分别为1.21%,0.90%,1.72%和1.63%,保留时间RSD分别为0.24%,0.29%,0.71%, 和0.55%,结果表明仪器精密度良好。
2.3.7 稳定性试验
精密吸取同一份供试品 (批号:20171201) 溶液,分别按“2.3.4”项下色谱条件,在24 h内每隔2 h重复进样,记录没食子酸、鞣花酸、herpetrione和herpetotriol的峰面积,测得其RSD分别为1.21%,1.29%,1.47%和1.62%,结果表明供试品溶液在24 h内稳定。
2.3.8 重复性试验
取同一批号 (批号:20171201) 样品,按“2.3.2”项下供试品溶液制备方法平行制备6份供试品溶液,按“2.3.4”项下色谱条件进样,记录没食子酸、鞣花酸、herpetrione和herpetotriol的峰面积,测得其RSD分别为1.01%,0.86%,1.63%和1.88%,结果表明本方法重复性良好。
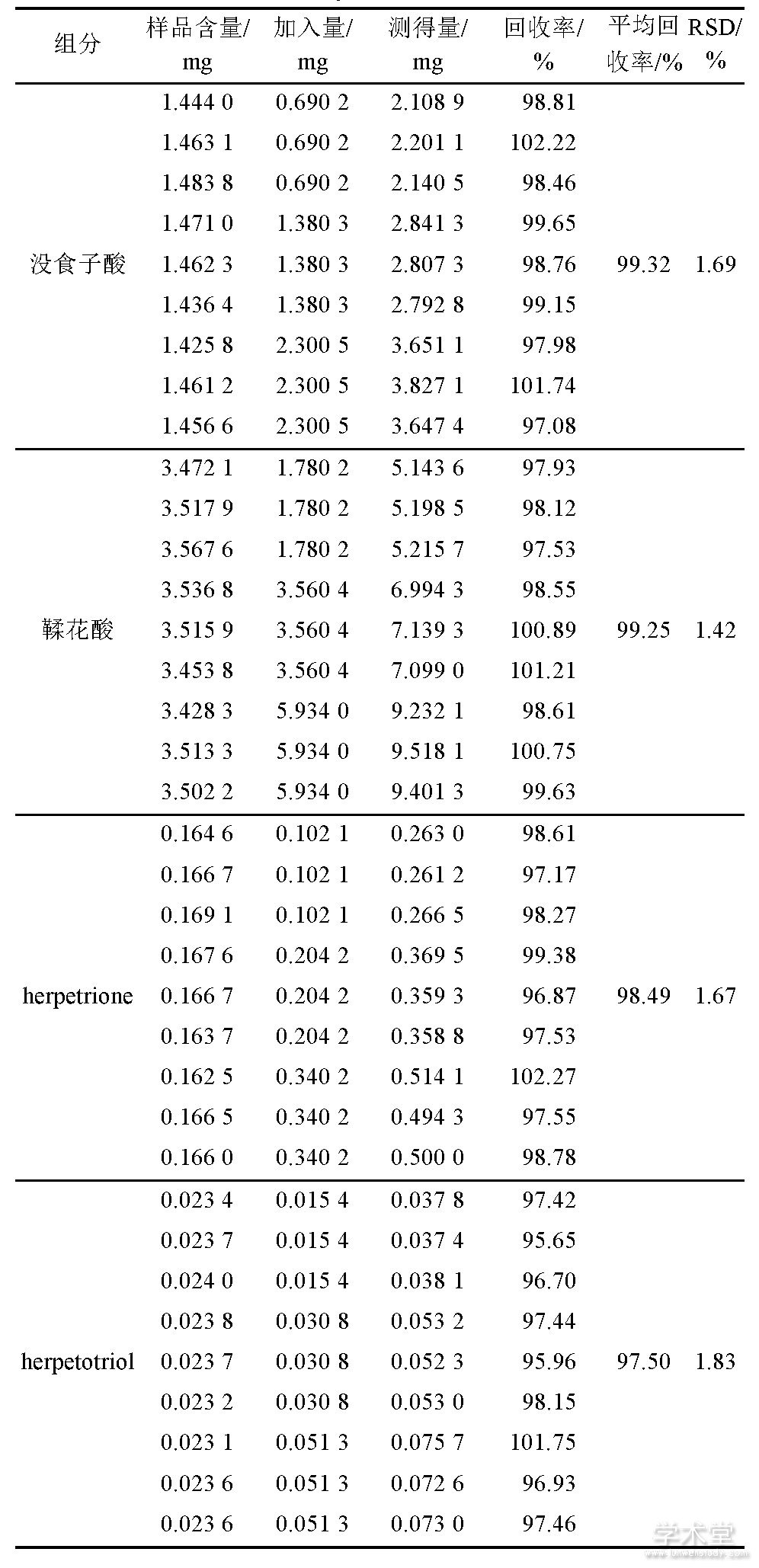
2.3.9 加样回收试验
取已知含量的样品 (批号:20171201) 9份,每份约0.5 g.置具塞锥形瓶中,每3份样品中各分别精密加入混有一定量没食子酸、鞣花酸、herpetrione和herpetotriol的溶液A、B、C (精密量取没食子酸、鞣花酸、herpetrione和herpetotriol混合对照品液30 mL,置100 mL量瓶中,加入甲醇的至刻度,摇匀,作为溶液A;精密量取没食子酸、鞣花酸、herpetrione和herpetotriol混合对照品液60 mL,置100 mL量瓶中,加入甲醇的至刻度,摇匀,作为溶液B;没食子酸、鞣花酸、herpetrione和herpetotriol混合对照品液作为溶液C) 25 m L,按“2.3.2”项下制成供试品溶液,再按“2.3.4”项下色谱条件分别测定。计算平均回收率,结果没食子酸、鞣花酸、herpetrione和herpetotriol回收率分别为99.32% (RSD=1.69%) 、99.25% (RSD=1.42%) 、98.49% (RSD=1.67%) 和97.49% (RSD=1.83%) .表明回收率良好。结果见表2.
表2 加样回收率实验结果 (n=9)
2.3.1 0 样品含量测定
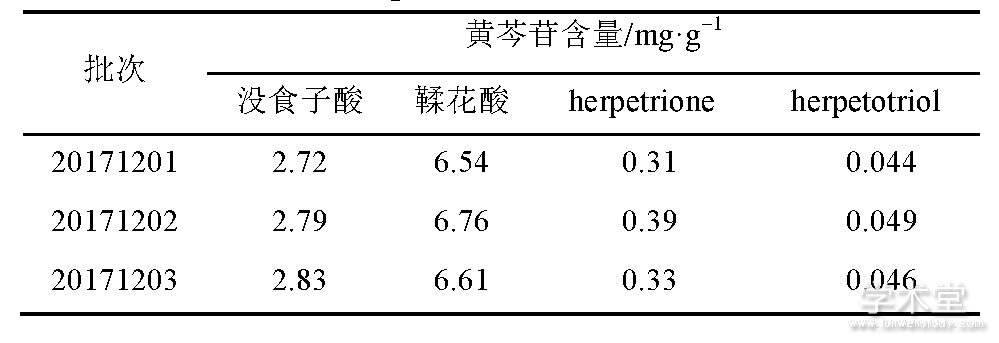
精密称取3批样品 (批号20171201, 20171202, 20171203) ,按“2.3.2”项下方法制成供试品溶液,再按“2.3.4”项下色谱条件进样。用外标法 (峰面积) 计算含量,结果见表3.
表3 样品含量测定结果 (n=3)
3.1 TLC分析
波棱瓜子的TLC鉴别,按照原标准《卫生部颁藏药标准:第一册》对波棱瓜子进行定性鉴别发现拖尾严重,分离效果不理想,所以参考相关资料,改变展开剂为三氯甲烷-丙酮-甲酸 (8∶4∶1) ,显色剂为5%香草醛硫酸溶液,并且增加了herpetrione对照品,结果特征斑点明显,阴性对照无干扰,取得理想的分离效果。在增加对照品上原方案是增加herpetrione和herpetotriol 2种对照品,但在实际结果中发现,样品中herpetotriol对照品含量较低,无法显示足够清晰的斑点,所以舍弃了herpetotriol对照品,只选择herpetrione对照品。
对石榴子的的薄层色谱鉴别,首先参考蔡霞等[10]的TLC试验。实验结果表明,薄层色谱斑点分离不好,尤其鞣花酸对照品斑点,并且阴性样品有干扰。参考其他文献,改为本研究中的TLC条件,结果取得比较好的效果。
3.2 HPLC分析
3.2.1 检测波长的选择
通过DAD检测器在紫外光波范围扫描得知,没食子酸、鞣花酸、herpetrione、herpetotriol最大吸收峰波长分别为216, 254, 211, 202 nm,经综合考虑,没食子酸、herpetrione和herpetotriol在波长220 nm处都有较高且稳定的吸收值,所以选择220 nm作为没食子酸、herpetrione和herpetotriol检测波长,254 nm作为鞣花酸检测波长。
3.2.2 流动相的选择
由于藏药五味金色丸成分复杂,经查询相关文献,本实验选定乙腈-水、乙腈-0.1%磷酸、乙腈-0.05 mol·L-1磷酸二氢钾溶液 (pH=3.0) 、甲醇-水、甲醇-0.1%磷酸、甲醇-0.05 mol·L-1磷酸二氢钾溶液 (pH=3.0) 6种流动相系统,通过大量试验比较各种比例的洗脱方式,而选择了最佳流动相:即“2.3.4”项下色谱条件。
3.2.3 供试品溶液制备方法的选择
本实验经查询相关文献[8,9],选定甲醇、80%甲醇、50%甲醇、乙酸乙酯、乙醇、80%乙醇、50%乙醇7种溶液,超声和回流2种方式,20, 40, 60, 80, 100, 120 min6个时间段。通过实验比较:加热回流比超声提取各组分含量相对较高,采用80%甲醇溶液提取各组分含量相对较高,提取时间在80 min后无明显增加。综上考虑,选择80%甲醇溶液加热回流80 min作为供试品溶液的制备方法。
4小结
藏药是在广泛吸收、融合了中医药学,印度医药学和大食医药学等理论的基础上,通过长期实践所形成的独特的医药体系,迄今已有上千年的历史,是我国民族药重要组成之一。但现在藏药的质量标准已经严重落后,五味金色丸是西藏地区治疗黄疸性肝炎常用方剂,疗效显着,为藏药的现代化发展,本实验特对其质量标准进行提高完善,结果表明其专属性强,重复性好,方法简便,可为将来藏药五味金色丸标准的提高提供参考。
参考文献
[1] 中华人民共和国卫生部。卫生部颁藏药标准:第一册[S].北京:人民卫生出版社, 1995:64; 274.
[2] 中国药典。一部[S]. 2015:62, 187, 433, 443, 460.
[3] TIAN X L, MU X W. Study on quality standard for Tibetan Wuwei Zhaxun pills[J]. Chin Pharm Aff (中国药事) , 2012, 26 (9) :1000-1002.
[4] 赵甡慧, 齐曼丽, 刘德旺。通滞苏润江胶囊中番泻叶、诃子、西红花的TLC鉴别研究[J].中国民族医药杂志, 2007, 13 (4) :52-53.
[5] LI Z Y, PAN Y, DING G. Qualitative and quantitative studies of costunolide and dehydrocostus lactone in Radix Aucklandiae[J]. Lishizhen Med Mater Med Res (时珍国医国药) , 2004, 15 (11) :745-746.
[6] LIU X M, SUN H Z, WANG X L, et al. Supplementary study on quality standard for Shugan Concentrated pills[J]. Chin J Mod Appl Pharm (中国现代应用药学) , 2017, 34 (12) :1712-1716.
[7] MA X, WANG L X, ZHAO J B, et al. Enhancing the quality standard of Zuozhudaxi[J]. Chin J Mod Appl Pharm (中国现代应用药学) , 2012, 29 (3) :250-253.
[8] 王佩龙。波棱瓜子药材质量标准研究[D].重庆:西南大学, 2013.
[9] 李隆云。藏药波棱瓜子的生药药学研究[D].成都:成都中医药大学, 2002.
[10] CAI X, LI C Y, ZHANG Y X, et al. Research on quality standards of Granati pericarpium and Granati semen[J].World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化) , 2015 (5) :1007-1011
[11] CHEN P, LIU Y H, LUO G F, et al. TLC identification of pomegranate seed and Terminalia chebula, HPLC determination of cinnamal and piperine in Tibetan medicine Shi-Wei Xiao-Shi-San[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化) , 2014, 16 (12) :2720-2724.
[12] WANG W, WEN C C, XIE S Q, et al. Simultaneous determination of shikimic acid, Gallic acid and ellagic of Fructus Chebulae by HPLC[J]. China J Tradit Chin Med Pharm (中华中医药杂志) , 2017, 32 (2) :819-821.
[13] CHEN W, LAI Y, SHEN L J. Determination of Gallic acid in megranates pericarp with HPLC[J]. Chin J Mod Appl Pharm (中国现代应用药学) , 2006, 23 (5) :386-388.
[14] 崔翠翠, 张学兰, 李慧芬。炮制对石榴皮中没食子酸、鞣花酸和鞣质含量的影响[J].中成药, 2010, 32 (4) :613-615.
[15] QIAN Y Z, HAN J, LIU L P, et al. Determination of herpetrione in Herpetospermum caudigerum by ultrahigh performance liquid chromatography[J]. Pharm J Chin People's Liberation Army (解放军药学学报) , 2011, 27 (6) :527-528, 531.
[16] CONG L B, WANG Q, HUANG Y J, et al. Simultaneous determination of 7 bioactive lignans compounds in Herpetospermum caudigerum by RP-HPLC[J]. Chin Pharm J (中国药学杂志) , 2008, 43 (12) :946-949.
点击查看>>中级质量工程师论文(精选范文10篇)其他文章















