3.3 结果与分析。
3.3.1 粪便短链脂肪酸分析。
用气相色谱仪对筛选的 20 名血液透析患者的粪便进行短链脂肪酸测定,得出结果如表 3-2 所示:基线 V0、干预 V2、V6 期两两时期的乙酸、丙酸、丁酸、异丁酸、异戊酸的对比的显着性差异,可看到 V0 和 V2 期的乙酸含量、丙酸含量有显着性差异(P=0.011、0.035<0.05),V2 期和 V6 期的丁酸含量有显着性差异(P=0.045<0.05),其它均无显着性差异。

3.3.2 益生菌和短链脂肪酸相关性分析。
如表 3-2 所示,益生菌摄入对肠道短链脂肪酸(short chain fatty acids,SCFAs)代谢水平的影响。短链脂肪酸又名挥发性脂肪酸,这类脂肪酸的碳链长度在 1-6之间,常见的短链脂肪酸包括乙酸、丙酸和丁酸。其主要由结肠中的厌氧菌发酵碳水化合物或降解蛋白质产生。短链脂肪酸在人体内具有重要的生理功能,其可以调节人体的肠道菌群多样性、为肠道上皮细胞提供营养物质并促进肠道细胞的増殖、减少结肠炎症的发生、抗肿瘤等[88–90]。肠道内的益生菌能够满足需要时,就可以对肠道菌群失调进行改善;之后在体内分解,其有效成分能够被人体吸收,从而促进肠道菌群之间的作用,最终对增强人体免疫力有所作用[91]。
2005 年 Schneider 等人以患有肠道疾病的实验对象和健康实验对象为实验对象,让上述两组人群连续 6 天摄入益生菌布拉氏酵母菌研究摄入该益生菌两组人群肠道中短链脂肪酸的变化。结果发现,摄入益生菌后,患病组实验对象肠道中短链脂肪酸生成量显着增加,健康组实验对象没有特别大的变化。益生菌对样品粪便中的乙酸、丙酸、丁酸含量有影响,并以 V2 期最为显着。说明在干预两个月以后达到益生菌对短链脂肪酸的影响。
3.3.3 血液透析便秘患者粪便 16s 高通量测序分析。
3.3.3.1 数据质控。
(1)测序数据统计。
数据去杂方法和参数:① 滤 reads 尾部的质量值是 20 以下的碱基,设置 50bp 的窗口且平均质量值低于20,就从窗口开始截去后端碱基,之后再过滤质控后 50bp 以下的 reads,去除含 N 碱基的 reads;② 根据 PE reads 之间的 overlap 关系,将成对 reads 拼接(merge)成一条序列,最小 overlap 长度为 10bp;③ 接序列的 overlap 区可以允许为 0.2 的最大错配比率,以用来筛选出不符合的序列;④ 基于序列首尾两端的 barcode 和引物区别样品,然后调整序列方向,barcode允许的错配数为 0,并且最大引物错配数为 2;使用软件:FLASH、Trimmomatic。
(2)样本数据统计。
①测序数据统计以 16s 基因序列为基础的测序方法,用来比较血液透析患者和干预 V2、V6时期为对照组的肠道微生物群落。从他们的粪便样本中提取 DNA,表 3-3 所示共获得 2226553 个高质量的 16srDNA 基因序列,平均每个样本序列为 37109 条基因序列,样本数据统计量最大序列为 44551 条,最小序列为 30055 条,样本数据统计信息见附录三。

②样本数据统计样本信息的总览,包括样本和测序相关信息,附录 3。
3.3.3.2 物种注释与评估。
OUT 的定义是在系统发生学或群体遗传学研究中,为了便于进行统计分析,人为的给某一个分类单元(品系,属,种、分组等)设置了统一的标志。然后将序列按照彼此相似性分类和归纳为许多不同的小组,进行聚类分析操作,其中一个 OTU 就是一个小组。基于相似度水平的不同,对所得序列进行 OTU 分类,一般是相似水平为 97%的条件下的 OUT 进行生物信息统计分析。分析步骤如下:
① 为了便于降低分析中间过程中冗余计算量,要对优化的序列再提取非重复序列;② 去除没有重复的单序列;③ 按照 97%相似性对非重复序列来进行 OTU 聚类,在聚类过程中要去除嵌合体,从而得到 OTU 的代表序列。采用 RDP classifier 贝叶斯算法,然后利用这种算法对 97%相似水平的 OTU 代表序列进行分类学分析,得到每个 OTU 对应物种的分类信息,然后分别在各个分类学水平下显示出来:domain(域),kingdom(界),phylum(门),class(纲),order(目),family(科),genus(属),species(种)进而统计各样本及其各样本之间的群落组成及差异。
利用 16s 细菌数据库整理功能基因数据库,得出结果。
(1)OTU 分类学分析。
OTU 分类学综合信息表, 将 OTU 分析结果分类学信息结合得到的综合表,Rank-Abundance 曲线是分析多样性的一种方式。其构建方法是要对单一样本中每一个 OTU 所含的序列数进行统计,然后将 OTUs 按相对丰度由大到小进行排序,以样本 OTU 等级为横坐标,以 OTU 中序列数的相对百分含量或序列数为纵坐标进行做图。
(2)Alpha 多样性分析。
微生物的多样性是可以通过单样本的多样性来分析,反映了微生物群落的相对丰度和微生物的多样性。多样性指数分析是统计显示了个样本在各个指数类型下的多样性指数数值,多样性指数表第一列为样本名,第一行为多样性指数类型,其余列为各指数类型对应的数值。本研究选取能计算群落多样性(Communitydiversity)的 shannon 相浓指数进行分析,图 3-3 多样性指数柱状图为 Shannon 均匀度测量指数分既指数越高代表菌群越丰富,显示基线 V0 期、干预 V2、V6 期相比菌群多样性差异并不明显。

(3)指数组间差异检验。
通过多样性指数分析可以得到群落中物种的丰度、覆盖度和多样性等信息。T检验,也称 Student t 检验,是用 t 分布理论来推论差异发生的概率,从而比较两个平均数的差异是否显着,主要用于样本含量较小(例如 n<30),总体标准差σ未知的正态分布数据。该分析可用于评估不同分组间多样性指数是否有显着性差异。
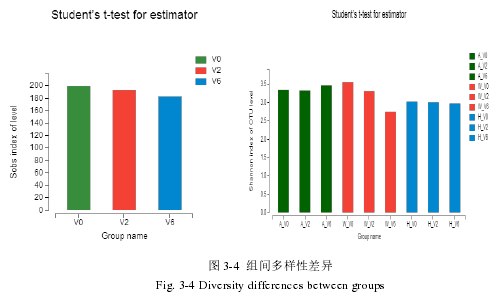
如图 3-4 所示显示,按时期和各个医院各个时期分析,组间无显着差异,说明组内差异较大。多样性指数 T 检验柱状图,此图展示所选两组样本间的显着性差异情况,并对有显着性差异的两组做好标记(0.01<p<=0.05 标记为*,0.001<p<=0.01 标记为**,p<=0.001 标记为***)。
3.3.3.3 物种组成分析。
研究环境中微生物的多样性,可以通过单样本的多样性即 alpha 多样性反映微生物群落的丰度和多样性,也包括一系列统计学分析指数以估计环境群落的物种丰度和多样性。
此模块主要有三个分析功能,分别是 Alpha 多样性指数分析、基于多样性指数的组间 T 检验分析还有稀释性曲线分析,通过多样性指数分析您可以得到群落中物种的丰度、覆盖度和多样性等信息,通过稀释性曲线分析您可以了解样本的测序深度是否合理。
(1)物种 Venn 图分析。
Venn 图可用于统计多组或多个样本中所共有和独有的物种数目,可以比较直观的表现样本的物种数目组成的相似性和重叠情况。一般情况下,分析时选用相似水平为 97%的 OTU 或其他分类学水平的样本表进行分析。

如图 3-5 所示基线 V0 期、干预 V2、V6 期三个时期的菌群数量为 577 个,基线 V0 期、干预 V2 期共有菌群数为 614 个,基线 V0 期、干预 V6 期共有菌群数为606 个,干预 V2 期、干预 V6 期共有菌群数为 596 个,只有基线 V0 期有的菌群为12 个,只有干预 V2 期有的菌群为 6 个,只有干预 V6 期有的菌群为 16 个。Venn图,重叠部分表示多个样本分组中共有的物种(或 OTU),没有重叠的部分表示该样本分组所特有的物种(或 OTU),数字表示对应的物种(或 OTU)数目。
(2)群落组成分析。
基于分类学分析的结果,显示一个或多个样本在不同分类水平上的分类学比对情况。在结果中,通常包含了两个信息:
① 本中含有何种微生物;② 样本中的微生物的序列数,也可看作为各微生物的相对丰度。
可采用使用统计学分析的方法,对样本在不同分类水平上的群落结构以及其变化情况将多个样本的群落结构放在一起分析对比进行观测。基于研究对象的样本数量,有不同的方式展示来展示结果。一般使用比较直观的饼图或柱状图等形式进行呈现。除此之外群落结构可在任一分类水平下进行分析。
(3)群落 Bar 图。
基于分类学分析结果,显示得出不同分组也可以是不同样本在各分类水平(如域、界、门、纲、目、科、属、种、OTU 等)上的群落结构组成情况。根据群落Bar 图,可以直观呈现两方面信息:
①各样本在某一分类学水平上含有何种微生物;②样本中各微生物的相对丰度(所占比重)。
③群落柱形图,横坐标/纵坐标为样本名,纵坐标/横坐标为物种在该样本中所占的比例,不同颜色的柱子代表不同的物种,柱子的长短代表该物种所占比例的大小。可以通过点击图例中的每个物种进行筛选个性化查看物种组成情况。

如图 3-6 所示,在属水平下基线 V0 期、干预 V2、V6 期的肠道菌群中相对丰度大于 1%的微生物有 26 种,分别为 Megamonas,Coprococcus_2,Fusobacterium,Lachnospira , Roseburia , Collinsella , Alistipes , Parabacteroides ,Phascolarctobacterium , Lactobacillus , [Ruminococcus]_gnavus_group ,[Ruminococcus]_torques_group , Fusicatenibacter , Escherichia-Shigella ,Subdoligranulum ,Ruminococcus_2 , Enterococcus , [Eubacterium]_hallii_group ,[Eubacterium]_rectale_group , Streptococcus , Anaerostipes , Prevotella_9 ,Bifidobacterium,Faecalibacterium,Bacteroides,Blautia。其中属于厚壁菌门有 18种、拟杆菌门 5 种、变形菌门 2 种、梭杆菌门 1 种和变形菌门一种。厚壁菌门和拟杆菌门为优势菌。
基线 V0 期中,厚壁菌门(53.9%)包括栖粪杆菌属(Faecalibacterium,9.0%)、布劳特氏菌属(Blautia,13.69%),罕见小球菌属(Subdoligranulum,3.42%),霍氏 真 杆 菌 属 ( [Eubacterium]_hallii_group ,3.59% ) , 直 肠 真 杆 菌 属([Eubacterium]_rectale_group ,3.78%),丁酸弧菌属(Anaerostipes,4.97%)、罗斯氏菌属(Roseburia,0.78%)、毛螺菌属(Lachnospira,0.75)、乳酸菌属( Lactobacillus,1.49% ) , 肠 球 菌 属 ( Enterococcus,0.23% ) , 链 球 菌 属( Streptococcus,2.95% )、巨单胞菌属( Megamonas,0.16% )和考拉杆菌属( Phascolarctobacterium,0.92% ) 。 拟 杆 菌 门 ( 13.8% ) 包 括 拟 杆 菌 属(Bacteroides,10.33%),普雷沃氏菌属(Prevotella_9,2.36%)、Alistipes(1.04%)和副杆状菌属(0.07%)。放线菌门(6.44%)包括双歧杆菌属(Bifidobacterium,5.7%)和,柯林斯氏菌(Parabacteroides,0.74%)。最后两个为变形菌门下的肠杆菌(Escherichia-Shigella,3.2%)和梭杆菌门下的梭杆菌(Fusobacterium,0%)。
与基线 VO 期相比服用菌片干预两个月后,厚壁菌门(49.52%)有所减少,栖粪杆菌属(Faecalibacterium)、罗斯氏菌属(Roseburia)、毛螺菌属(Lachnospira)和布劳特氏菌属(Blautia)有所增加,上升到 10.34%、1.17%、1.06%和 14.2%,罕见小球菌属(Subdoligranulum)、霍氏真杆菌属([Eubacterium]_hallii_group)和直肠真杆菌属([Eubacterium]_rectale_group)下降到 1.40%、1.94%和 2.39%,乳杆菌属(Lactobacillus)下降至 0.99%,链球菌属(Streptococcus)是上升至 3.72%,巨单胞菌属(Megamonas,0%)下降,肠球菌属(Enterococcus,0.2%),罗斯氏菌属(Roseburia,1.17%)增加。拟杆菌门相对丰度上升到 21%,拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella_9)上升到 14.48%和 6.52%。放线菌门(5.68%),双歧杆菌属(Bifidobacterium)下降到 3.82%,肠杆菌属下降到 1.86%。
相较于干预 V2 期,菌片干预六个月后,厚壁菌门(44.8%)含量继续下降,包括栖粪杆菌属(Faecalibacterium,6.32%)、布劳特氏菌属(Blautia,11.5%),罕见 小 球 菌 属 ( Subdoligranulum,1.64% ) , 霍 氏 真 杆 菌 属( [Eubacterium]_hallii_group ,1.80% ) , 直 肠 真 杆 菌 属([Eubacterium]_rectale_group ,1.76%),丁酸弧菌属(Anaerostipes,2.66%)均有所减少,罗斯氏菌属(Roseburia,0.43%)和毛螺菌属(Lachnospira,0.45%)有显着减少(P<0.05),肠球菌属(Enterococcus)上升至 6.59%,链球菌属(Streptococcus)持续上升至 2.43%,乳杆菌属(Lactobacillus)持续下降到 0.51%,巨单胞菌属(Megamonas,1.02%)增加,罗斯氏菌属(Roseburia,0.43%)减少。拟杆菌门下降至 17.57%,拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella_9)均有所下降,下降为 13.21%和 4.36%。放线菌门(7.78%)增加,包括双歧杆菌属(Bifidobacterium)增长到 6.98%和肠杆菌(Escherichia-Shigella)持续下降至 1.16%。
综上所述,普氏菌属(Prevotella_9)、拟杆菌属(Bacteroides)、布劳特氏菌(Blautia)、栖粪杆菌属(Faecalibacterium)、丁酸弧菌属(Anaerostipes)为健康人肠道内普遍存在的菌群属,在口服益生菌片剂期间都有所增加,双歧杆菌属(Bifidobacterium)、肠球菌属和链球菌属为肠道有益菌在干预时期有所增加,乳杆菌属持续减少。
(4)群落 Heatmap 图。
Heatmap 图是以颜色梯度来表征二维矩阵或表格中的数据大小,并呈现群落物种组成信息。一般基于物种或样本间丰度的相似性进行聚类分析,并将结果展现在群落 heatmap 图上,这使高丰度和低丰度的物种分块聚集,分类明显,不同分组(或样本)在各分类水平上的群落组成的相似性和差异性可以通过相似程度与颜色变化来反映。群落 Heatmap 图,热图下侧和右侧分别为样本名称和 OTU 编号(或者物种名称),如果进行了聚类分析左侧和上侧分别为物种聚类树和样本聚类树。热图中颜色的深浅分别代表 OTU(或者物种)丰度的高低。

Heatmap 图是以颜色梯度来呈现菌群中的物种组成信息,颜色的变化和相似程度体现了不同样品中菌群组成的差异性和相似性。通过 Bar 图分析了服用益生菌片剂不同时期组血液透析患者肠道菌群的组成(见图 3-6),接着利用群落 Heatmap图(见图 3-7)来观察三个不同时期 20 名血透患者菌群结构的变化和差异性,并在科分类水平上运用 Students ’ T 检验分析不同处理组间的差异物种,Heatmap图中,基线 V0 到干预 V6 红色快和绿色快大部分呈缓慢变化趋势,也有变化较大的色块,尤其是以 Phyllobacteriaceae( P=8.007E-09<0.01)、Alcaligenaceae(P=0.04384<0.05)为代表(见图3-4A)。干预V2期中红色色块代表Bacteroidaceae、Nocardiaceae、Verrucomicrobiaceae、Fusobacteriaceae、Prevotellaceae 色块颜色加深 , 相 对 丰 度 上 升 , 占 比 提 高 , 绿 色 色 块 代 表 Family_XIII 、norank_o__Mollicutes_RF9、Bacteroidales_S24-7_group 色块颜色加深,相对丰度下降, 占比减少。干预 V6 组中以为 Bifidobacteriaceae、Bacteroidales_S24-7_group、Verrucomicrobiaceae、Fusobacteriaceae、Enterococcaceae 代表的红色色块颜色加深,相对丰度上升, 占比提高。
Heatmap 图通过颜色梯度变化直观地显示了服用益生菌片剂不同时期组血液透析患者肠道菌群结构的差异,干预 V2 组的色块颜色和干预 V6 组都有所变化,说明口服益生菌片剂两个月促进肠道菌群结构的变化。从图 3-4B 可以看出,与基线 V0 组的 20 名血透患者肠道菌群相比,口服益生菌片剂六个月后,血透患者肠道中 Phyllobacteriaceae(P=8.007E-09<0.01)相对丰度显着下降,肠球菌属Enterococcus 比例下降(2.0%下降至 1.2%),未分类拟杆菌 Bacteroidales_S24-7(P=0.04<0.05)比例显着降低,拟普雷沃菌 Alloprevotella 比例下降(P=0.054),葡萄球菌 Staphylococcus 比例下降(2.16%下降至 0.03%)。
3.3.3.4 样本比较分析。
(1)PLS-DA 分析。
PLS-DA(Partial Least Squares Discriminant Analysis),即偏最小二乘法判别分析,是多变量数据分析技术中的判别分析法,经常用来处理分类和判别问题。通过对主成分适当的旋转,PLS-DA 可以有效的对组间观察值进行区分,并且能够找到导致组间区别的影响变量。
利用 Alpha 多样性分析初步证明了以口服益生菌片剂服用时期不同为分组对菌群多样性无明显关联,本实验接着进行样本分组分析,利用基于 OTU 水平下的PLS-DA 分析来比较口服益生菌片剂的不同时期为分组,对筛选的 20 名血液透析便秘患者的肠道微生物群落组成的差异进行分析。如图所示:样本分组分析通过比较样品间进化信息的差异得到距离矩阵,直观显示不同样品中微生物群落在进化上的差异性。基于 OTU 水平下的 PLS-DA 分析在特定的进化谱系中挖掘影响环境样品菌落组成差异的潜在主成分,PLS-DA 图,样本点的空间距离代表样本间的距离。
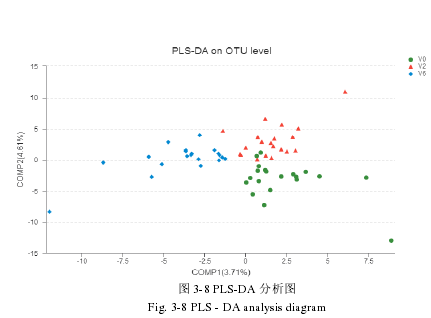
如图 3-8 所示,PLS-DA 分析比较了未服用益生菌片剂 V0 期和服用益生菌片剂两个月 V2 期和服用益生菌片剂六个月 V6 期血液透析患者肠道菌群组成的差异。COMP1(3.71%)和 COMP2(4.61%)是总变异中权重最高的两个主成分,散点的分布显示样本发生不明显的区分,与未服用益生菌片剂 V0 期相比,服用益生菌片剂两个月 V2 期和服用益生菌片剂六个月 V6 期血液透析患者菌群结构差异较小,都集中在 COMP1 轴中侧偏左处。此外,在 COMP2 轴上,服用益生菌片剂两个月 V2 期和服用益生菌片剂六个月 V6 期样品左右分布,说明口服益生菌片剂对肠道菌群起到了调节作用不明显,而两组样本的点有个别交互的现象,可能是由于选择人群的个体有较大差异的情况下对肠道菌群的影响具有局限性,所以服用益生菌片剂的两个时期的菌群结构存在一定的共性。结果表明口服益生菌片剂调节肠道菌群结构效果不明显。
3.3.3.5 物种差异分析。
物种差异分析根据得到的群落丰度数据,运用相关的分析方法进行分析,检测不同组(或样本)微生物群落表现出的丰度差异。 物种差异性分析模块的内容包括:组间差异显着性检验、Lefse 多级物种差异判别分析。
组间显着性差异检验根据得到的群落丰度数据,运用严格的统计学方法,对不同组(或样本)微生物群落之间的物种进行假设检验,评估物种丰度差异的显着性水平,获得组(或样本)间显着性差异物种。该分析可在不同分类学水平下进行。
(1)多组比较。
多组样本指大于 2 组以上样本之间物种的差异比较一般采用以下方法:
① one-way ANOVA,又称单因素方差分析,可用于检验多组样本的均值是否相同。通过此分析可以比较物种在 3 组或 3 组以上样本组中的分布是否存在显着性差异,同时对有差异的特征进行 post-hoc 检验多组中存在差异的样本组。
② Kruskal_Wallis 秩和检验,简称克氏秩和检验,它是一个将两个独立样本的 wilcox 秩和检验推广到 3 个或更多组检验的方法。是多组(大于等于 3)独立样本非参数检验的一种方法。该分析可以对多组样本的物种进行显着性差异分析,并对 P 值计算假发现率 q 值,单物种比较柱形图,纵坐标表示不同分类水平下的物种名,横坐标表示该样本的某一物种丰度的百分数数值,不同颜色表示不同分组。

如图 3-9 所示,在属水平下进行基线 V0 期与干预 V2、V6 期的三组的肠道菌群群落进行比较分析。布劳特氏菌属(Blautia)、Faecalibacterium、胃瘤球菌属([Ruminococcus]_torques_group)干预 V2 期增加,三组比较呈减少趋势;普雷沃氏菌属(Prevotella_9)在干预 V2 期增加,且三组比较有所增加;双歧杆菌属(Bifidobacterium)干预 V2 期减少,干预 V6 期增加,三组比较呈增加趋势;Anaerostipes 、 直 肠 真 杆 菌 属 ([Eubacterium]_rectale_group) 、 霍 氏 真 杆菌 属([Eubacterium]_hallii_group) 、 埃 希 菌 属 (Escherichia-Shigella) 、 纺 锤 链 杆 属(Fusicateibacter)三组比较呈逐渐减少趋势;链球菌属(Streptococcus)干预 V2 期增加,干预 V2 到干预 V6 期减少,三组比较无变化;Ruminococcus_2 干预 V2 期减少,干预 V6 期无变化,总体减少;Subdoligranulum 干预 V2 期减少,干预 V6 期增加,总体减少;Enterococcus 干预 V2 期无变化,干预 V2 到干预 V6 期增加,总体 增 加 。 可以 表 明口 服 益 生菌 片 剂 第二 个 月布 劳 特 氏菌 属 (Blautia) 、Faecallbacterum 、 胃 瘤 球 菌 属 ([Ruminococcus]_torques_group) 、 拟 杆 菌 属(Bacteroides)、普雷沃氏菌属(Prevotella_9)、双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)增加,第六个月有所维持或减少,干预 V2 期和干预 V6 期相比有效果,但三组肠道菌群比较均无显着性差异,说明益生菌片剂对干预 V6 期血液透析患者肠道菌群的调节作用不明显,导致三组比较无显着差异菌。
(2) 两组比较。
选择的两组样本之间物种的差异比较一般采用以下 3 种方法:
T 检验,又称 Student’s t-test(equal variance)、 Welch T 检验 (方差不等),又称 Welch’s t-test(unknow variance)和 wilcox 秩和检验(Wilcoxon rank-sum test),也叫曼-惠特尼 U 检验(Mann–Whitney U test),这些分析可以对两组样品的物种进行显着性差异分析,并对 p 值进行多种方法的校正,多物种差异检验柱形图,纵坐标表示不同分类水平下的物种名,横坐标表示该样本的某一物种丰度的百分数数值,不同颜色表示不同分组。0.01<p<=0.05 *="" 0.001<="" p="" <="0.01" **=""p<="0.001" ***<="">。

如图 3-10-1 所示,基线 V0 期和干预 V2 期在目水平下的菌群群落显示,拟杆菌目(Bacteroidales()P<0.05)具有显着性差异.,干预 V2期拟杆菌目(Bacteroidales)水平显着提高。如图 3-10-2 所示,基线 V2 期和干预 V6 期在纲水平下的菌群群落显示,变形菌目(Alphaproteobacteria)(P<0.01)具有极大显着性差异。如图 3-10-3所示,基线 V0 期和干预 V6 期在纲水平下的菌群群落显示,β-变形菌(Betaproteobacteria)(P<0.05)具有显着性差异,蓝细菌(Cyanobacteria)(P<0.01)具有极大显着性差异差异,变形菌(Alphaproteobacteria)(P<0.01)具有极大显着性差异。
3.3.3.6 关联与模型预测分析。
(1)环境因子相关性 Heatmap 图。
采用监督式多元分析方法,引入样本环境因子信息与群落丰度进行分析,研究环境因子与物种、样本之间的相互影响的关联关系。可以用热图直观的展现数值矩阵,相关性热图,热图的 X 轴和 Y 轴分别为环境因子和物种(或 OTU),通过计算获得 R 值和 P 值。R 值在图中以不同颜色展示,热图右侧色卡是不同 R 值的颜色分区。0.01<p<=0.05 *="" 0.001<="" p="" <="0.01" **="" p<="0.001"***<=""> 。

如图 3-11 所示,蓝细菌门(Cyanobaceria)和透析时间(time)呈显着负相关;疣微菌门(Verrucomicrobia)与水分含量(MC)和乙酸含量(Acetic)呈显着负相关,与 pH、肾病类型(type)和异戊酸含量(Isovaleric)呈显着正相关;拟杆菌门(Bacteroidetes)与尿酸(UA)呈显着负相关,与 pH 呈显着正相关;unclassified_k_norank、黏胶球形菌门(Lentisphaere)与透析时间呈显着负相关;互养菌门(Synergistetes)与尿素(UREA)和 pH 均呈显着正相关;柔膜菌门(Tenericutes)与透析时间(time)、乙酸含量(Acetic)和丙酸含量(Propionic)均呈显着负相关;变形菌门(Proteobacteria)与丁酸含量(Butyric)呈显着负相关,与肾病类型(type)呈显着正相关;梭杆菌门(Fusobacteria)与透析时间(time)呈显着正相关;放线菌门(Actinobacteria)与异丁酸含量(Isobutyric)呈显着负相关;另外 WS6、Saccharibacteria、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)与透析时间(time)、水分含量(MC)、丁酸含量(Butyric)、乙酸含量(Acetic)、丙酸含量(Propionic)、尿素(UREA)、肌酐、尿酸(UA)、pH、肾病类型(type)、年龄、异丁酸含量(Isobutyric)和异戊酸含量(Isovaleric)均无明显相关性。
(2)Random Forest 分析。
随机森林(Random Forest)属于机器学习算法,是一个包含多棵决策树的分类器,它的分类结果根据检测样本的各个维度上的属性,在不同的决策树上进行判定,综合考虑所有判定结果后给出最终分类,对于分类问题结果取概率最大值,回归分析则取概率均值,它可以高效快速挑选出对样本分类最为重要的物种类别(biomarker)。
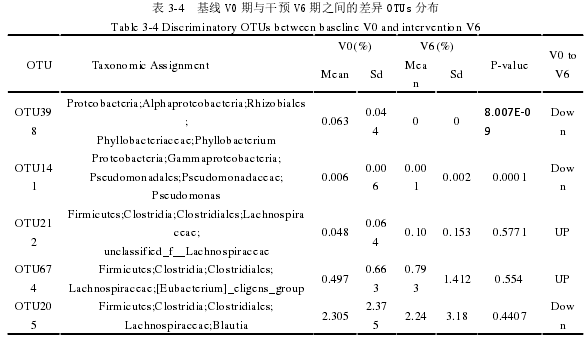
采用随机森林方法进行的 ROC 分析,通过从预测集去除 OTU 引起误差的增加的多少给每一个 OTUs 评估一个重要性的得分,根据表 3-4 共得到了 5 个OTUs,其相对丰度能够可靠的鉴别口服益生菌 V6 期与基线 V0 期对照的样本。这些有差异的 OTUs 主要集中在变形菌门和厚壁菌门。
3.3.4 益生菌和肠道菌群相关性分析。
在门的水平上,近些年国内外进任的一系列人口调查实验均发现人体肠道菌群主要由硬壁菌门、拟杆菌门、变形菌门和放线菌门构成,隶属于上述四个菌门的细菌占到了人体细菌总量的 99%上虽然在口的水平上各个国家地区的人群都主要由上述四个菌口构成,但具体到属的水平上如前言部分所述,不同时期的人们肠道菌群结构便开始出现较大的个体差异性,这说明人体肠道菌群的组成是极为复杂的、在很大程度上也是受外界环境影响的。
益生菌对肠道菌群的影响是多方面的,根据其对肠道菌群影响的机制不同,可将这种影响分为直接影响和间接影响。直接影响是指人体食用酸奶或菌片等富含益生菌的产品以后,益生菌能直接影响肠道菌群的结构。间接影响是指摄入益生茜以后,益生菌会对肠道菌群的代谢如短链脂肪酸的代谢和总胆汁酸代谢,肠道细菌酶活力,肠道内矿物质的吸收等产生影响。益生菌的摄入对体内肠道菌群的结构产生影响。大量研巧表明,通过口服益生菌的方式可快速改变宿主肠道菌群的结构。这可能是由于人们在摄入富含益生菌的产品后,大量活性益生菌被直接送到人体肠道中,从而使肠道菌群的构成在短时间内产生了较大的变化。除此之外,益生菌进入肠道后会通过代谢作用,杀灭一部分致病茜、并促进部分有益菌的生长,这也会在一定程度上改变宿主肠道菌群的构成[76][92–95。
3.3.5 肠道菌群和短链脂肪酸相关性分析。
如图 3-3—图 3-11,表 3-3 和表 3-4 所示,肠道是人体最重要的新陈代谢器官,肠道菌群直接的影响到人体的新陈代谢。肠道菌群最主要的功能就是通过发酵碳水化合物实现能量的废物利用,例如发酵难消化的食物残羹(植物细胞壁,纤维素和低聚糖),粘蛋白侧链和脱落的上皮细胞。除了能量的废物利用,肠道微生物还利用产生的短链脂肪酸,发酵产生气体(氢气、二氧化碳和甲烧)和生物量,这些都直接影响肠道的生理机能。肠道微生物的成分也用来合成某些族和族的维生素并能影响上皮细胞的表达,此外,它们还通过代谢外源物质来保持氦基酸的内稳态,并影响药物的功效,这些都大大增强了宿主防御外源物质的能力。
其中,肠道微生物在人体结肠中通过发酵食物产生了人体所必须的短链脂肪酸主要有三种脂肪酸:乙酸、丙酸、丁酸。脂肪酸给细胞提供能量(乙酸供给肌肉,丙酸供给肝脏,丁酸供给结肠细胞),影响结肠代谢,控制上皮细胞的增值和变异。被鉴定为具有短链脂肪酸产生功能的劳特氏菌属(Blautia)、梭菌属(Clostridium)、考拉杆菌属(Phascolarctobacterium)、罗斯氏菌属(Roseburia)和罕见小球菌属(Subdoligranulum),栖粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)。在肠道中主要的代谢产物为短链脂肪酸的菌属及其代谢产生的短链脂肪酸的种类参见表 3-5:

3.4 本章小结。
益生菌干预便秘改善,从粪便短链脂肪酸的测定和 16s 高通量菌群测序结果分析来看,研究结果表明 V0 和 V2 期的乙酸含量、丙酸含量有显着性差异(P<0.05),V2 期和 V6 期的丁酸含量有显着性差异(P<0.05),其它均无显着性差异;肠道内的优势菌门是厚壁菌门和拟杆菌门,厚壁菌门持续减少,厚壁菌门大部分是专性厌氧菌,维持肠道正常的营养、代谢及免疫功能,而拟杆菌门增加,以往研究发现,血液透析会改变厚壁菌门的生存环境,利于拟杆菌门细菌生存和繁殖。干预 V2 期的双歧杆菌属 Bifidobacterium 下降到 3.82%。乳杆菌属丰度下降,链球菌属(Streptococcus)是上升至 3.72%,巨单胞菌属(Megamonas,0%)下降,罗斯氏菌属(Roseburia,1.17%)增加。到干预 V6 期双歧杆菌属 Bifidobacterium 增长到6.98%,肠球菌属(Enterococcus)上升至 6.59%,链球菌属(Streptococcus)持续上升至 2.43%,乳杆菌属(Lactobacillus)持续下降到 0.51%,巨单胞菌属(Megamonas,1.02%)增加,罗斯氏菌属(Roseburia,0.43%)减少。双歧杆菌属和肠球菌属丰度在干预六个月增加较多,而其他肠道有益菌无较大改变。在干预期间变形菌门丰度上升,肠道内有害菌增加不明显,导致肠屏障功能受损。而蓝细菌、互养菌门、黏胶球形菌门对健康和疾病的影响未知,需要进一步研究明确。
口服益生菌片剂六个月对肠道菌群改善来看,肠道内的有益菌增多但有害菌或肠道其他环境并无较大抑制作用。





