
副溶血弧菌( Vibrio parahaemolyticus,简称 VP菌) 是一种革兰氏阴性弧菌,主要分布于海水、海河交界处及海产品中。人们食用被其污染的食物后,很可能会引起以发热、腹泻、呕吐等为主要症状的急性胃肠炎,严重者可引起脱水、休克,甚至死亡。VP 菌可以游离于海水环境,也可以在固相表面形成生物膜,生物膜是其适应不利环境而采取的主要生存策略。生物膜形成受密度感应( Quorum sensing,QS) 系统和 c-di-GMP 信号通路的调节。QS 是一种密度依赖性的细胞间信号传递机制。
在这一机制中,细菌通过合成、分泌及感应自诱导因子,并通过一系列的级联信号传导,最终开关 QS 系统核心调控子的表达,核心调控子进而再调节细菌的运动、生物膜形成和毒力因子表达等。VP 菌能分泌 3 种自诱导因子 HAI-l、AI-2 及 CA-l,它们与受体蛋白结合,在 Qrr sRNAs 的参与下,调节核心调控子 OpaR 和 AphA 的表达。在高密度时,OpaR起核心调节作用,它能抑制毒力因子( T3SS) 的表达和在固相表面的爬动能力( laf),而促进荚膜多糖( CPS) 的合成。在固相表面的爬动是生物膜形成的起始步骤,而 CPS 是生物膜基质的主要成份之一; 在低密度时,AphA 起核心调节作用,表型结果显示它能促进毒力因子的表达和生物膜形成,但是其分子机制还未被阐明。
c-di-GMP 是一个普遍存在的第二信使分子,能促进细菌生物膜的形成。c-di-GMP 的分子代谢受GGDEF 和 EAL 结构域的调节。GGDEF 具有鸟苷酸环化酶活性,能以 GTP 为底物催化合成 c-di-GMP;而 EAL 具有磷酸二酯酶活性,能使 c-di-GMP 降解成 GMP。VP 菌有 50 多个蛋白参与 c-di-GMP 的分子代谢( 含有 GGDEF、EAL 或二者兼有) ,包括ScrC和 ScrG,二者均兼具 GGDEF 和 EAL 结构域。ScrC 由操纵子 scrABC 编码,ScrA 产生 S 信号,ScrB 感应这种信号并与 ScrC 相互作用,使得 ScrC表现出 EAL 的磷酸二酯酶活性,并降解 c-di-GMP,抑制 CPS 的合成,而激活 laf 的表达。ScrG也主要表现为磷酸二酯酶活性,并发挥与 ScrABC相似的功能。Scr 通路是 VP 菌生物膜形成的另一信号传导途径,它是否与 QS 系统相关联,目前还未见报道。
在本研究中,我们首先利用表型实验( 褶皱和结晶紫染色) 验证了 AphA 能促进 VP 菌生物膜形成,进而利用 HPLC-MS/MS 的方法测定了野生株和aphA 突变株中 c-di-GMP 的含量,最后利用实时定量 RT-PCR、LacZ 和 EMSA 等实验技术,证明了AphA 能通过间接抑制 scrABC 和 scrG 的转录表达而促进 c-di-GMP 的合成,进而增强 VP 菌生物膜形成。
1、 材料和方法
1. 1 材料
1. 1. 1 菌株和质粒: VP 菌 RIMD2210633 株( 野生型,WT) 及其 aphA 突变株( ΔaphA) 、重组质粒 scrA: :pHRP309 和 scrG: : pHRP309 ( pHRP309 质粒无启动子区的 β-半乳糖苷酶基因上游分别克隆入 scrA 和scrG 的启动子区序列,庆大霉素抗性) 均由本实验室保存。
1. 1. 2 主要试剂: TRIzol Reagent 为 Invitrogen 产品; Taq DNA 连接酶、dNTPs 为 Fermentas 产品; PCR产物纯化试剂盒为 QIAGEN 产品; LightCycler?480SYBR Green Master 为 Roche 产 品; Micro BCAProtein Assay Kit 为 Thermo 产品; DNA-freeTMKit 为Amibion 产品; M 肉汤( Difco Marine,DM) 和 HI 肉汤( 2. 5% Bacto heart infusion) 购自 BD Bioscience。
1. 2 细菌培养
VP 菌培养方法分为预培养和正式培养。预培养: 取 20 μL 甘油菌种接种于 15mL 的 HI 肉汤培养基中( 50 mL 的三角烧瓶,下同) ,37℃下 200 r/min培养至平台期( 12 -14 h) ,而后按 1∶ 50 稀释接种至15 mL 新鲜的 HI 肉汤中,37℃ 下 200 r / min 培养至OD620大约为 1. 4。正式培养: 将预培养物按 1∶ 1000稀释接种至 15 mL 新 鲜 的 HI 肉 汤 中,37℃ 下200 r / min培养至 OD620大约为 0. 15,收集菌体,备用。
1. 3 菌落表面褶皱
将 1. 2 中预培养物按 1∶ 50 稀释接种至 3mL 的M 肉汤中( 试管) ,30℃ 静止培养 4 d 后,取 1. 5 μL滴加于 HI 平板( 2. 5% Bacto heart infusion + 1. 5%琼脂) 的表面,每株菌至少 3 个菌落的重复,37℃下静置培养,48 h 后拍正面照。
1. 4 结晶紫染色
将 1. 2 中预培养物按 1∶ 50 稀释接种至 2 mL 的M 肉汤中( 试管培养,3 个重复) ,置 30℃ 下 100 rpm培养 48 h。小心的倒出液体培养物,将附着于试管壁的菌膜用去离子水洗涤3 次,干燥后加入3 mL 的0. 1% 结晶紫溶液,常温染色 30 min,再用去离子水洗涤 3 次。晾干试管,并拍照,根据结晶紫染色的强弱即可判定生物膜的形成量。
1. 5 c-di-GMP 测定
取10 mL 的1. 2 中正式培养物,收集菌体,用细菌裂解液( 甲醇∶ 乙腈∶ 水 = 40∶ 40∶ 20) 提取 c-di-GMP。利用色谱串联质谱 ( HPLC-MS / MS ) 的方法,分别检测每 mL 的细菌培养物中 c-di-GMP 的pmoL 量。同时,利用 Micro BCA Protein Assay Kit,按说明书提供的方法检测每 mL 细菌培养物中 mg总蛋白量。细菌培养物中 c-di-GMP 浓度用 pmol/mg 蛋白表示。
1. 6 RNA 提取与实时定量 PCR( qRT-PCR)
细菌按 1. 2 的方法培养后,收集菌体,利用TRIzol Reagent 提取总 RNA。利用 Amibion 公司的 DNA-freeTMKit 去除总 RNA 中可能污染的 DNA,而后利用 N6 随机引物将其逆转录为 cDNA。用Roche 的 LightCycler system 作 qRT-PCR 分析。以16S rRNA 的表达量为内参绘制标准曲线,用于基因表达水平的相对定量。
1. 7 LacZ 报告基因融合试验
PCR 扩增 scrA 和 scrG 的启动子区( 引物序列见表 1) ,并分别克隆入 pHRP309 质粒的 β-半乳糖苷酶基因( 无启动子区) 的上游,得重组质粒。将重组质粒分别转入 WT 和 ΔaphA 中。细菌按 1. 2 的方法培养后,收集菌体,分别检测并比较 WT 和 ΔaphA 菌株中的 β-半乳糖苷酶活性的差异,从而判定 AphA对靶基因的调控关系,一般以 t 检验的 P < 0. 01 为判定标准。

1. 8 凝胶阻滞实验( EMSA)
PCR 扩增 scrA 和 scrG 的启动子区 ( 引物见表1) ,并纯化回收,用 T4 多聚核苷激酶( T4 PNK) 对DNA 片段 5' 末端进行标记。利用 Ni-NTA 柱法纯化 His-AphA 蛋白。将不同浓度的 His-AphA 蛋白与标记的 DNA 探针在 10 μL 结合反应体系中,室温共同孵育 20 min 后,将样品加入 4% 非变性聚丙烯酰胺凝胶中进行电泳,- 60℃放射自显影后分析结果。
2、 结果和分析
2. 1 AphA 蛋白影响 VP 菌生物膜表型
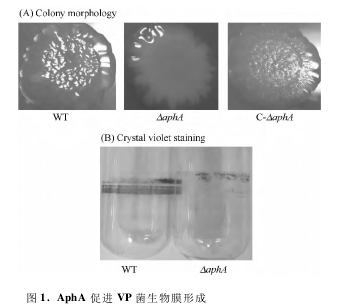
为了研究 aphA 缺失后对 VP 菌生物膜形成能力的影响,我们对 WT 和 ΔaphA 菌株做了表型分析。图 1-A 为菌落褶皱实验结果,可以看出:ΔaphA 的菌落形态要比 WT 光滑的多,当把 aphA回补到 ΔaphA 菌株后( C-aphA) ,C-aphA 菌落形态又重新变得褶皱,这表明 AphA 能促进胞外多糖( EPS) 的合成; 图 1-B 为结晶紫染色实验结果,可以看出: ΔaphA 在试管壁的生物膜形成量明显低于 WT 的,这表明 aphA 缺失后 VP 菌在气液表面的生物膜形成能力降低。总之,AphA 能促进 VP菌生物膜的形成。
2. 2 AphA 促进 c-di-GMP 的合成
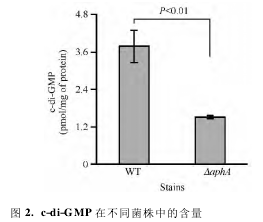
上文表明 AphA 能促进 VP 菌生物膜形成,而 c-di-GMP 是促进生物膜形成的第二信使。为了验证 AphA 是否能调节 c-di-GMP 的合成,我们利用HPL-MC / MS 的方法测定了 WT 和 ΔaphA 中 c-di-GMP 含量,其结果如图 2 所示,可以看出: ΔaphA 中的 c-di-GMP 含量明显低于 WT 中的,且二者具有显著性差异( P <0. 01) ,这表明 AphA 能促进 VP 菌 c-di-GMP 的合成。
2. 3 AphA 抑制 scrABC 和 scrG 的转录
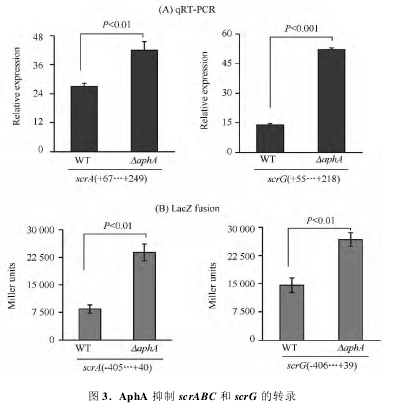
AphA 对 scrABC 和 scrG 调控的 qRT-PCR 结果如图 3-A) 所示: scrA 和 scrG 在 ΔaphA 中的相对表达量要明显高于 WT 中的,且二者具有显著性差异( P <0. 01) ,这说明 AphA 抑制 scrABC 和 scrG 的转录。进一步利用 LacZ 报告基因融合实验研究 AphA对 scrABC 和 scrG 的调控关系,其结果如图 3-B) 所示: 克隆有 scrA 或 scrG 启动子区的 β-半乳糖苷酶基因在 ΔaphA 中的转录活性( miller units) 明显高于WT 中的,且二者具有显著性差异( P < 0. 01) ,这进一步说明 AphA 能抑制 scrABC 和 scrG 的转录表达。
2. 4 His-AphA 不能结合到 scrABC 和 scrG 的启动子区
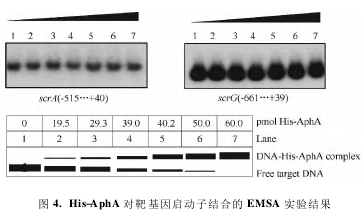
利用 EMSA 实验验证 His-AphA 是否能直接作用于 scrABC 和 scrG 的启动子区,结果如图 4 所示:当 His-AphA 蛋白量达到 60. 0 pmol 时,仍未出现阻滞条带,这已比前期研究中出现阻滞带时所用的蛋白量高出数倍,这表明 AphA 不能结合到 scrABC和 scrG 的启动子区。
3、 讨论
AphA 是弧菌属 QS 系统在低密度下的核心调控子,参与调解弧菌毒力和生物膜形成。在霍乱弧菌中,AphA 与 AphB 相互作用并激活 tcpPH 的转录表达。TcpP/TcpH 在 ToxR/ToxS 的协助下,激活毒力调控子 ToxT 的表达,ToxT 再激活 tcp( 编码菌毛)和 ctx( 编码霍乱毒素) 的转录,而使细菌表现出强毒性。AphA 还能激活 vpsT 的表达,VpsT 再激活胞外多糖基因 vps 的表达,而利于生物膜形成。VP菌 AphA 与霍乱弧菌的 AphA 高度同源,其功能也具有高度的相似性,但是其分子作用机制还未见报道。
scrABC 操纵子编码 3 种蛋白: ScrA 位于胞浆中,能产生一种称为 S 信号的信号分子,并分泌到胞外; ScrB 是位于周质的小分子结合蛋白; ScrC是一种膜结合蛋白,其 N-末端具有两个跨膜结构域,而 C-末端具有 GGDEF 和 EAL 结构域。ScrB 受ScrA 产生的 S 信号刺激,能与 ScrC 的 N-末端相互作用,促使 ScrC 表现出 EAL 结构域的磷酸二酯酶活性,降解 c-di-GMP,抑制 cps 而激活 laf 的表达,使细菌趋于游离; 当细胞中只存在 ScrC 时,GGDEF 结构域的活性占主导地位,并能促进 c-di-GMP 和 cps合成,抑制 laf 的表达,细菌趋于形成生物膜。由于scrC 和 scrAB 位于同一操纵子,ScrA、ScrB 和 ScrC 总是同时存在,因此在生理条件下 ScrC 主要表现出EAL 结构域的活性,参与降解 c-di-GMP 和抑制生物膜形成。ScrG 是继 ScrC 之后,在 VP 菌中发现的第2 个同时具有 GGDEF 和 EAL 结构域的蛋白。与ScrC 一样,ScrG 也主要表现出 EAL 结构域活性,过表达 ScrG 能抑制 c-di-GMP 合成和 ΔscrABC 的表型特征。但是当 ScrG 的 EAL 结构域突变后,GGDEF结构域也具有酶活性,但是其影响 c-di-GMP 代谢机制还不清楚。
本文中,我们利用 HPLC-MS/MS、褶皱和结晶紫染色实验证明了 AphA 能促进 VP 菌 c-di-GMP 的合成及生物膜形成,随后的实时定量 RT-PCR 和 LacZ报告基因融合实验结果表明 AphA 是通过抑制 scrG和 scrABC 的转录表达来促进 c-di-GMP 的合成,进而促进生物膜形成,这表明 Scr 通路调解 VP 菌生物膜形成并不是孤立于 QS 系统之外的。但是体外的EMSA 实验结果显示 AphA 与 scrABC 或 scrG 的启动子区并无直接的相互作用,这表明 QS 系统与 Scr 通路可能还具有其他的联系方式。在低密度生长时,AphA 能抑制 opaR 的转录表达,OpaR 是 QS 系统在高密度下的核心调控子,其识别基序为一个反向互补重复序列“TATTGATAAATTTATCAATA”,而在 scrABC 和 scrG 的启动子区分别有一段碱基序列“TATAGATAAAACTATTATTA”和“TAATGAGTAT-TCAGTCAATTA”与基序非常相似,这表明 OpaR 极可能对 scrABC 和 scrG 具有直接的调节作用。AphA可能是通过抑制 OpaR 或者其他未知调控子的表达来间接抑制 scrABC 和 scrG 的转录表达,进而促进VP 菌生物膜形成的,在后续的研究中我们将验证这一推测。





