线 粒 体 超 氧 化 物 歧 化 酶2(mitochondrialsuperoxide dismutase,SOD2)属于金属过氧化物歧化酶家族成员,是真核生物中的主要抗氧化酶,其在胞浆内合成,移至线粒体发挥作用,在清除细胞活性氧化物中起重要作用。有研究显示:过氧化物和辐射等刺激能够诱导SOD2基因的表达,且SOD2可 以 起 到 对 肿 瘤 细 胞 的 抑 制 作 用。研究表明:
SOD2基因在细胞内过表达时能有效保护细胞免受氧化应激的损伤,而SOD2基因缺失的小鼠可出现皮肤及免疫系统衰老的征象,提示其在细胞的抗氧化保护中起重要作用。研究发现:
SOD2基因在人脐静脉内皮细胞 (human umbilicalvein endothelial cells,HUVEC)中呈弱表达,本研究构建pcDNA3.0-SOD2重组质粒,观察SOD2基因在HUVEC中的表达情况,并采用荧光定量PCR方法检测其差异性表达,旨在为SOD2基因功能研究奠定基础。
1材料与方法
1.1 菌株、载体及细胞 大肠杆菌 DH5α购于大连宝 生 物 工 程 有 限 公 司,pcDNA3.0质 粒 购 于Invitrogen公司,HUVEC为吉林大学基础医学院病理生物学教育部重点实验室保存。
1.2 主要试剂 Pfu高保 真DNA聚合酶、T4DNA连 接 酶、AMV逆 转 录 酶、Trizol试 剂、DL2000DNA Marker及DNA Markerλ-EcoT14购自大连宝生物工程有限公司;EcoRⅠ和Xho Ⅰ内切酶购自北京纽英伦生物技术有限公司;凝胶回收试剂盒购自北京天根生化科技有限公司;质粒提取试剂购自Oxygen公司;Lipofectamine 2000购自Invitrogen Life Technologies(Carlsbad,USA)。
1.3 引物设计根据NCBI关于人SOD2编码序列设计引物。为了定向克隆的方便,在上游引物和下游引物分别引入了EcoRⅠ和Xho Ⅰ酶切位点,引物序列如下:
Forward,5′-ACGTACCGGTAT-GTTGAGCCGGGCAGTGTGCG-3′;Reverse,5′-ACGTGAATTCTTACTTTTTGCAAGCCATGT-ATCTTTC-3′;隆片段为681bp。引物由上海生物工程公司合成。
1.4 细胞培养 HUVEC用含10 %胎牛血清的IMDM培养基置于37℃孵育箱中培养。
1.5细胞总 RNA 提取应用Trizol试剂按厂家说明书提取细胞总RNA;用酶标仪于260和280nm波 长 处 测 定 吸 光 度 (A)值,分 别 根 据A260值及A260/A280比值确定RNA浓度和纯度,根据凝胶电泳确定RNA样品的完整性。
1.6 逆转录 (RT)反应 应用逆转录试剂盒按厂家说明书进行RT反应,合成第一股cDNA。
1.7 PCR 扩增获取人 SOD2 编码区应用PfuDNA聚合酶反应体系按厂家说明书对上述获得的cDNA进行PCR扩增。扩增程序为:94 ℃预变性2min;94℃变性30s,62℃退火30s,72℃延伸1min,35个循环;72 ℃延伸5min。PCR结束后每管取5μL加入6×loading buffer 1μL,混匀,上样,1.5%琼脂糖凝胶电泳检测PCR产物。用紫外凝胶成像仪对PCR产物电泳条带进行扫描照相。
1.8 pcDNA3.0-SOD2重组质粒的构建按照凝胶回收试剂盒说明书,对RT-PCR产物电泳的目的条带进行回收。回收的SOD2片段与pcDNA3.0真核表达载体一起用EcoR Ⅰ和XhoⅠ双酶切,T4连接酶连接,克隆至pcDNA3.0载体中。连接体系如下:
1μL RT-PCR产物,1μL pcDNA3.0质粒,ddH2O 19.5μL,混匀。45℃、5 min,冰上1min,加入2.5μL DNA Ligase Buffer、1μLT4DNA Ligase后,16℃过夜连接。取100μLDH5α感受态细胞,加入5μL连接产物,混匀后冰浴30min,42℃热击90s,冰浴2min,加入900μL LB培养基,37℃温和振荡复苏细胞1h,取100μL转化产物涂布于含氨苄霉素的LB平板上,37℃孵箱倒置培养20h,观察菌落生长情况。
1.9菌落PCR 鉴定重组阳性克隆 25μL反应体系中 加 入Pfu Taq DNA聚 合 酶MIX混 合 物12.5μL,上、下游引物各1μL,加灭菌双蒸水至25μL,用灭菌牙签挑取单个圆滑菌落少许点入反应体系中。PCR反应条件:94 ℃预变性2 min;94℃变 性30s,62 ℃退 火30s,72 ℃延 伸1min,30个循环;72℃延伸5min。PCR结束后每管取5μL加入6×loading buffer 1μL,混匀,上样,1.5%琼脂糖凝胶电泳检测PCR产物。用紫外凝胶成像仪对PCR产物电泳条带进行扫描照相。
1.10 pcDNA3.0-SOD2质粒双酶切质粒提取:
取PCR鉴定含有重组质粒的单一克隆,接种到含50mg·L-1氨苄霉素的LB液体培养基中,37℃、220r·min-1培养过夜。按照Axygen质粒提取试剂盒说明书进行质粒提取。将提取的pcDNA3.0-SOD2质粒进行EcoR Ⅰ和XhoⅠ双酶切反应,取5μL酶切产物进行1%琼脂糖凝胶电泳,紫外灯下观察照相。
1.11 pcDNA3.0-SOD2序 列 测 定测 序 物 为pcDNA3.0-SOD2重 组 质 粒, 引 物 为 通 用 引 物PCDNAT7,测序结果与GenBank中的SOD2序列进行对比。
1.12 pcDNA3.0-SOD2重组质粒转染 HUVEC按照Lipofectamine 2000试 剂 转 染 说 明 书 进 行24孔板贴壁细胞的转染。转染后6h换IMDM培养液,细胞继续培养。
1.13 RT-PCR 检测转染后 HUVEC 中 SOD2基因表达提取细胞总RNA,进行RT-PCR反应。PCR产物经1.5%琼脂糖凝胶电泳,照相分析。
2结果
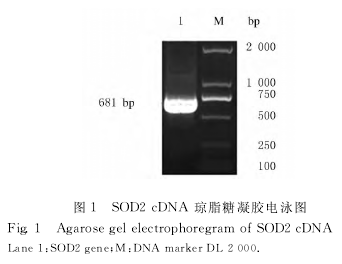
2.1 SOD2编码区 DNA 片段的扩增从HUVEC提取的总RNA经鉴定其纯度和完整性均 较好,RT-PCR扩增产物凝胶电泳得到约681bp的DNA条带,即基因SOD2编码序列CDS(669bp)加上两端酶切位点的片段长度,与预期扩增片段大小相符 (图1)。
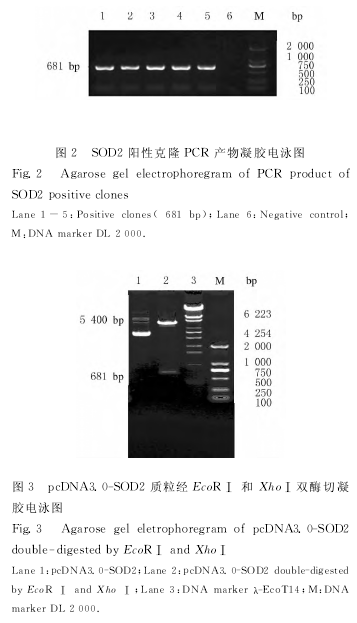
2.2 pcDNA3.0-SOD2表达载体的筛选应用对菌落的直接PCR扩增法筛选阳性克隆,以菌落上的少许菌体直接作为模板进行PCR扩增,经电泳分析发现:选取的5个菌落可见到681bp大小的阳性条带 (图2),与预期片段大小一致,推测此克隆即为含有SOD2基因插入片段的阳性克隆。
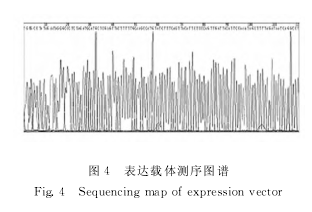
2.3 重组质粒pcDNA3.0-SOD2的双酶切鉴定选取阳性克隆提取质粒DNA,并进行EcoRⅠ和XhoⅠ双酶切鉴定,结果见到681bp的条带和载体片段 (图3),此克隆为插入有SOD2基因的重组质粒。
2.4 表达载体的最终鉴定将构建的表达载体送上海英骏生物技术有限公司进行测序分析,测序的部分图谱见图4,结果表明测序反应完全可靠。DNA测序结果见图5,表达载体包含SOD2全长编 码 区 的669核 苷 酸 序 列, 与GenBank(NM-000636)报道结果完全一致。
2.5 转染重组质粒的 HUVEC中SOD2的表达将重 组 质 粒pcDNA3.0-SOD2转 染HUVEC后,在37℃、5% CO2条件下培养24h,加入G418筛选 有 抗 性 的 克 隆 细 胞。 收 获 转 染 重 组 质 粒pcDNA3.0-SOD2的HUVEC和空载对照组细胞,提取总RNA,经过反转录得到cDNA,然后以其为模板进行PCR扩增,电泳分析结果表明:与呈弱阳性条带的对照组比较,转染组细胞的目的条带清晰可见。见图6。
3讨论
SOD是机体内重要的抗氧化酶之一,能够催化超氧化物通过歧化反应转化为氧气和过氧化氢。
在人和哺乳动物中,SOD分为:
FeSOD(SOD1),存在于细胞内质网;MnSOD(SOD2),位于线粒体 中 ;Cu ZnSOD(SOD 3),为 细 胞 外 基 质 超 氧 化物酶。SOD2编码的锰超氧化物歧化酶可以与氧化磷酸化作用的超氧化物副产物结合,从而将线粒体中产生的超氧离子清除,产生氧化能力相对较弱的过氧化氢。
HUVEC是较易受到氧化损伤的一类细胞,在环境及药物的持续刺激下,该细胞会呈现一定的 氧 化 损 伤 继 而 发 生 凋 亡。本 研 究 发 现:
SOD2在HUVEC中 呈 弱 表 达。 超 氧 阴 离 子(O2-)、过氧化氢等活性氧能引发多种病理效应,导致 癌 症、 过 敏、 动 脉 硬 化 和 老 年 痴 呆 等 疾病。 研 究发 现: 过 氧 化 物 和 超 氧 化 物(ROS)等能够诱导SOD2基因的转录,从而使低浓度的活性氧自动被机体清除。当机体暴露于高水平的活性氧环境中时,由于线粒体中的DNA无组蛋白的保护和有效的DNA修复系统,因此很容易引起氧化损伤,并最终导致癌症的发生。鉴于环境中辐射、氧化及生物体衰老等氧化应激反应的不可避免性,且机体正常情况下SOD2表达相对SOD1较低,在人体正常细胞,尤其易受到氧化损伤的内皮细胞过表达SOD2便显得尤为重要。对于SOD基因的研究已经用于防辐射、防缺血再灌注、抗自身免疫性疾病、抑制肿瘤和癌症等方面。
对于SOD2基因研究的生物学效应也很广泛,但SOD2基因在抗氧化及抗肿瘤中的具体作用途径及机制尚有待进一步探讨。随着人们对氧化应激机制研究的不断探索,SOD2基因也日益广泛地受到关注。本实验克隆了SOD2DNA编码区序列,构建了pcDNA3.0-SOD2真核表达载体,并能在真核细胞中过表达,本研究结果为进一步的体内研究及基因治疗创造了条件,为研究SOD2在氧化应激相关疾病发生发展中的作用奠定了基础。
[参考文献]
[1]Ni S,Yu Y,Zhang Y,et al.Study of oxidative stress inhuman lens epithelial cells exposed to 1.8GHz radiofrequencyfields[J].PLoS One,2013,8(8):e72370.
[2]Ji G,Lv K,Chen H,et al. MiR-146a regulates SOD2expression in H2O2stimulated PC12cells[J].PLoS One,2013,8(7):e69351.
[3]Yu YX,Gu ZL,Yin JL,et al.Ursolic acid induces humanhepatoma cell line SMMC-7721apoptosis via p53-dependentpathway.[J].Chin Med J(Engl),2010,123(14):1915-1923.
[4]Hosoki A,Yonekura S,Zhao QL,et al. Mitochondria-targeted superoxide dismutase(SOD2)regulates radiationresistance and radiation stress response in HeLa cells[J].J Radiat Res,2012,53(1):58-71.
[5]Xu L,Emery JF,Ouyang YB,et al.Astrocyte targetedoverexpression of Hsp72 or SOD2 reduces neuronalvulnerability to forebrain ischemia[J].Glia,2010,58(9):1042-1049.
[6]Scheurmann J,Treiber N,Weber C,et al. Mice withheterozygous deficiency of manganese superoxide dismutase(SOD2)have a skin immune system with features of“inflamm-aging”[J].Arch Dermatol Res,2013,Jul 16[Epub aheadof print]
[7]Brouwer M,Hoexum-Brouwer T,Grater W,et al.Replacement of a cytosolic copper/zinc superoxide dismutaseby a novel cytosolic manganese superoxide dismutase incrustaceans that use copper(haemocyanin)for oxygentransport[J].Biochem J,2003,374(Pt 1):219-228.
[8]Hwang O. Role of oxidative stress in Parkinson’sdisease[J].Exp Neurobiol,2013,22(1):11-17.
[9]Madamanchi NR,Runge MS. Redox signaling incardiovascular health and disease[J].Free Radic Biol Med,2013,61C:473-501.
[10]Sochocka M,Koutsouraki ES,Gasiorowski K,et al.Vascular oxidative stress and mitochondrial failure in thepathobiology of Alzheimer’s disease:new approach totherapy[J].CNS Neurol Disord Drug Targets,2013,12(6):870-881.
[11]Folbergrova J,Jesina P,Nuskova H,et al.Antioxidantenzymes in cerebral cortex of immature rats followingexperimentally-induced seizures:upregulation ofmitochondrial MnSOD(SOD2)[J].Int J Dev Neurosci,2013,31(2):123-130.
[12] 郭韬,魏强.线粒体DNA突变与肿瘤发生的关系 [J].生物学通报,2009,44(11):10-12.
[13]Fukui M,Zhu BT. Mitochondrial superoxide dismutaseSOD2,but not cytosolic SOD1,plays a critical role inprotection against glutamate-induced oxidative stress and celldeath in HT22 neuronal cells[J].Free Radic Biol Med,2010,48(6):821-830.
[14]Apolloni S,Parisi C,Pesaresi MG,et al.The NADPHoxidase pathway is dysregulated by the P2X7receptor in theSOD1-G93A microglia model of amyotrophic lateralsclerosis[J].J Immunol,2013,190(10):5187-5195.
[15]Gustafsson S,Lind L,Soderberg S,et al.Oxidative stressand inflammatory markers in relation to circulating levels ofadiponectin[J].Obesity(Silver Spring),2012,21(7):1467-1473.
[16]Jia J,Xiao Y,Wang W,et al.Differential mechanismsunderlying neuroprotection of hydrogen sulfide donors againstoxidative stress[J].Neurochem Int,2013,62(8):1072-1078.