摘 要: 【目的】探究龙眼胚性愈伤组织Argonaute10(AGO10)基因的特性与龙眼生长发育、激素响应及非生物胁迫响应之间的关系。【方法】根据龙眼胚性愈伤组织转录组数据库Unigene序列,采用RT-PCR结合RACE技术,以‘红核子’龙眼胚性愈伤组织cDNA为模板,进行龙眼胚性愈伤组织DlAGO10基因的克隆和生物信息学分析,同时利用qRT-PCR技术分析DlAGO10基因在龙眼体胚发生过程中、不同组织部位中、对不同激素的响应以及非生物胁迫响应的表达情况。【结果】获得龙眼DlAGO10基因的cDNA全长序列(GeneBank登录号为MH708535),全长共3 859 bp,其中包含完整开放阅读框(ORF)3 003 bp,编码999个氨基酸。生物信息学分析表明,DlAGO10的保守结构域具有AGO的经典结构域PiWi结构,与甜橙和克莱门柚AGO10蛋白同源性较高。qPCR分析结果表明,在龙眼体胚发生过程中,DlAGO10在龙眼非胚性愈伤组织时期和子叶胚时期的表达量较高,在‘红核子’龙眼合子胚S5阶段的相对表达量最高;不同组织部位的表达情况为,DlAGO10在‘红核子’龙眼雌花中表达量最高,雄花次之,其他组织部位表达量均较低。植物激素和非生物胁迫处理下的表达分析表明,一定浓度的2,4-D、KT和水杨酸(SA)均可诱导DlAGO10上调表达,而茉莉酸甲酯(MeJA)即可上调也可下调;盐、渗透、干旱和脱落酸(ABA)胁迫均可上调DlAGO10的表达。【结论】DlAGO10可能参与龙眼体胚发生早期和晚期的转录调控过程,且可能参与生长素、细胞分裂素、SA和ABA的逆境胁迫信号转导途径,调控龙眼多种非生物胁迫应答过程。
关键词: 龙眼; 龙眼体胚发生; AGO10(Argonaute 10); 表达分析;
Abstract: 【Objective】Argonaute family proteins are highly conserved basic proteins that widely exist in the biological community and distribute in different individuals. As the core component of RNA-induced silencing complex (RISC), the Argonaute (AGO) family proteins play a crucial role in RNA interference(RNAi). In plants, the combination of AGO protein and small RNA participates in maintaining the stability of the gene, regulating the development of tissue, embryonic development, cell differentiation and responsing to hormones and stress. The objective of the current study is to discover the effection of argonaute gene in the embryogenic callus , different tissues of ‘Honghezi’ longan and various hormones, abiotic stresses.【Methods】Based on the database of longan transcriptome, the cDNA sequences of argonaute gene were isolated from longan (‘Honghezi’ cultivar) embryogenic callus by reverse transcription polymerase chain reaction (RT-PCR) and rapid amplification of cDNA end (RACE). Based on the unigene sequence (CL2736.Contig4) of the DlAGO10, two pairs of 5’RACE primers (universal primer UPM-Long and DlAGO10- 5RACE1, universal primer UPM-Short and DlAGO10-5RACE2) were designed to amplify the 5’-terminal nucleotide sequence of DlAGO10, which was 439 bp, two pairs of 3RACE primers (universal primer UPM-Long and DlAGO10-3RACE1, universal primer UPM-Short and DlAGO10-3RACE2) were designed to amplify the 3’-terminal nucleotide sequences of DlAGO10,which was 368bp. After fragment assembly, the full-length cDNA sequence was obtained, which was 3859bp. Based on the 5’-and 3’-terminal nucleotide sequences, one pair of gene specific primers (DlAGO10-CF/DlAGO10-CR) was designed to check the full length whether the stitching is correct. Bioinformatics analysis softwares (for example NCBI, DNAMAN6.0, ExPASy, ProtParam and so on) were used to predict the biological information of DlAGO10. Real-time quantitative PCR (qPCR) assay was used to analyze the relative level of gene expression during longan somatic embryogenesis (SE) in different longan tissues, and in response to hormones and abiotic stresses. The process of longan SE contained five stages, including non embryogenic callus (NEC), embryogenic callus (EC), incompletecompact pro-embryogenic cultures (ICpEC), globular embryos (GE), and cotyledon embryos (CE). The samples for longan tissue included roots (R), Stems(S), Leaf buds (Lb), leaves (L), floral buds (FB), Alabastrum (Al), Male flowers (Mf), Female flowers (Ff), Filament (F), Anther (An), young fruits (YF), Ripe fruits (RF), and pulps (P). Hormones included 2,4-D which concentration was 0, 0.5, 1.0, 1.5 mg·L-1, KT, the concentration was 0, 0.25, 0.5, 0.75, 1.0, 2.0 mg·L-1, and 0, 25, 50, 75 and 100 μmol·L-1 of salicylic acid (SA) and methyl jasmonte (MeJA). Abiotic stress treatments included salinity (NaCl, 150 mmol·L-1), osmotic stress (mannitol, 150 mmol·L-1), drought (PEG4000, 10%), and abscisic acid (ABA, 10 mmol·L-1) at different time of treatments (0, 1, 2, 4, 8, 12, 16 and 24 h). The relative expression of DlAGO10 was calculated by reference genes(EF-1a,eIF-4a,and FSD1a).【Results】After verification, the DlAGO10 was isolated and the full-length sequence was successfully cloned from embryogenic callus of ‘Honghezi’ longan (GeneBank accession number is MH708535). The full-length cDNA was 3 859 bp, containing ORF sequence 3 003 bp, encoding 999 amino acids. The 5’ untranslated region (5’ UTR) length of DlAGO10 was 439 bp, and the 3’ untranslated region (3’ UTR) length was 368 bp, including 21 bp PloyA. Bioinformatics analysis showed that the conserved domain of DlAGO10 had the typical domain characteristics PiWi of AGO and had a transmembrane domain, and the N-terminal contained 1 strong transmembrane helices, with a score of 642. The DlAGO10 protein was a hydrophilic alkaline protein, and the number of positive charged amino acids (Arg+Lys) was more than the number of negative charged amino acids (Asp+Glu), indicating that DlAGO10 was a stable protein. So the number and type of amino acids were related to the structure and function of AGO. Phylogenetic tree analysis indicated that DlAGO10 belonged to the same branch with Citrus sinensis and Citrus clementina. qPCR results showed that DlAGO10 had the higher expression in non-embryogenic callus(NEC), cotyledon embryos(CE), and S5 stage , while the least relative expression were in embryogenic callus(EC), and S2 stage of ‘honghezi’ longan. In different organs of ‘Honghezi’ longan, qPCR results showed that DlAGO10 had the hightest relative expression in female flower(FF), the second place in male flower(MF), the third position in the leaf bud (Lb), and the other organs (Roots, Stems, Leaves, floral buds, Alabastrum, filament, anther, young fruits, ripe fruits and pulps) had the low relative expression. A certain concentration of 2, 4-D, KT, SA can improve the relative expression of DlAGO10. When the concentration of 2,4-D is 0.5 mg·L-1, the relative expression of DlAGO10 is the highest, which is 2 times more than the relative expression of the control group (2,4-D concentration is 0 mg·L-1). When KT concentration is 0.25 mg·L-1, the relative expression of DlAGO10 is maximum, which is 2.4 times of the control group (KT concentration is 0 mg·L-1). When SA concentration is 50 μmol·L-1, and its relative expression was the highest, while different concentration of MeJA were not only positive regulation but also negative regulation of DlAGO10. Through a certain concentration of NaCl, mannitol, PEG4000, and ABA treaments for a period of time, the relative expression of DlAGO10 can be upregulated. But different kinds of abiotic stresses had the optimum treatment hours. The best hours of treatment with NaCl (150 mmol·L-1), mannitol (150 mmol·L-1), PEG4000 (10%), and ABA (10 μmol·L-1) were 4 h, 8 h, 16 h and 1 h respectively, while the least relative expression of the treatment hour were 0 h, 0 h, 24 h, and 24 h. Also, the overall response trend was different under different stress treatments.【Conclusion】These results suggested that DlAGO10 might be involved in the early and late transcriptional regulation of longan embryo. Furthermore, DlAGO10 might participate in floral organ development, various kinds of hormone and abiotic stress responsiveness, like auxin, cytokinin, salicylic acid, and ABA stress signal transduction pathway.
Keyword: Dimocarpus longan; Somatic embryogenesis; Argonaute 10; Expression analyses ;
Argonaute(AGO)蛋白是高度保守的碱性蛋白,在生物体中能够大量表达,且在不同个体间的表达量差异较大[1]。功能差异使真核生物中的AGO蛋白分为PIWI蛋白和AGO蛋白两大类,其中PIWI类蛋白仅存在于动物体中,而AGO类蛋白广泛存在于植物体内,主要结合microRNA和sRNA起作用[2]。不同物种的AGO家族成员数量存在差异性,例如拟南芥基因组中有10个AGO蛋白[3],而水稻基因组编码19个AGO蛋白[4]。在拟南芥中,AGO家族成员的功能研究较为透彻,AtAGO1主要调控植物的生长发育与胁迫反应[5],AtAGO2参与植物的JA途径防御活动[6],AtAGO4结合siRNA导致基因沉默,从而调控RNA介导DNA甲基化信号通路[7],AtAGO5主要与雌配子体的发生和RNA的沉默有关[8],AtAGO6募集siRNA,对DNA甲基化至关重要[9],AtAGO7主要调节发育时速,为ta-siRNAs的形成和稳定所必需[10],AtAGO9能抑制韧皮部生殖细胞的分化并参与DNA的修复[11],AtAGO10调控植物的顶端分生组织[12]。
AGO蛋白主要由PAZ、MID和PIWI三个功能结构域组成,N末端还包含了一个可变区域,主要与小RNA的分离有关,PAZ结构域与3’末端的结合有关,MID结构域与sRNA的5’磷酸基团紧密结合,PIWI结构域具有核酸内切酶催化反应中心,其启动子元件中有2,4-D、KT、MeJA、SA以及胁迫的响应元件。AGO蛋白是RNA介导的沉默复合体(RNA-induced silencing complex,RISC)的核心元件[13]。在植物体内AGO蛋白与小RNA结合参与维持基因的稳定,调控组织发育、胚胎发育及细胞分化,并在逆境胁迫响应和防御等方面具有一定的作用[14]。
龙眼是我国热带、亚热带地区的重要果树,在国内和世界水果市场上占有重要的经济地位,‘红核子’龙眼为福建省福州市的主栽品种,具有产量高,抗寒能力强,味浓甜,品质上等优点。龙眼体细胞胚胎高频率发生系统是在木本植物中最为优良的体胚发生系统之一,可作为木本植物体胚发生的模式系统[15],龙眼体胚发生系统不仅在我国有应用,甚至在巴西、美国等国家均有应用。近年来,笔者实验室借助多种分子生物学手段,已对龙眼体胚发生过程开展多项研究,发现生长素、多酚氧化酶、Dicer-like酶等参与体胚发生过程。小RNA在龙眼体胚发生及形态建成过程中发挥着重要的作用[16],sRNA的产生依赖于AGO酶的切割,揭示了AGO家族基因在龙眼体胚发生过程中起着调控作用,杨曼曼等[17]发现DlAGO家族中DlAGO6对龙眼体胚发生具有调控作用。目前,关于AGO基因家族的研究主要集中在拟南芥、番茄、玉米和水稻等模式植物上,而在木本果树植物中的研究却鲜有报道。笔者基于龙眼胚性愈伤组织的转录组数据(Genbank登录号:SRA059205),同时结合Lin等[18]龙眼基因组数据库的公布,以龙眼‘红核子’体细胞胚胎发生系统为材料,分离和克隆龙眼AGO10基因,研究其在龙眼体胚不同阶段、合子胚不同发育阶段以及在不同组织部位的表达,以及激素和非生物胁迫下的相对表达情况,为探究龙眼体胚发育过程中AGO10与小RNA协同调控的作用机制奠定基础,为AGO10调控植物体胚提供理论依据。
1、 材料和方法
1.1、 供试材料
龙眼松散型的胚性愈伤组织(‘红核子’品种LC2细胞系)由福建农林大学园艺植物生物工程研究所诱导并继代培养[19];参照Lin[20]的方法培养获得非胚性愈伤组织(NEC)、愈伤组织(EC)、不完全性紧实结构(IcpEC)、球形胚(GE)、子叶形胚(EC);龙眼‘红核子’幼果出现子叶胚期记为S1,每4 d收集一次合子胚,依次记为S2、S3、S4、S5、S6和S7;龙眼‘红核子’品种的根、茎、叶、花和果实等为材料采自福建农林大学创业园。
以培养20 d的龙眼愈伤组织为材料分别进行2,4-D(0、0.5、1.0、1.5 mg·L-1)、KT(0、0.25、0.5、0.75、1.0、2.0 mg·L-1)、MeJA(0、25、50、75、100 μmol·L-1)和SA(0、25、50、75、100 μmol·L-1)等激素不同浓度的处理,置于摇床(110 r·min-1,25 ℃)进行24 h的处理;此外以培养20 d的龙眼胚性愈伤组织为材料,分别添加NaCl(150 mmol·L-1)、甘露醇(150 mmol·L-1)、聚乙二醇(PEG-4000,10%)和ABA(10 μmol·L-1)进行非生物胁迫处理,分别培养1、2、4、8、12、16和24 h。上述试验材料处理后经液氮冻存于-80 ℃冰箱用于后续试验。
1.2、 方法
1.2.1、 总RNA提取及cDNA逆转录
采用Tripue(Transgen,China)试剂盒进行龙眼总RNA的提取,经1%(w)琼脂糖凝胶电泳检测其完整性后,用紫外分光光度计(Thermo Fisher,USA)检测OD260/280在1.9~2.1之间且完整性良好的核酸备用。采用GeneRacerTMKit(Invitrogen,USA)进行RT-PCR所需cDNA的逆转录,同时采用SYBR ExScript试剂盒(Takara,Japan)和罗氏LightCycler480仪器(Thermo Fisher,USA)用于qPCR,详细的操作步骤见说明书。
1.2.2、 引物设计及PCR扩增
转录组中AGO10序列分析与PCR验证。根据龙眼不同体胚发生阶段的转录组数据(GeneBank登录号:SRA059205),总共搜索到与AGO10相关的Unigene序列7条,用DNAMAN6.0软件多重比对并结合NCBI中的blastn分析,结果发现,CL2736.Contig1、CL2736.Contig2、CL2736.Contig3、CL2736.Contig4、CL9568.Contig1、CL9568.Contig2、Unigene29821可编码同一个AGO基因,因此,根据CL2736.Contig4这条最长序列来设计引物,验证ORF拼接是否正确,其引物名称命名为DlAGO10-F1/DlAGO10-R1。
3’-RACE和5’-RACE。采用RACE法,根据CL2736.Contig4序列设计引物,扩增该基因的3’末端和5’末端序列,引物名称命名为DlAGO10-5RACE1、DlAGO10-5RACE2、DlAGO10-3RACE1、DlAGO10-3RACE2。
目的基因的扩增。以反转录的龙眼胚性愈伤组织cDNA为模板,以DlAGO10-CF/DlAGO10-CR为引物,进行该基因cDNA全长序列的拼接验证。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,56~60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸6 min,PCR程序根据实际情况进行调整。获得目的片段后切胶回收,TA克隆后挑取阳性克隆子的菌液进行PCR扩增,将有目的条带的菌液送至铂尚生物科技有限公司测序。
同时,根据所得的全长序列设计实时荧光定量PCR的引物,命名为DlAGO10-QF/DlAGO10-QR,引物均由北京六合华大基因科技股份有限公司合成。引物的序列、退火温度及扩增用途见表1。
表1 DlAGO10基因克隆引物序列
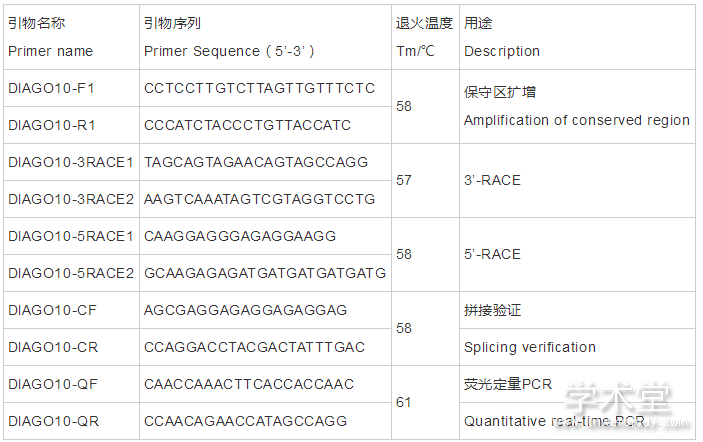
Table1 Primers used in DlAGO10 gene cloning
1.2.3、 生物信息学分析
利用NCBI和DNAMAN 6.0对获得的DlAGO10序列进行分析,并利用在线软件ExPASy ProtParam (http://au.expasy.org/tools/)预测DlAGO10蛋白的理化性质;采用SignaIP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;同时利用在线软件COILS(http://embnet.vital-it.ch/software/COILS form.html)进行蛋白卷曲螺旋预测;利用PSORT II(http://psort.hgc.jp/form.html)进行亚细胞定位预测,利用Tmpered(http://www.ch.embnet.org/software/TMPRED form.html)进行跨膜结构域预测;采用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点;最后采用MEGA 5.05软件的Neighbor-Joining(邻位相连法,NJ法)构建核苷酸序列的分子系统进化树(P-distance法),并用bootstrap法(重复1 000次)评估系统进化树。
1.2.4、 DlAGO10基因在不同处理下的qRT-PCR分析
参考Lin等[21]的方法,以龙眼EIF4a、EF-1a和FSD作为内参基因。采用SYBR ExScript试剂盒(TaKaRa,Japan)和罗氏LightCycler480仪器(Thermo Fisher,USA),以经不同浓度处理的、不同组织部位的、不同胁迫处理下的龙眼胚性愈伤组织cDNA为模板,根据荧光定量引物设计的原则在DlAGO10基因的特异位置设计上下游引物进行qRT-PCR扩增。待反应结束后,进行扩增曲线、溶解曲线(60~95 ℃)和凝胶电泳分析,同时检测引物的特异性;每个反应设置3个重复,将不同处理下的的龙眼胚性愈伤组织cDNA模板的混合样进行10倍梯度稀释,制作标准曲线。从扩增曲线图中得到Ct值,并根据标准曲线获得不同处理下DlAGO10基因的mRNA相对含量,通过内参基因的校正,最终得到目的基因的相对表达量,进行DlAGO10基因在不同处理下的表达情况分析。数据分析采用Excel和SPSS 19.0软件进行。
2、 结果与分析
2.1、 DlAGO10基因cDNA全长序列的获得(GeneBank登录号为MH708535)
通过对龙眼转录组数据库的分析,以龙眼‘红核子’胚性愈伤组织cDNA为模板、DlAGO10-F1和DlAGO10-R1为保守区上下游引物进行PCR扩增,获得DlAGO10的cDNA序列长度3 060 bp,包含完整的ORF序列3 003 bp,编码999个氨基酸;随后分别设计3’RACE和5’RACE引物,采用5’RACE通用引物UPM-Long和DlAGO10-5RACE1以及5’RACE通用引物UPM-Short和DlAGO10-5RACE2扩增获得5’UTR为439 bp,采用3’RACE通用引物UPM-Long和DlAGO10-3RACE1以及3’RACE通用引物UPM-Short和DlAGO10-3RACE2扩增获得3’UTR为368 bp,含有22 bp Poly (A),终止密码子是TAG。以龙眼‘红核子’胚性愈伤组织cDNA为模板,利用cDNA全长验证引物DlAGO10-CF/DlAGO10-CR进行拼接验证,其拼接序列正确,最终获得该基因全长为3 859 bp。
2.2、 生物信息学分析
2.2.1、 DlAGO10蛋白的基本性质分析
采用ExPASy ProtParam对DlAGO10进行理化性质预测,结果表明,DlAGO10蛋白为具亲水性的碱性蛋白,且带正电荷氨基酸数量(Arg+Lys)均大于带负电荷氨基酸的数量(Asp+Glu),表明DlAGO10属稳定蛋白。SignaIP 4.2 Server在线分析显示,DlAGO10蛋白不具有明显的信号肽,因此是一个非分泌蛋白。采用PSORTⅡ预测显示,DlAGO10蛋白的亚细胞定位在细胞核(73.9%)。利用Tmpered2.0对DlAGO10蛋白进行跨膜结构预测,结果显示,DlAGO10具跨膜结构域,且N-末端朝内含有1个强的跨膜螺旋结构,其得分为642。磷酸化位点预测显示,DlAGO10蛋白含有95个磷酸化位点(Ser:55,Thr:29,Tyr:11),其氨基酸种类和数量与AGO结构功能具有一定的关系。利用PsiPred在线软件对DlAGO10蛋白进行二级结构预测,结果表明,DlAGO10的二级结构以无规则卷曲为主,其比例高达66.4%,α-螺旋占比13.0%,β-折叠占比20.6% 。基于二级结构预测结果对该蛋白进行三级结构预测,其结果与二级结构的预测相符(图1)。利用NCBI-Protein Tools对DlAGO10蛋白质保守区域进行分析,结果(图2)显示,DlAGO10蛋白含有AGO蛋白的经典结构域PIWI,但并不具有PAZ和MID两大经典结构,这可能造成DlAGO10与其他AGO蛋白的功能差异。
图1 利用SWISS-MODEL预测DlAGO10的三级结构及模型参数
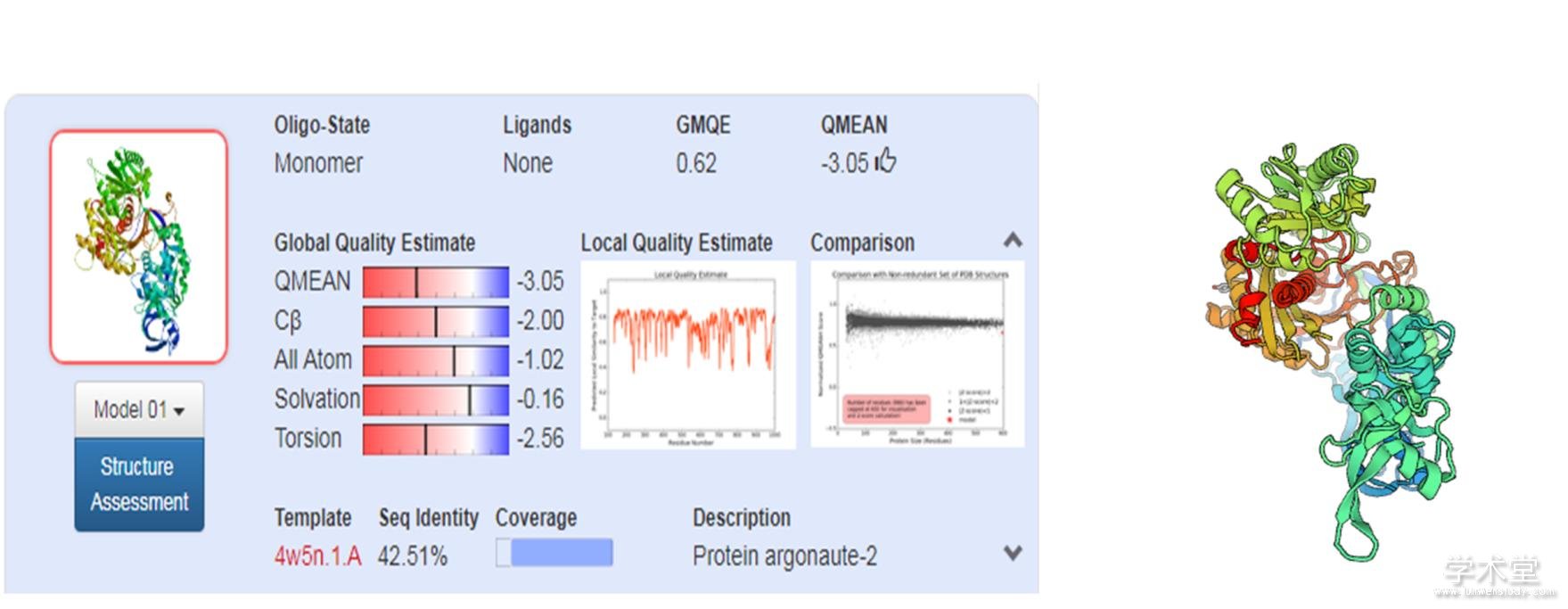
Fig. 1 Predicted the 3D structure and model parameter of DlAGO10 with SWISS-MODEL
图2 DlAGO10蛋白保守结构域预测
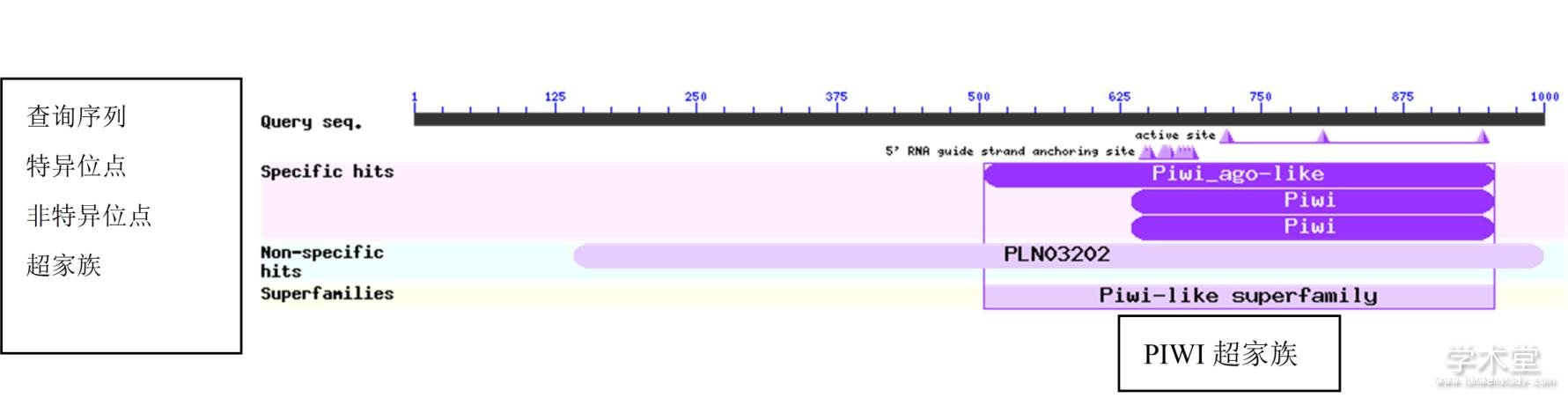
Fig. 2 Functional domains prediction for DlAGO10
2.2.2、 氨基酸序列比对及系统进化树分析
将DlAGO10编码的氨基酸序列在NCBI上进行blastp比对,发现DlAGO10与甜橙AGO10(Citrus sinensis,XP_006489472.1)、克莱门柚AGO10(Citrus clementina, XP_006433984.1)、可可AGO10(Theobroma cacao,XP_007018772.1)、麻风树AGO10 (Jatropha curcas,XP_012069721.1)、葡萄AGO10(Vitis vinifera, XP_002279408.1)、烟草AGO10(Nicotiana sylvestris,XP_009781911.1)、高粱AGO10(Sorghum bicolor,XP_022947595.1)、玉米AGO10(Zea mays,XP_003519706.1)的同源率分别为94%、93%、93%、92%、91%、86%、86%、85%;为了进一步研究DlAGO10序列的保守性,使用软件DNAMAN6.0将该基因的氨基酸序列与其他植物的AGO10进行比对,发现绝大部分植物AGO10蛋白主要由PAZ、MID和PIWI三个功能结构域组成,N末端还包含了一个可变区域,主要与小RNA的分离有关,PAZ结构域与3’末端的结合有关,MID结构域与sRNA的5’磷酸基团紧密结合,PIWI结构域具有核酸内切酶催化反应中心[12],但DlAGO10只具有PIWI结构域,PIWI结构域位于DlAGO的C-末端部分,由2个亚结构域组成,其中一个提供导向RNA的5’锚定,另一个提供切割的催化位点。DlAGO10的PIWI结构域核心具有切割单链RNA,例如由双链siRNA指导的mRNA。为了研究植物AGO的进化关系,根据NCBI数据库中甜橙、克莱门柚、麻风树、大豆、蒺藜苜蓿和烟草等的10多条AGO10氨基酸序列,采用MEGA 5.05软件的Neighbor-Joining(邻位相连法,NJ法)构建核苷酸序列的分子系统进化树(P-distance法),并用bootstrap法(重复1 000次)评估系统进化树,结果(图3)表明,进化树根据种属聚为明显的两大类,其中,龙眼AGO10与双子叶植物甜橙CsAGO10和克莱门柚CcAGO10的亲缘关系最近,与单子叶玉米ZmAGO10、高粱SbAGO10的亲缘关系最远。
图3 植物AGO10进化树分析

Fig. 3 Phylogenetic tree of plant AGO10
2.3、 龙眼体胚发生过程中DlAGO10基因在不同处理下的的表达情况
利用qRT-PCR法对DlAGO10基因在龙眼体胚发生不同时期的mRNA转录水平进行分析,结果如图4所示。DlAGO10基因在龙眼体胚发生不同时期表达量的变化较大,先下降后上升,呈“V”模型,在非胚性愈伤组织(NEC)中的表达量最高,是松散型愈伤组织(EC)的4倍左右,在子叶胚(CE)中的表达量次之,表明了该基因主要调控龙眼体胚的早期和晚期发育。
图4 龙眼体胚发生过程中DlAGO10的相对表达量
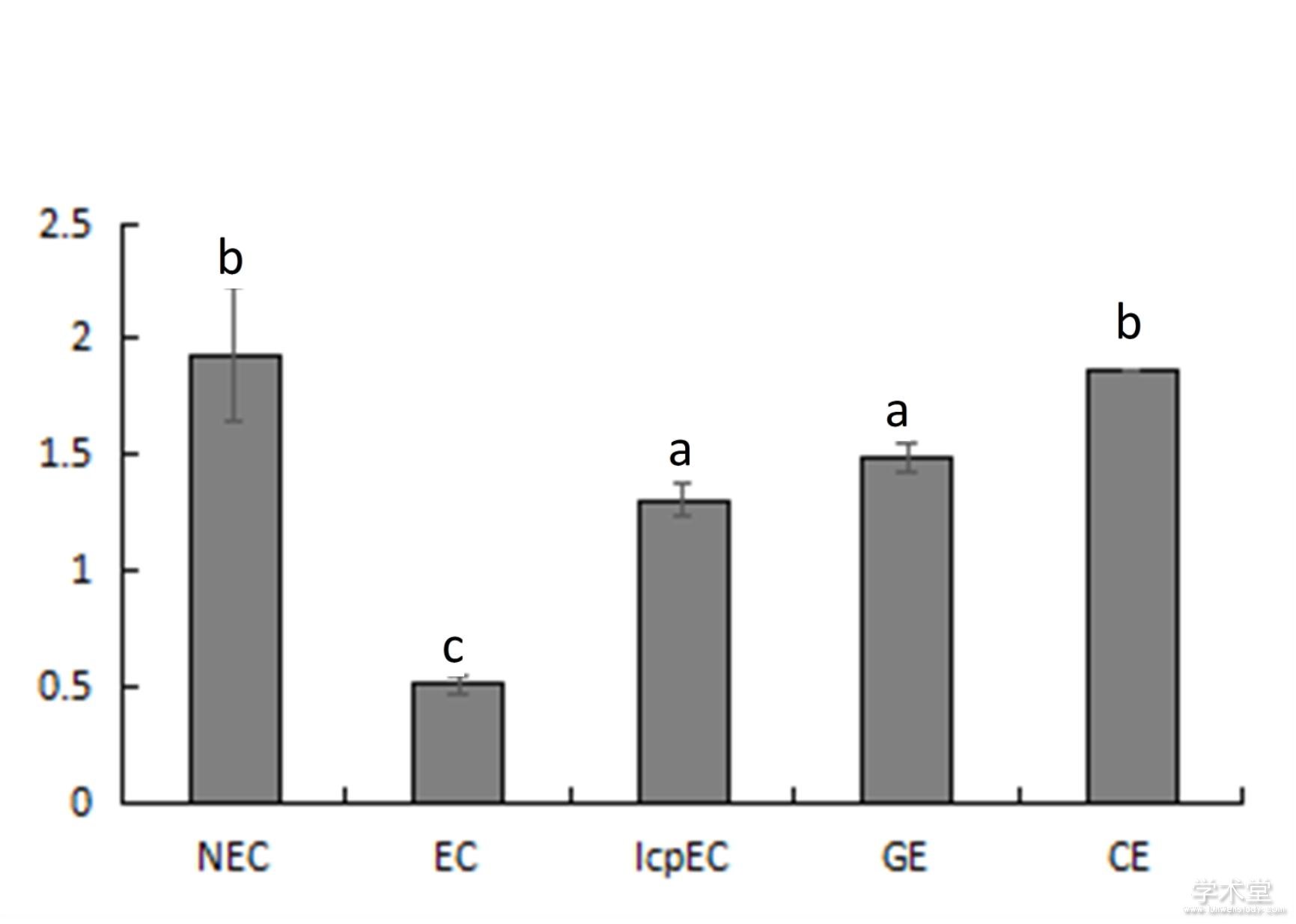
Fig. 4 Relative expression of DlAGO10 during longan somatic embryogenesis stage
NEC. 非胚性愈伤组织;EC. 愈伤组织;IcpEC. 不完全性紧实结构;GE. 球形胚;EC. 子叶形胚。NEC. Non embryogenic callus; EC. Embryogenic callus; IcpEC. Incomplete compact pro-embryogenic cultures; GE. Globular embryos; CE. Cotyledon embryos.
2.4、 DlAGO10在龙眼‘红核子’合子胚不同发育阶段的表达分析
DlAGO10在龙眼‘红核子’合子胚不同阶段的表达模式如图5所示,DlAGO10在合子胚不同发育阶段的表达量是先下降后上升,在S5阶段其相对表达量达到最高,然后又下降,S5阶段的表达量相比于S4阶段是显着上升的。结果表明,DlAGO10可能参与合子胚的发育,尤其在合子胚的后期发育阶段具有重要的调控功能。
图5 龙眼‘红核子’合子胚不同发育阶段
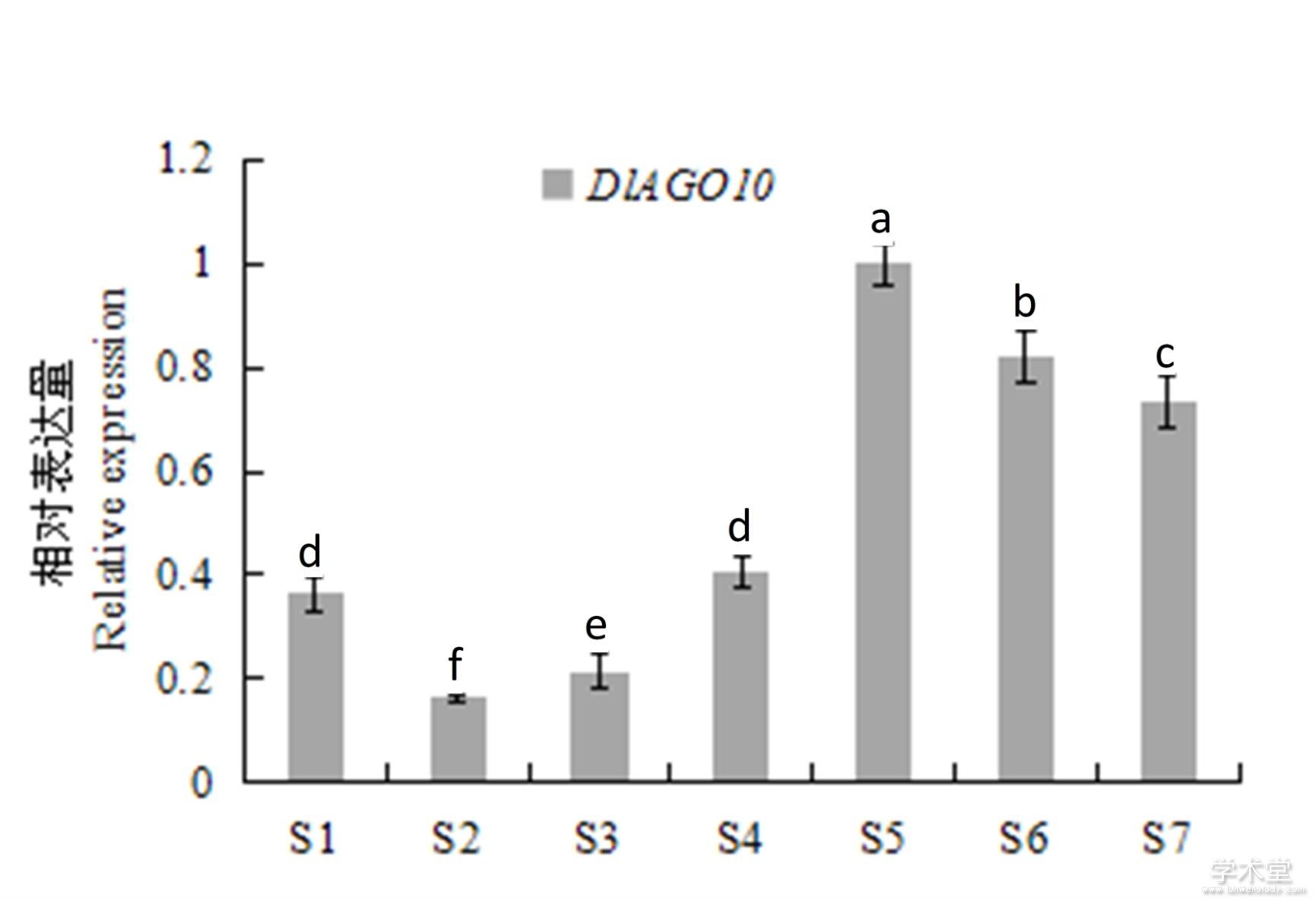
Fig. 5 Longan ‘Honghezi’ zygotic embryogenesis stage
2.5、 DlAGO10在龙眼‘红核子’不同组织器官中的差异表达分析
DlAGO10在龙眼根、茎、叶、花和果实等组织器官中的相对表达情况如图6所示。DlAGO10在不同组织器官中相对表达量的情况为雌花>雄花>叶芽>花蕾>幼果>成熟果>茎>花药>叶>花芽>根>花丝>果肉。由此说明,DlAGO10可能参与龙眼不同组织器官的发育,而在花的不同组织器官中相对表达量均较高,所以AGO10在花的发育中起到非常重要的作用。
图6 DlAGO10在龙眼‘红核子’不同组织部位的相对表达量
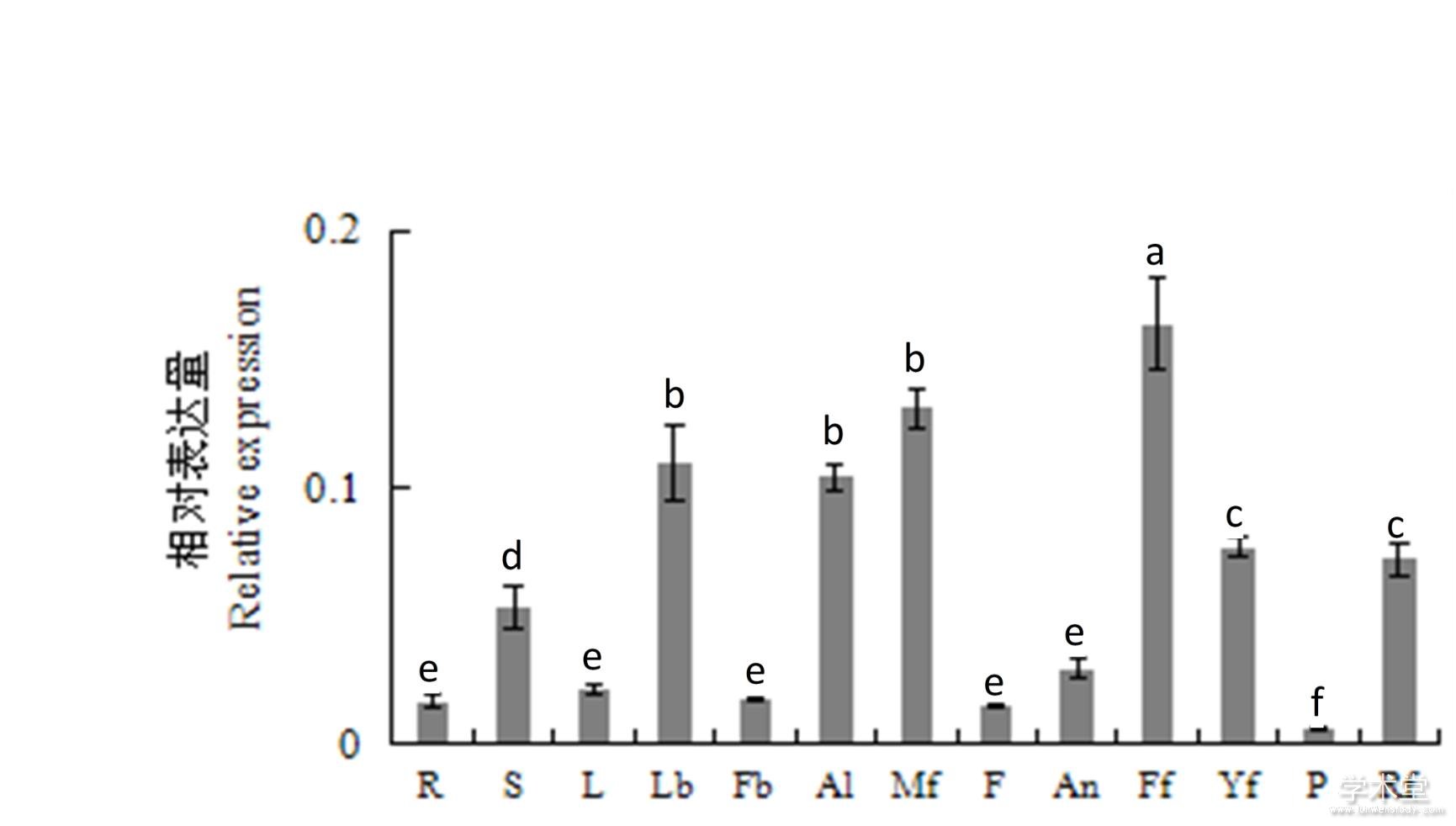
Fig. 6 Relative expression of DlAGO10 in different tissues of longan ‘Honghezi’
R. 根;S. 茎;Lb. 叶芽;L. 叶;Fb. 花芽;Al. 花蕾;Mf. 雄花;Ff. 雌花;F. 花丝; An. 花药;Yf. 幼果;P. 果肉;Rf. 成熟果。R. Root; S. Stem; Lb. Leaf bud; L. Leaf; Fb. Flower bud; Al. Alabastrum; Mf. Male flower; Ff. Female flower; F. Filament; An. Anther; Yf. Young fruit; Rf. Ripe fruit; P. Pulp.
2.6、 DlAGO10在不同激素处理下的表达分析
AGO10蛋白参与植物的逆境响应等过程,为了更好地研究AGO10蛋白在外界环境变化下的作用机制,利用不同浓度的2,4-D、KT、SA和MeJA对龙眼胚性愈伤组织进行处理,并分析DlAGO10的相对表达量情况。结果(图7)表明,DlAGO10对不同种类的激素处理均有响应,一定浓度的2,4-D、KT和SA正调控DlAGO10 mRNA的转录,当2,4-D质量浓度为0.5 mg·L-1时,DlAGO10的相对表达量达到最高,是对照组(2,4-D质量浓度为0 mg·L-1)相对表达量的2倍多;当KT质量浓度为0.25 mg·L-1时,DlAGO10的相对表达量达到最大值,是对照组(KT质量浓度为0 mg·L-1)的2.4倍;当SA浓度为50 μmol·L-1时,其相对表达量达到最高;而MeJA对DlAGO10既有正调控作用,也有负调控作用。
图7 外源激素处理下DlAGO10的相对表达量
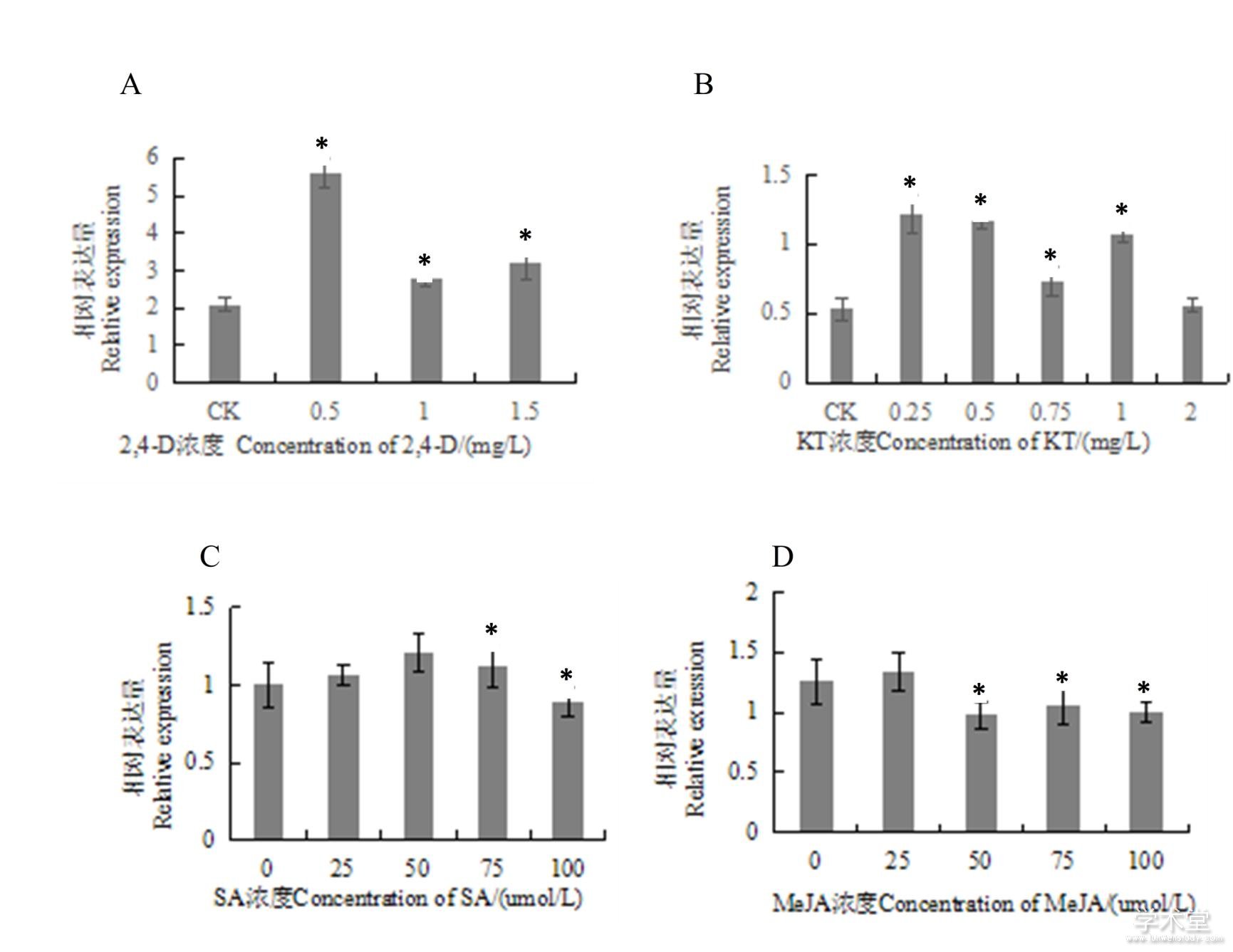
Fig. 7 Relative expression of DlAGO10 at different hormone
2.7、 DlAGO10在不同胁迫处理下表达模式的qPCR分析
不同非生物胁迫处理下,DlAGO10的表达分析不同(图8)。NaCl模拟的盐胁迫,随着处理时间的延长,其相对表达量先上升后下降再上升,当处理时间为4 h时,其相对表达量达到最高值,是参照组的3.4倍;甘露醇模拟的渗透胁迫,随着处理时间的延长,其总体表现为正调控,当处理时间为24 h时,其相对表达量达到最高值;PEG4000模拟的干旱胁迫,随着处理时间的延长,表现为不规则的波动,处理16 h时,其相对表达量达到最高,为对照组的1.5倍;ABA胁迫处理下,其相对表达量的变化趋势也是呈现不规则的波动,处理1 h时,其相对表达量达到最高值。由此可见,DlAGO10参与各种非生物胁迫过程,包括盐胁迫、渗透胁迫、干旱胁迫以及ABA激素信号途径的应答。
图8 非生物胁迫下DlAGO10的相对表达量
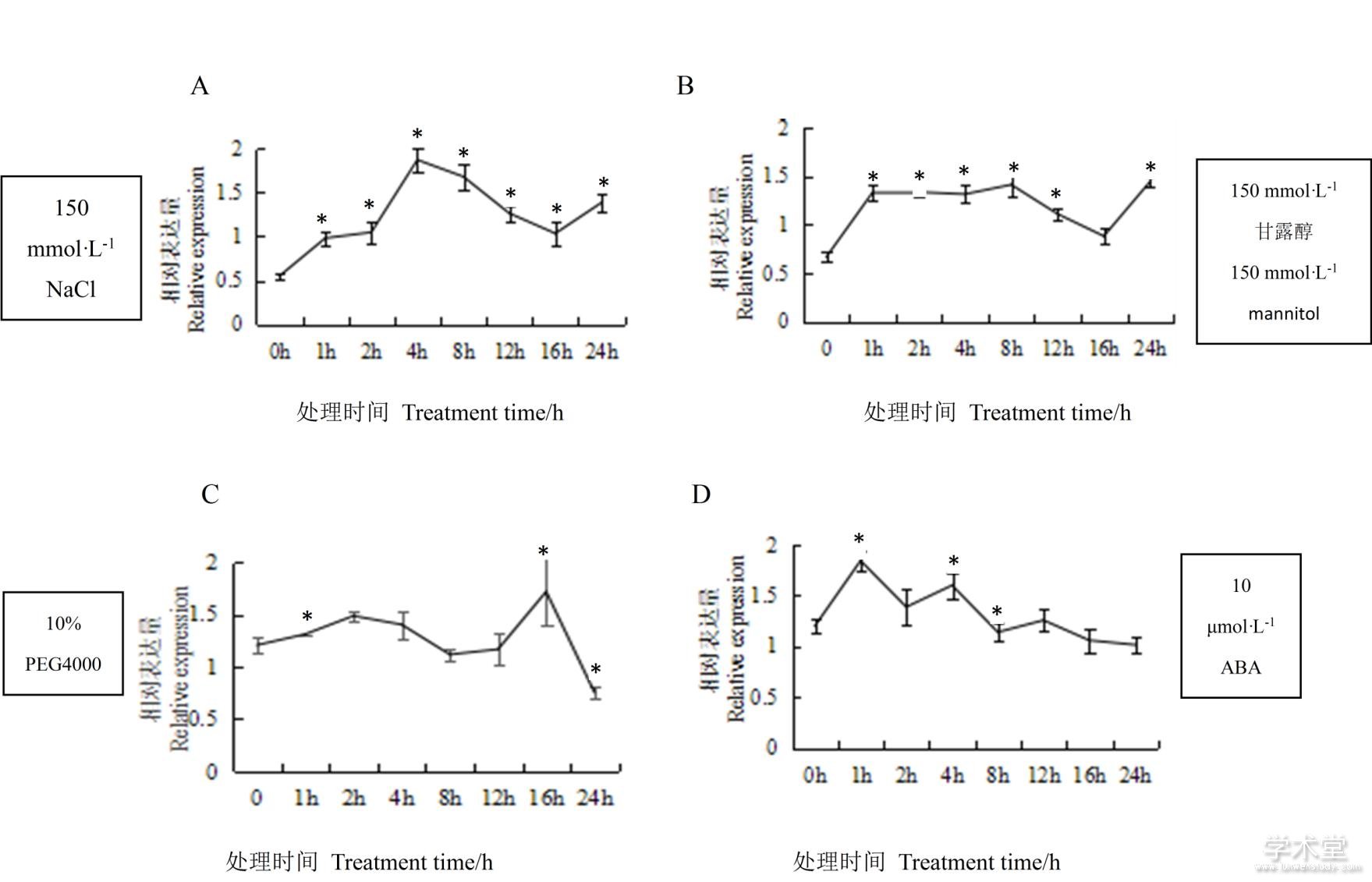
Fig. 8 Relative expression of DlAGO10 in response to abiotic stress
3、 讨 论
3.1、 DlAGO10蛋白的结构和功能
近年来较多地报道了AGO基因家族各个成员的结构以及功能,其为一种效应蛋白。在AGOs基因家族中,小RNA从各个方面介导AGO蛋白调控基因的表达且不同成员之间存在着功能冗余现象,AGO10和AGO1联系紧密,AGO1能够调控植物顶端分生组织发育[22];AGO4、AGO6和AGO9与DNA甲基化作用有关[23];AGO7在植物从幼期到成熟期的转型发挥着重要的作用[24]。本文通过生物信息学分析结果显示,DlAGO10编码的蛋白具有AGO蛋白的经典保守结构域PIWI结构,但不具有PAZ等结构域,DlAGO10含有跨膜结构域以及不同种类和数量的氨基酸,这些特点与AGO10的功能具有相关性。
3.2、 龙眼AGOs可能参与体胚和花器官的发育
AGO蛋白在miRNA介导的基因调控过程中起着重要的作用,而有研究表明miRNA合成相关基因表达量的降低会影响胚胎发育和分生组织的培养,由此可见,AGO蛋白与体胚的发育具有一定的关系[25,26]。本研究通过对DlAGO10基因在龙眼体胚发生过程中的差异表达分析发现,DlAGO10在不同时期均有表达,但是表达量有所差异,在龙眼非胚性愈伤组织阶段和子叶胚时期表达量较高,说明DlAGO10参与龙眼体胚发生过程,但是其在龙眼体胚发生过程中的表达调控机制需进一步研究。
AGO基因家族成员在不同植物组织器官中相对表达量的高低均不相同。有研究发现,AGO1可在成熟植物体的所有部位中表达,但在分生组织和维管组织中的相对表达量最高[27];AGO4在植物的胚、花和叶中相对表达量较高;AGO6在根和芽的表达受限;AGO9在芽尖和未成熟的胚珠中表达受限[23]。在本试验中,DlAGO10在不同组织器官中均表达,但表达量存在显着差异,在龙眼雌花和雄花中的相对表达量较高,推测DlAGO10可能参与龙眼花器官的发育。
3.3、 DlAGO10可能响应多种激素的应答
植物体细胞胚胎的发生受多种激素的调控,其往往形成复杂的调控网络体系。有研究表明,高浓度的2,4-D能促进细胞核DNA甲基化水平提高,基因沉默比例提高,而低浓度的2,4-D却能激活体细胞胚发生的特异的基因[28]。AGO基因在植物体胚发生过程中扮演着重要的角色,在拟南芥中胚胎发生过程中发现,在拟南芥胚胎发生过程中发现,AtAGO10和AtAGO1与miR165/166协同作用调控HD-ZIPIII表达部位,进而下调ARF2介导的植物激素水平,从而维持茎尖分生组织(SAM)的正常活动[29]。不同激素对DlAGO10的影响不同,本研究中2,4-D、KT和SA对DlAGO10的相对表达量均呈现正调控,但其具体的调控机制有待进一步研究验证。
3.4、 DlAGO10参与胁迫应答
AGO参与小RNA介导的基因沉默过程,在转录和转录后调控过程中起着重要的作用,可能参与植物对渗透、干旱和盐等逆境的响应。周莎莎等[30]对苹果进行自然干旱、盐胁迫、冷胁迫和ABA处理发现,在这些非生物逆境胁迫的处理下,AGO基因家族中的不同成员在不同的胁迫处理下均上调。植物激素脱落酸(ABA)是植物响应干旱和盐胁迫的主要信使,当植物受到逆境胁迫时会响应ABA的基因。本研究结果表明,NaCl模拟的盐胁迫、甘露醇模拟的渗透胁迫、PEG4000模拟的干旱胁迫和ABA胁迫下,其对DlAGO10呈正调控影响。由此可见,DlAGO10可能参与龙眼对胁迫逆境的抗性。然而,在龙眼体胚发生过程中,DlAGO10如何调节细胞进行胁迫的应对,在应答逆境信号转导中的调控途径/信号网络等一系列问题还需要进一步研究。
参考文献:
[1] CARMELL M A, XUAN Z, ZHANG M Q, HANNON G J. The Argonaute family: tentacles that reach into RNAi, developmental control, stem cell maintenance, and tumorigenesis[J]. Gene & development, 2002, 16 (21): 2733-2742.
[2] HOCK J, MEISTER G. The Argonaute protein family[J]. Genome Biology, 2008, 9(2): 210.
[3] KAPOOR M, SHARMA R, LAMA T, SAMA A N, KHURANA P, TYAGI A K, KAPOOR S. Genome-wide identification, organization and phylogenetic analysis of Dicer-like, Argonaute and RNA-dependent RNA polymerase gene families and their expression analysis during reproductive development and stress in rice[J]. BMC Genomics, 2008, 9(1): 451.
[4] WU J, YANG Z R, WANG Y, ZHENG L, YE R, JI Y, ZHAO S, JI S, LIU R, XU L, ZHENG H, ZHOU Y, ZHANG X, CAO X, XIE L, WU Z, QI Y, LI Y. Viral-inducible Argonaute 18 confers broad-spectrum virus resistance in rice by sequestering a host microRNA[J]. Elife, 2015, 4: e05733.
[5] 王文婧,刘婷,郭磊,刘春明. SCL/AGO1基因控制拟南芥细胞分裂与定向伸长[J]. 植物学报,2011,46(4): 370-378.
[6] 徐伟,严善春. 茉莉酸在植物诱导防御中的作用[J]. 生态学报,2005,25(8): 2074-2082.
[7] TILL S, LADURMER A G. RNA Pol IV plays catch with argonaute 4[J]. Cell, 2007, 131(4): 643-645.
[8] BROSSEAU C, MOFFETT P. Functional and genetic analysis identify a role for Arabidopsis ARGONAUTE 5 in antiviral RNA silencing[J]. Plant Cell, 2015, 27(6): 1742-1754.
[9] MCCUE A D, PANDA K, NUTHIKATTU S, CHOUDURY S G, THOMAS E N, SLOTKIN R K. ARGONAUTE 6 bridges transposable element mRNA-derived siRNA to the establishment of DNA methylation[J]. The EMBO Journal, 2015, 34(1): 20-35.
[10] ADENOT X, ELMAYAN T, LAURESSERGUES D, BOUTET S, BOUVHE N, GASCIOLLI V, VAUCHERET H. DRB4-dependent TAS3 trans-acting siRNA control leaf morphology through AGO7[J]. Current Biology, 2006, 16(9): 927-932.
[11] OLIVER C, SANTOS J L, PRADILLO M. On the role of some ARGONAUTE proteins in meiosis and DNA repair in Arabidopsis thaliana[J]. Frontiers in Plant Science, 2014, 5: 177.
[12] JI L, LIU X, YAN J, WANG W, YUMUL R E, KIM Y J, DINH T T, LIU J , CUI X, ZHENG B, AGARWAL M, LIU C, CAO X, TANG G, CHEN X. ARGONAUTE10 and ARGONAUTE1 regulate the termination of floral stem cells through two microRNAs in Arabidopsis[J]. PLoS Genetics, 2011, 7(3): e1001358.
[13] HUTVAGNER G, SIMARD M J. Argonaute proteins: key players in RNA silencing[J]. Nature Reviews Molecular Cell Biology, 2008, 9(9): 22-32.
[14] CARMICHAEL J B, PROVOST P, EKWALL K, HOBMAN T C. Ago1 and Dcr1, two core components of the RNA interference pathway, functionally diverge from Rdp1 in regulating cell cycle events in Schizosaccharomyces pombe[J]. Molecular Biology of the Cell, 2004, 15(3): 1425-1435.
[15] LAI Z X, CHEN C L, ZENG L H. Somatic embryogenesis in longan (Dimocarpus longan Lour.) [M]. JAIN S M, GUPTA P K, NEWTON R J. Somatic embryogenesis in woody plants (Vol 6). London: Kluwer Academic Publishers, 2000: 415-431.
[16] 赖钟雄. 龙眼生物技术研究[M]. 福州: 福建科学技术出版社,2003: 18-22.
[17] 杨曼曼,林玉玲,王天池,赖钟雄. 龙眼胚性愈伤组织AGO6基因克隆及其在体胚发生过程中的表达分析[J]. 江西农业大学学报,2015,37(1): 141-148.
[18] LIN Y, MIN J, LAI R, WU Z, CHEN Y, YU L, CHENG C, JIN Y, TIAN Q, LIU Q, LIU W, ZHANG C, LIN L, HU Y, ZHANG D, THU M, ZHANG Z, LIU S, ZHONG C, FANG X, WANG J, YANG H, VARSHNEY R K, YIN Y, LAI Z. Genome-wide sequencing of longan (Dimocarpus longan Lour.) provides insights into molecular basis of its polyphenol-rich characteristics[J]. GigaScience, 2017, 6(5): 1-14.
[19] 赖钟雄,潘良镇,陈振光. 龙眼胚性细胞系的建立与保持[J]. 福建农业大学学报, 1997, 26(2): 33-40.
[20] LIN Y, LAI Z, TIAN Q, LIN L, LAI R, YANG M, ZHANG D, CHEN Y, ZHANG Z. Endogenous target mimics down-regulate miR160 mediation of APF10, -16, and -17 cleavage during somatic embryogenesis in Dimocarpus longan Lour.[J]. Frontiers in Plant Science, 2015, 6: 956.
[21] LIN Y, LAI Z. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J]. Plant Science, 2010, 178(4): 359-365.
[22] BASU S, SHARMA V K, BHATTACHARYYA D, CHAKRABORTY S. An overview of antiviral RNA silencing in plant: Biogenesis, host-virus interaction and potential applications[M]//Approaches to Plant Stress and their Management. India: Springer, 2014: 317-337
[23] HARDCASTLE T, KELLY K, DOONAN J H. The Arabidopsis RNA-directed DNA methylation argonautes functionally diverge based on their expression and interaction with target loci [J]. The Plant Cell, 2010, 22(2): 321-334.
[24] HUNTER K, WELCH D R, LIU E T. Genetic background is an important determinant of metastatic potential [J]. Nature Genetics, 2003, 34(1): 23-24.
[25] WU X, LIU M, GE X, XU Q, GUO W. Stage and tissue-specific modulation of ten conserved miRNAs and their targets during somatic embryogenesis of Valencia sweet orange[J]. Planta, 2011, 233(3): 495-505.
[26] KAWAMURA Y, SAITO K, KIN T, ONO Y, ASAI K, SUNOHARA T, OKADA T N, SIOMI M C, SIOMI H. Drosophila endogenous small RNAs bind to Argonaute 2 in somatic cells[J]. Nature, 2008, 453(7196): 793-797.
[27] 许鑫,李丹丹,李双江,阚云超,李春奇. 玉米AGO基因的克隆与表达分析[J]. 西北植物学报,2014,34(3): 0449-0453.
[28] VON-ADERKAS P, BONGA J M. Influencing micropropagation and somatic embrygenesis in mature trees by manipulation of phase change, stress and culture environment[J]. Tree Physiology, 2000, 20(14): 921-928.
[29] ROODBARKELARI F, DU F, TRUERNIT E, LAUX T. ZLL/AGO10 maintains shoot meristem stem cells during Arabidopsis embryogenesis by down-regulating ARF2-mediated auxin response[J]. BMC Biology, 2015, 13(1): 1-12.
[30] 周莎莎. 长期干旱条件下苹果水分利用效率调控的蛋白组学研究及相关基因鉴定[D]. 杨凌:西北农林科技大学,2016.





