第三章 绵羊痘病毒辽宁锦州分离株的分离鉴定
绵羊痘病毒(Sheeppox,SPPV)是痘病毒科(Poxviridae)山羊痘病毒属(Capripoxvirus)的成员,是绵羊痘的病原。作为一种古老的疾病,该病在羊群中普遍存在,被广泛认为是最常见的病毒性传染病之一。近年来,该病的发生呈上升趋势,严重阻滞养羊业的健康发展。此外,绵羊痘还可以感染人,对人类的健康构成一定的危害,针对 SPPV 病原的研究逐渐成为一个热点,特别是一些养羊业发达的国家。前期我们对锦州市一养羊户饲养羊群出现全身性痘疹的原因从病理学和病原学角度进行系统分析,确诊其在羊群中的发生为 SPPV 感染所致。
为了进一步深入了解该病原的分子特征,本实验进行了 SPPV 辽宁锦州地方毒株的分离鉴定。
1 材料与方法
1.1 材料
1.1.1 病料来源
辽宁锦州地区某养羊户送检疑似绵羊痘病羊。
1.1.2 细胞和菌株
原代胎羊肾细胞由本实验室分离制备;E.coli DH5α 由本实验室制备保存。
1.1.3 主要试剂
DMSO、MEM 粉剂、胎牛血清为 GIBCO 公司产品;青霉素、链霉素、胰蛋白酶等均购自上海生物工程有限公司; pMD18-T 购自大连宝生物有限责任公司;病毒 DNA 提取试剂盒购自上海生工工程有限公司;DNA 凝胶回收试剂盒购自 Axygen 公司;甲醛;无水乙醇;丙酮;二甲苯;苏木素染液;碳酸钠;碳酸氢钠;EDTA;酚红;氯化钠;氯化钾。
1.1.4 实验仪器
各型微量可调移液器(Eppendorf,德国);HB-100 恒温金属浴(杭州博日科技有限公司);4℃ LEGEND MICRO17R 高速离心机(Thermo,德国);YKKY/FM50 制冰机(中国);DK-8D 型电热恒温水箱(上海一恒科技有限公司);DW-40L262 型立式医用冰箱(海尔,中国);GZX-9070 MBE 数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);BS124S 型电子分析天平(赛多利斯仪器北京有限公司);DL-CJ-IN 型超净工作台(北京东联哈尔仪器制造有限公司);MCO-17AI 型 CO2培养箱(SANYO,日本);倒置相差显微镜(OLYMPUS,日本);70P-72 型超速离心机(HITACHI,日本);PCR 扩增仪(GeneAmp PCR System9600,Biometra);TY600C 型电泳仪、电泳槽(北京君意东方电泳设备有限公司);凝胶成像系统(Alpha Innotech,美国);–80℃超低温冰箱(SANYO,日本);生物显微镜(OLYMPUS,日本);显微成像系统(Motic BA200); RM2016 组织切片机(Leica,德国);数码照相机(Canon)。
1.2 方法
1.2.1 主要试剂的配制
1.2.1.1 双抗溶液(终浓度:青霉素 10000 U/mL,链霉素 10 mg/mL)将 160 万单位青霉素溶于 80 mL 五蒸水中,同时将 1 g 链霉素溶于 50 mL 五蒸水中,之后分别取溶解后的青霉素和链霉素溶液各 50 mL,将二者混合后经0.22 μm 滤器过滤除菌,分装,-20℃冻存备用。
1.2.1.2 MEM 培养基将9.6gMEM固体粉末与1.1gNaHCO3溶于800mL五蒸水中,用1mol/LNaOH将 PH 值调至 7.2~7.4,加水定容至 1L,0.22μm 滤器过滤除菌后 4℃保存。按照8%比例加入胎牛血清配制成细胞生长液和 2%比例加入的胎牛血清为细胞维持液。
1.2.1.3 0.25% 胰蛋白酶消化液2.5g 胰 蛋 白 酶 粉 末 , 8.0gNaCl,0.4gKCl,0.134g Na2HPO4·12H2O ,0.06gKH2PO40.35gNaHCO3,1.027g EDTANa2,2.5g 葡萄糖,0.02g 酚红依次溶于 900mL五蒸水中,待完全溶解后,用 1 mol/L NaOH 调节 pH 至 8.0~8.5,补加水至 1L,0.22 μm 滤器过滤除菌后-20℃保存。
1.2.1.4 D-Hank’s 液NaCl 8.0 g,KCl 0.4 g,Na2HPO4·12H2O 0.134 g,KH2PO40.06 g,NaHCO30.35g,酚红 0.02 g 依次溶于 900 mL 五蒸水中,待完全溶解后,用 1 mol/L NaOH 调节 pH 至 7.2~7.4,补加水至 1000 mL,过滤除菌后,4℃保存。
1.2.2 病料处理
将采集到的病羊的肺部痘疹组织痂皮剪碎,用石英砂充分研磨,按照 1:5 的比例稀释于 0.01mol/PBS 缓冲液中,制成悬液,并按照 20%比例向其中加入双抗溶液(10000U/mL,链霉素 10mg/mL),4℃浸渍 16~18h,感作后 3000r/min 离心30min,将上清液吸出转移至无菌离心管中,用 0.45um 滤器过滤备用。
1.2.3 病毒培养
取感作处理后的病料上清溶液 1mL,将其接种于生长良好的原代胎羊肾细胞,37℃吸附 1h,间或晃动使病毒充分吸附于羊细胞上,1h 后弃去上清液加入含 2%血清的 MEM 维持液,在 37℃,5%CO2浓度下静止培养,同时设置正常细胞对照组。在随后的几天中观察细胞生长情况以及有无出现细胞病变(CPE)。
若细胞在接种病料液 4~5 天后仍未出现明显病变,则继续盲传至次代细胞,直至细胞出现细胞膜收缩,折光性增强,细胞脱落等现象,立即收集病毒和细胞混合液。
1.2.4 病毒纯化
收集细胞病变液,反复冻融三次后使用差速离心法对病毒进行纯化。首先将收集到的细胞病变液 3000r/min 离心 10min 离去细胞碎片,之后将上清液经20000r/min 超速离心 6h,收集病毒沉淀。
1.2.5 病毒毒力测定
纯化后的病毒液 10 倍倍比稀释后接种于 96 孔细胞板内生长良好的羊肾细胞,随后几天观察细胞病变数量,测定其组织细胞半数感染量(50% tissue cultureinfective dose,TCID50),并使用 Reed-Muench 法进行计算。
1.2.6 电镜负染观察
将细胞病变液反复冻融 3 次后,3000r/min 离心 20min,取上清液,经 2%磷钨酸负染后进行电镜观察。
1.2.7 P32 基因的克隆及测序分析
1.2.7.1 病毒基因组 DNA 的提取
按照生工 UNIQ-10 柱式病毒 DNA 提取试剂盒说明书操作。
1.2.7.2 引物设计及 PCR 扩增
根据 GenBank 公布的绵羊痘病毒 SHEEP-AY077834 株的 P32 基因序列设计一对特异性引物,引物序列如下:
FP:5’-CTCATTGGTGTTCGGATTTTC-3’
RP:5’-CCGTTACCACTTGCTTCC-3’
用 1.2.7.1 提取的病毒基因组为模板进行 PCR 扩增,反应体系为 25μL,其中P10.6μL,P20.6μL,Taq DNA 聚合酶 0.3μL;DNA 模板 1.5μL,ddH2O18.3μL,dNTP:1.2μL;buffer:2.5μL。PCR 反应程序:95 ℃预变性 5 min ,95℃变性 35 s, 50 ℃退火 55 s, 72 ℃延伸 90s, 35 循环,72 ℃延伸 10 min,保存于 4℃[110]。以上各种液体混匀后,放入 PCR 仪中扩增,取扩增产物于 1%琼脂糖凝胶电泳。电泳缓冲液为 1×TAE,以 100V 恒压电泳 30min,用紫外检测仪观察凝胶电泳结果。
1.2.7.3 PCR 扩增产物的纯化
按照 AxyPrep DNA 凝胶回收试剂盒(杭州爱思进生物技术有限公司)说明书操作。
1.2.7.4 扩增产物的克隆
(1)连接
将 1.2.7.3 回收纯化的 PCR 扩增产物与 pMD18-T 载体进行连接,连接反应体系为:pMD18-T Vector 0.5μL,DNA 回收产物 4.5μL,加入 5μL solution I,充分混匀后在 16℃下反应 8h。
(2)转化
A.从-80℃冰箱中取出保存的感受态细胞 DH5α,将其放于冰上缓慢融化,细胞一经融化,用微量移液器轻轻混匀,轻弹管底。
B.将 10μL 连接产物全部加入感受态细胞管中,放于冰上静置 30min。
C.在 42℃静止水浴热激 90s,迅速将离心管冰浴 5min。
D.加入 200μL37℃预热的液体 LB 培养基(无抗生素),于 37℃摇床,180rpm震荡培养 90min。
E.在混合液中加入 40μL X-Gal(20μg/mL)和 60μL IPTG(10%),混匀,一同涂在含有 100μg/mL 氨苄青霉素的 LB 平板上,于 37℃温箱培养 12~16h。
1.2.7.5 阳性克隆的筛选与测序
经蓝白斑筛选出的阳性克隆,加入到6mlAMP+的LB液体培养基中,挑取3~5 个克隆,并对每个克隆进行编号,置于摇床上,37 ℃ 180rpm震荡培养 8~10h。
用菌液 PCR 检测插入片段,鉴定为阳性克隆后送样测序。将测序结果通过Clustalx,Mega 等生物软件及 GenBank 中的相应序列进行比较并进行同源性分析。
2 结果
2.1 病毒分离
应用原代肾细胞从病羊肺组织中分离获得 1 株绵羊痘病毒,命名为SPPV/LN/12/JZ 株,将采集的患病羊肺部痘疹结痂制成匀浆液,接种于胎羊肾细胞。与正常细胞相比(图 3.1),该病毒在前三代细胞的病变不明显,盲传四代后出现典型的细胞病变(CPE),病变细胞表现为变圆、核固缩、脱离(图 3-2)。

2.2 病毒毒力测定
SPPV/LN/12/JZ 分离株在胎羊肾细胞上的感染滴度为 10-7.2/0.1mL。
2.3 电镜负染
CPE 阳性细胞培养液经 2%磷钨酸负染后进行电镜观察可见卵圆形病毒粒子,大小约为 250~300nm,典型的痘病毒粒子(图 3-2)。
2.4 测序分析
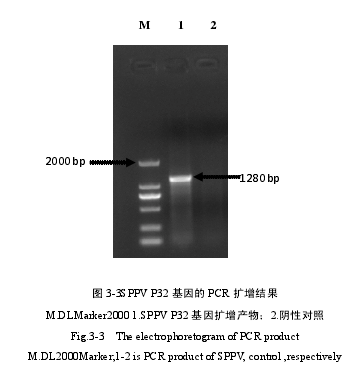
对纯化后的病毒进行 PCR 扩增经 1%琼脂糖凝胶电泳检测,结果显示 P32基因特异性引物扩增出大小为 1280bp 的目的片段(图 3-3)。SPPV P32 基因经凝胶回收、克隆测测序后,使用 Clustal Ⅹ,Mega 软件在核苷酸水平上对该毒株的P32 基因序列进行同源性分析,核苷酸测序结果(图 3-4),其中绵羊痘 P32 基因完整阅读框为 972bp,根据遗传距离绘制遗传进化树(图 3-5),P32 基因遗传进化树结果显示,SPPV/LN/12/JZ 株与 SPPV-China-ningxia-2009(JN596274)毒株的亲缘关系最为相近。

3 讨论
绵羊痘病毒是一种非常重要的传染源,能够引起绵羊发生绵羊痘,其中以幼龄羔羊最为易感[19]。近些年来,该病在世界各地均有发生,且呈上升态势,相关的临床报道也在不断增多。综合最近几年的发病情况,可以看出感染的严重程度较以往有所增强,常呈爆发性流行。值得注意的是,近年来随着该病的频繁爆发,感染的严重程度以及感染范围也在逐渐扩大,该病对绵羊的危害越来越严重[49]。
目前,国内外学者从绵羊体内分离出不同地方株的绵羊痘病毒并进行了系统的鉴定。在本研究中,我们从病理学和病原学角度对辽宁锦州地区某羊群所发生的一起疑似羊痘疫情进行系统的分析,在确诊的基础上进行了系统的病原分离与鉴定工作。
选择病毒敏感细胞是分离绵羊痘病毒的重要环节,在本研究中选用绵羊肾细胞进行 SPPV 分离,盲传至第四代后细胞出现典型的 CPE,通过电镜负染观察,在细胞培养上清中观察到典型的痘病毒粒子,表明已成功分离并获得病毒。之后,利用 PCR 方法对其 P32 基因进行检测与分析,扩增获得与预期片段大小一致的目的条带。为进一步明确该分离株的分子特征,本研究将获得的该分离株 P32基因与 GenBank 中已公布的相应基因片段进行核苷酸同源性及遗传进化分析,分析结果显示,该分离株与与宁夏绵羊 SPPV 分离株(JN596274)同源性最高,且处于同一进化小分支。根据上述结果,证实我们分离获得的分离株为 SPPV,命名为 SPPV/LN/12/JZ 分离株。此外,本研究首先利用胎羊肾细胞对其毒力进行测定,结果表明 SPPV/LN/12/JZ 在胎羊肾细胞上的感染滴度为 10-7.2/0.1ml。该项研究通过对 SPPV/LN/12/JZ 分离株进行全面和系统的鉴定,证实引起羊群爆发“痘疹”的原因为 SPPV 感染所致,该研究结果不仅为病毒分子生物学特性的研究奠定基础,同时也将为该病的诊断、免疫预防以及治疗提供重要的理论依据。





