
脑内深部肿瘤位置较深,一些邻近重要功能区的病变周围解剖结构复杂,在传统手术术中不易确定肿瘤边界,一直是手术治疗的难点。随着神经导航技术的发展和微创手术理念的更新,我们采用神经导航辅助微骨窗入路显微手术治疗脑内深部肿瘤,取得了良好的治疗效果。
资料与方法
1. 一般资料: 选取 2008 年 5 月至 2012 年 12 月收集的 140 例脑深部肿瘤患者,分为试验组(86 例)和对照组(54 例) 。试验组患者采用神经导航辅助的显微手术切除肿瘤,对照组患者采用传统手术治疗。试验组患者中,男 39 例,女 47 例; 年龄 15 ~63岁,中位年龄为 37. 3 岁。临床表现为单纯头痛 45例,头痛伴呕吐 12 例,癫痫 6 例,偏瘫 19 例,语言障碍 11 例,视野受限 6 例。肿瘤位于额叶 27 例,颞叶 18 例,顶叶 20 例,枕叶 8 例,侧脑室 13 例,基底节区 9 例,中央运动区12 例。试验组患者术后病理诊断为胶质瘤 33 例,脑膜瘤 10 例,脑转移瘤 30 例,淋巴瘤 2 例,脉络从乳头状瘤 4 例,海绵状血管瘤 5例,中枢神经细胞瘤 2 例。对照组患者中,男 24 例,女 30 例; 年龄 21 ~ 65 岁,中位年龄为 39 岁。所有患者手术前诊断标准一致,均经 CT 或磁共振影像诊断,肿 瘤 最 大 直 径 为 61. 3 mm,最 小 直 径 为0. 9 mm,平均直径为 35. 4 mm,病灶中心距离脑皮层约 2. 5 ~5. 0 cm。
2. 手术方法: 试验组患者进行神经导航辅助手术,对照组患者采用传统骨瓣开颅术式。(1) 手术准备: 采用美国 GE 公司生产的电磁式神经导航系统(Insta-Trak3500) ,手术前进行头颅 CT (层厚2. 5 mm) 或 MRI 薄层连续扫描,层厚 1 mm,层数90 ~ 100,将影像数据录入光盘中。通过光盘将数据导入神经导航工作站,进行三维重建,建立头颅模拟立体模型,显示肿瘤的三维形状和与周围组织结构的毗邻关系,进而精确定位,设计最佳手术计划,以手术后 3 个月的随访资料为基础进行神经功能的评定。(2) 术中导航: 患者全身麻醉成功后采用四钉头架固定头部,将参考架(示踪器) 固定于头架上,定位标记,要求平均误差 <2 mm,待准确显示脑深部病变的三维空间位置和邻近的重要神经血管结构后,根据导航显示信息设计手术入路和切口。
手术中及时利用导航探针探查肿瘤和周围结构,尽量避免脑室开放,或脑池的脑脊液流失过多而引起脑组织移位。手术切口为小直切口或弧形切口,切开后用乳突牵开器撑开,采用电动环钻或气动铣刀锯成圆形,骨窗直径为 2 ~4 cm,根据导航确认肿瘤的切除程度和深度。位于重要功能区附近的肿瘤不适合全切者,以不损伤重要神经结构为原则,最大限度的切除肿瘤。手术结束后进行止血、缝合硬膜、复位骨瓣,并采用钛连接片固定,缝合头皮切口,皮下留置胶膜引流或无需引流。
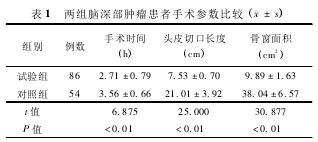
3. 疗效评价: 两组患者手术前后均进行头部MRI 检查,根据多田公式计算手术前肿瘤体积和手术后的残余肿瘤体积。切除率 = (手术前肿瘤体积-手术后残余肿瘤体积) /手术前肿瘤体积 × 100%。记录并比较两组患者的手术时间、头皮切口长度和骨窗面积。
4. 统计学方法: 采用 SPSS 16. 0 统计软件进行数据分析。计量资料的比较采用 t 检验; 计数资料的比较采用 χ2检验,以 P <0. 05 为差异有统计学意义。
结果
1. 手术参数比较: 两组患者手术时间 (t =6. 875) 、头皮切口长度(t = 25. 000) 和骨窗面积比较(t =30. 877) ,差异均有统计学意义(均 P <0. 05) 。
2. 手术全切率比较: 试验组患者均在神经导航辅助下准确定位肿瘤,顺利完成手术,患者均于手术后1周内复查 MRI,其中全切除78例(90. 7%) ,近全切除5例(5. 8%) ,大部分切除2例(2. 3%) ,活检1例 (1. 2%) 。对照组 患者全切除40例(74. 1%) ,近全切除 9 例(16. 7%) ,大部分切除 5例(9. 3%) 。试验组的全切率显著高于对照组,差异有统计学意义(P <0. 05) 。
讨 论
脑深部肿瘤由于肿瘤位置深、视野相对狭小、解剖结构复杂、手术路径长、传统手术术后并发症较高等,严重影响患者的预后。Wilson 于 1971 年提出微骨窗入路手术,治疗各种脑深部病变。神经导航技术的出现,可协助神经外科医生在操作中准确定位肿瘤边界,进而切除病灶,并且在手术前能够设计最佳手术路径,减小手术切口和脑组织的无效暴露。
我们根据 86 例脑深部肿瘤患者的特点和解剖关系,采用神经导航辅助微骨窗入路技术进行显微手术治疗,取得了良好疗效。其优点: (1) 精确定位肿瘤的头皮投影,获得手术的最短路径,进行小创伤头皮切口和骨窗设计,且方便颅脑手术中的切口设计。(2) 手术中可以准确定位病变的位置和边界、周围重要神经结构和血管,避免损伤正常结构和血管。(3) 手术中实时显示手术切除的程度,可为体积较大或级别较低胶质瘤的切除提供可靠依据。(3) MRI 显示出的低级别胶质瘤往往在显微镜下不易辨别其边界,可在导航探针的指引下找到边界进行等体积切除肿瘤组织。(4) 切除位于基底节区的深部肿瘤时,神经导航的提示可避免深部重要神经结构的损伤。(5) 切除脑转移肿瘤时,在导航探针的指引下找到肿瘤,根据其与脑组织的明显边界进行游离切除,显著降低了术后复发率。我们的结果显示,试验组的全切率(90. 7%) 显著高于对照组,差异有统计学意义(P <0. 05) 。
影响神经导航精确性的主要因素是手术中的脑移位。李波等采用神经导航辅助切除功能区胶质瘤,手术后患者出现偏瘫或偏瘫加重,原因是由于手术中脑移位。采用神经导航辅助微骨窗入路手术,可以减少手术中脑脊液的流失和脑移位,降低手术误差。而微骨窗入路技术的不足之处是手术视野较狭小,不利于质地较硬、范围较广和血流较丰富的病变的处理。为了尽量减少手术误差,我们认为可以采取以下措施: (1) 手术前牢固固定头架和导航参考架,防止手术中移位。(2) 采用表面注册结合解剖标志注册。(3) 手术中尽量不使用脱水剂,不做过度换气,减少对脑体积的影响。(4)手术中尽量不打开脑池或释放脑室内脑脊液。(5)尽量减小正常脑组织的切除体积。(6) 切除大的囊性肿瘤时不要急于打开囊腔吸走囊液,首先游离肿瘤的周边,再处理囊液。(7) 手术中尽量不牵拉或减少牵拉脑组织。(8) 发生脑移位的患者,可根据解剖标志和手术者的经验正确判断。目前,减少手术中神经导航误差最好的方法是手术中实时影像跟踪定位,限于目前的条件未能实现,但可以借助手术中超声或神经内镜、CT 和 MRI 等方法辅助切除肿瘤。程伟等认为,将手术中超声和神经导航结合可以充分发挥两者的优势。
综上所述,神经导航辅助下微骨窗入路手术可显著提高脑深部肿瘤患者的治疗疗效,提高全切率,缩短手术时间,并减少手术创伤,具有重要的临床应用价值。
参考文献:
[1] 谭国伟,王占祥,郭剑锋,等 . 神经导航在颅内病变微创手术中的应用价值[J]. 中华神经外科疾病研究杂志,2007,6:454-457.





