咪达唑仑对肝癌细胞增殖、凋亡与细胞周期的影响
时间:2018-11-02 来源:广东医学 作者:潘家浩,李强,陈东泰, 本文字数:5601字摘 要: 目的 探讨静脉麻醉药咪达唑仑对人肝癌细胞增殖能力的影响。方法 首先通过CCK-8增殖实验观察递增浓度20、40、60、80和100μmol/L的咪达唑仑分别各自作用24、48和72 h后对人肝癌细胞的影响;通过流式细胞仪检测浓度为50μmol/L (Mida50组) 和100μmol/L (Mida100组) 的咪达唑仑以及PBS对照组 (Control组) 作用于人肝癌细胞发生的凋亡和细胞周期的变化;通过免疫印迹方法观察咪达唑仑对ERK通路的影响。结果 咪达唑仑浓度为20μmol/L递增至100μmol/L作用24 h时, 人肝癌细胞株Huh7细胞增殖生存率由 (88.55±5.64) %下降至 (47.71±4.45) %, 差异有统计学意义 (P<0.05) , 且浓度为100μmol/L的咪达唑仑作用24、48和72 h的增殖生存率分别为 (47.71±4.45) %、 (25.69±6.52) %和 (18.10±2.95) %, 差异有统计学意义 (P<0.05) 。流式细胞实验显示Mida50和Mida100组的早期凋亡和晚期凋亡比率分别为 (7.07±0.41) %和 (8.36±0.48) %以及 (7.58±0.47) %和 (13.44±0.67) %。细胞周期示Control组、Mida50组、Mida100组S期比例分别为 (22.19±1.07) %、 (27.57±2.15) %和 (38.11±1.25) %。免疫印迹结果显示咪达唑仑作用于人肝癌细胞会使p-ERK下调。结论 咪达唑仑在体外细胞实验中能抑制人肝癌细胞株Huh7细胞的增殖并呈浓度相关和时间相关, 其中可能与咪达唑仑促进其凋亡和细胞周期S期停滞相关, 相关机制可能是通过ERK通路实现的。
关键词: 咪达唑仑; 肝细胞癌; 增殖; 凋亡;

Abstract: Objective To investigate the effects of Midazolam on the proliferation of human hepatocellular carcinoma (HCC) cells.Methods CCK8 proliferation assay was used to observe the anti-tumor effects of Midazolam on HCC cells.Midazolam treatment were given at different concentrations, including 20, 40, 60, 80 and 100 μmol/L, and for 24 h, 48 h and 72 h.The cell apoptosis and cell cycle of HCC were studied by flow cytometry.Western blotting was adopted to study the influence of Midazolam on ERK pathways.Results The cell viabilities of huh7 cells inhibited by Midazolam with concentrations of 20 μmol/L and 100 μmol/L were (88.55±5.64) % and (47.71±4.45) % in a concentration-dependent manner, and they were (47.71±4.45) %, (25.69±6.52) % and (18.10±2.95) % inhibited by Midazolam of 100 μmol/L for 24 h, 48 h and 72 h, respectively (P< 0.05) .Midazolam induced apoptosis, and suppressed cell cycle progression of huh 7 cells.The percentages of early apoptosis cells in Group Mida50 and Mida100 were (7.07±0.41) % and (7.58±0.47) %, respectively;as the late apoptosis percentages were (8.36±0.48) % and (13.44±0.67) %, respectively.The accumulation rates of live cells in S phase in Group Control, Mida50 and Mida100 were (22.19±1.07) %, (27.57±2.15) % and (38.11±1.25) %, respectively.Meanwhile, western blotting showed Midazolam induced down-regulation of p-ERK.Conclusion Midazolam is able to inhibit the proliferation of HCC cells, and to induce apoptosis and suppress cell cycle.ERK pathways may play a crucial role in this process.
Keyword: midazolam; hepatocellular carcinoma cell; proliferation; apoptosis;
目前越来越多的研究提出麻醉可以影响手术患者, 特别是肿瘤手术患者远期预后这一观点。有研究报道外周血液里的肿瘤细胞数量在肿瘤患者的生存和预后起着重大的作用[1]。由此可见, 静脉麻醉药对肿瘤细胞的直接作用是十分重要的。咪达唑仑 (midazolam) 作为常用的静脉麻醉药, 由于它的起效快, 镇静效果显着等作用也被常用于肿瘤患者术前、麻醉诱导及围术期的镇静。近年来, 有研究发现咪达唑仑能抑制肿瘤细胞生长和促进凋亡[2]。肝细胞癌是全球第三大导致肿瘤相关性死亡的恶性肿瘤, 并且在过去几年它的发生率有上升的趋势[3]。肝细胞癌目前的治疗手段最重要的是手术切除, 因此与手术密切相关的麻醉和围术期的药物使用, 尤其是静脉麻醉药的选择就显得至关重要。目前肝癌的研究大多集中于受体或者基因在肿瘤发生、发展中的作用, 咪达唑仑在肝癌中的研究鲜有报道。为了探讨静脉麻醉药本身是否能对肝癌产生影响, 本研究于2015年6月至2018年2月通过咪达唑仑作用于人肝癌细胞株, 观察咪达唑仑对人肝癌细胞增殖、凋亡与细胞周期的影响, 为肝细胞癌患者手术的麻醉方式和药物选择提供新的依据。
1、 材料与方法
1.1、 细胞培养
人肝癌细胞株Huh7细胞由中山大学肿瘤防治中心、华南肿瘤学国家重点实验室元云飞课题组提供。肝癌细胞系Huh7细胞培养于含有10%胎牛血 (Cat.No#C11995500BT;GIBCO公司) 的DMEM (高糖) 培养基中常规培养, 5%CO2和37℃恒温培养箱中连续传代培养, 0.25%胰酶购自GIBCO公司, 细胞至对数生长期时进行实验。
1.2、 CCK-8增殖实验
利用Cell Counting Kit-8 (CCK-8;Ck04, 东仁化学公司) 试剂盒进行检测。按试剂盒说明书取对数生长期的细胞胰酶消化制备成一定密度的单细胞悬液, 调整细胞密度为 (3~6) ×103个/mL, 按每孔100μL的容积, 按预先设计好的形式接种于96孔培养皿中。置于85%湿度、5%CO2、37℃恒温培养箱中培养48 h后开始, 咪达唑仑浓度取0 (PBS替代咪达唑仑) 、20、40、60、80和100μmol/L于24、48和72 h进行检测, 检测时每孔加入CCK-8 10μL, 在培养箱中孵育3 h后, 取出96孔板, 以450 nm为测定波长在全自动酶标仪上测各孔吸亮度值 (A值) 并以0μmol/L为对照组计算其细胞增殖生存率。
1.3、 流式细胞仪检测细胞凋亡和细胞周期
取对数生长期的细胞加入含有药物或含有相等体积PBS的培养液处理;细胞分为3组, Control组、Mida50组和Mida100组。Control组为PBS对照组, Mida50组和Mida100组分别为咪达唑仑50μmol/L和100μmol/L对应的浓度组。咪达唑仑购自江苏恩华制药有限公司。加药处理后的细胞继续按照常规培养, 72 h后用0.25%胰酶适当消化, 用预冷至4℃的PBS溶液吹打成细胞悬液, 离心后弃去上清。再用预冷的PBS溶液洗涤细胞2次, 离心后弃去上清, 加入500μL的Binding Buffer液吹打出细胞悬液后, 细胞凋亡实验中加入Annexin V-FITC 5μL和PI溶液5μL, 充分混匀, 室温下避光孵育30 min;细胞周期实验中加入PI和RnaseA, 重悬之后转入流式管中, 避光孵育30 min;上机检测设定每次计算细胞数为20 000个, 激发波长为488 nm, 散射波长为530 nm;结果通过Flowjo 7.6来分析检测细胞的凋亡情况和细胞周期各期的比例。
1.4、 免疫印迹法
蛋白由细胞用含有蛋白酶抑制剂的裂解缓冲液 (Roche) 提出, 并按照BCA Protein Assay Kit (Therrmo) 说明书进行量化。10%SDS-PAGE胶中每孔加入等量的蛋白, 接着电转至PVDF膜上 (Millipore) 。PVDF膜分别加入ERK1/2抗体 (Cell signaling technology) , p-ERK1/2抗体 (Cell signaling technology) 和GAPDH抗体 (Cell signaling technology) 。4℃隔夜孵育后使用辣根过氧化物酶二抗体进行检测, 结果灰度用ImageJ 1.46r进行分析。1.5统计学方法应用SPSS 16.0统计软件, 每个均能重复3次以上, 计量资料以x±s表示。不同处理组的差异采用单因素方差分析, 组间两两比较采用LSD-t检验, 以P<0.05为差异有统计学意义。
2、 结果
2.1、 咪达唑仑对人肝癌细胞增殖能力的影响
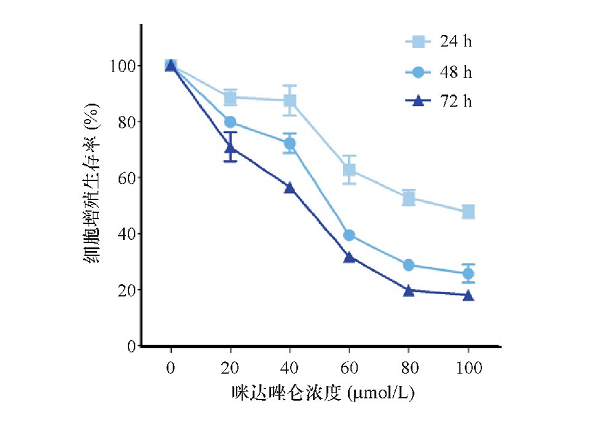
咪达唑仑处理的人肝癌细胞株Huh7细胞的增殖生存率有所下降, 分别作用24、48和72 h后20、40、60、80和100μmol/L各浓度对应的增殖生存率随着作用时间延长, 细胞的增殖生存率有所下降, 100μmol/L的咪达唑仑作用24、48和72 h的增殖生存率分别为 (47.71±4.45) %、 (25.69±6.52) %和 (18.10±2.95) %。见表1。
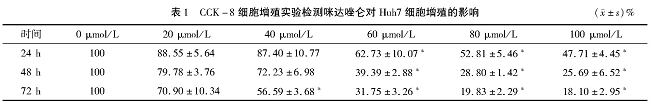
*与0μmol/L比较P<0.05
2.2、 咪达唑仑对人肝癌细胞凋亡的影响
随着浓度递增, 细胞凋亡率上升, Mida50和Mida100组的早期凋亡和晚期凋亡比率分别为 (7.07±0.41) %和 (8.36±0.48) %以及 (7.58±0.47) %和 (13.44±0.67) %。见图2。
图1 CCK-8细胞增殖实验检测咪达唑仑对Huh7细胞增殖的影响
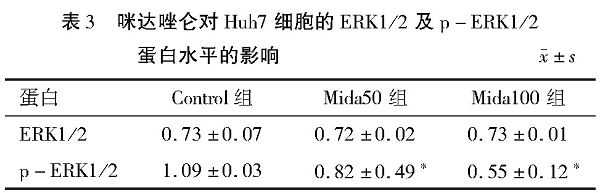
2.3、 咪达唑仑对人肝癌细胞周期停滞的影响
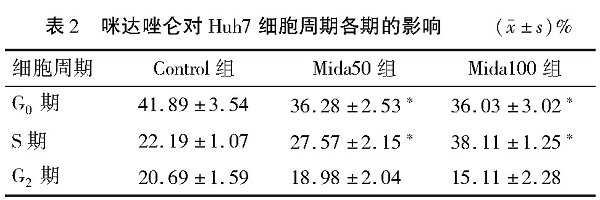
细胞周期实验结果显示咪达唑仑能影响人肝癌细胞株Huh7细胞周期, 主要为G0期比例下降和S期比例上升, 并且以S期停滞更明显。见表2和图3。
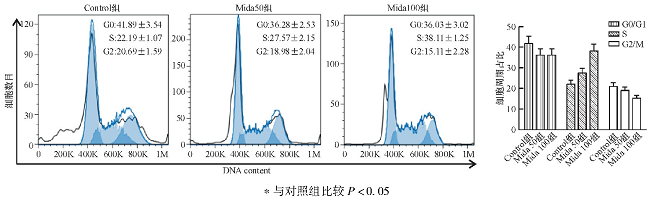
2.4、 咪达唑仑通过抑制ERK1/2磷酸化影响人肝癌细胞生长
免疫印迹结果显示Control组、Mida50组和Mida100组以GAPDH作为内参, ERK1/2的蛋白水平没有差异, p-ERK1/2的蛋白水平有明显下调。见表3、图4。
图2 流式细胞仪检测咪达唑仑对Huh7细胞凋亡的影响
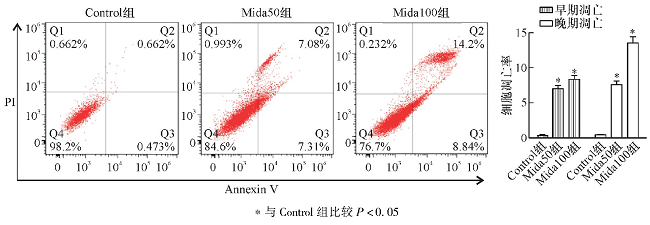
*与Control组比较P<0.05
*与Control组比较P<0.05
图3 流式细胞仪检测咪达唑仑对Huh7细胞周期的影响
3、 讨论
近年来越来越多的研究发现手术中麻醉相关技术可能影响肿瘤患者的预后和进展。有一篇回归性分析指出吸入麻醉药与静脉麻醉药相比, 术中使用吸入麻醉药维持麻醉的患者病死率更高[4]。静脉麻醉药具有这种优势的原因目前还未明了, 但是可能与免疫功能调节和肿瘤生长因子的影响有关。咪达唑仑是一种常用的静脉麻醉药, 广泛用于术前诱导和镇静[5]。目前已有报道描述了咪达唑仑可以促进睾丸间质肿瘤细胞的凋亡[2], 但它在肝细胞癌中的影响仍然未有报道。
肝细胞癌作为全球第二大常见肿瘤, 并且近年来肝细胞癌的发生率有上升的趋势[5], 所以在肝细胞癌的诊疗上很重要的一环是寻找其发生发展的相关机制。目前公认的其中一种肿瘤靶向治疗是有关于凋亡的, 尤其在肝细胞癌中凋亡是其中一个很重要的机制[6]。本研究通过体外细胞实验证明咪达唑仑具有抑制肝癌细胞生长的潜能, 并且也证明了咪达唑仑能促进肝癌细胞发生凋亡和细胞周期停滞。
图4 免疫印迹检测咪达唑仑对Huh7细胞的ERK1/2及p-ERK1/2蛋白水平的影响
目前已有研究证明咪达唑仑具有影响肿瘤的潜在作用。Mishra等[7]研究显示咪达唑仑可以促进淋巴瘤细胞和肠癌细胞的凋亡并且其细胞周期停留于S期, 这一结果与本研究结果相一致。Chen等[8]也报道了瞬时受体蛋白M型可以逆转咪达唑仑引起的恶性胶质瘤细胞增殖减少这一效应, 也间接证明了本研究结果的可靠性。咪达唑仑作用的受体于外周是作用于外周型苯二氮艹卓类受体 (peripheraltype benzodiazepine receptor, PBR) 。已有报道PBR参与很多细胞活动, 其中包括细胞增殖、细胞死亡、氧化应激以及肿瘤的增殖和凋亡[9]。目前仍然鲜有报道咪达唑仑与PBR在细胞增殖, 尤其肿瘤增殖和凋亡上的关系, 所以咪达唑仑是否作用于PBR影响肿瘤的发生、发展仍然需要研究去验证。MAPKs信号通路在细胞生长, 诱导分化增殖和生存具有重要的作用[10]。本研究发现咪达唑仑作用于人肝癌细胞会使其p-ERK蛋白水平下调。Li等[11]研究显示咪达唑仑可以通过JNK-ERK通路减少运动神经的氧化应激水平。由于氧化应激广泛出现在肿瘤细胞, 包括肝细胞癌, 并且使其发生细胞凋亡和细胞周期停滞[12], 所以我们认为咪达唑仑可能是通过ERK信号传导通路影响肝细胞癌的增殖, 凋亡和细胞周期。
肝细胞癌目前主要的治疗手段仍然是手术切除, 由于麻醉与手术的密切关系, 在肿瘤患者的手术中麻醉用药就显得十分重要。贯穿整个围术期, 包括术前诱导、术中及术后的辅助镇静, 咪达唑仑是一种暂不可取代的静脉麻醉药。在本研究中, 我们使用咪达唑仑作用于人肝癌细胞, 发现咪达唑仑能浓度依赖性和时间依赖性地抑制肝癌细胞的生长, 并从细胞凋亡和细胞周期的角度出发, 也发现了咪达唑仑具有诱导凋亡和细胞周期停滞的潜能。此外, 免疫印迹的结果发现咪达唑仑可以抑制肝癌细胞ERK的磷酸化。
综上所述, 在体外肝癌细胞实验中, 咪达唑仑可能通过ERK通路影响人肝癌细胞的增殖, 凋亡和细胞周期, 提示咪达唑仑在肝癌患者的手术中使用是有益的, 为日后肝癌患者手术的麻醉药物的选择提供了新的依据。
参考文献:
[1]Matsushita D, Uenosono Y, Arigami T, et al.Clinical Significance of Circulating Tumor Cells in Peripheral Blood of Patients with Esophageal Squamous Cell Carcinoma[J].Ann Surg Oncol, 2015, 22 (11) :3674-3680.
[2]So EC, Chen YC, Wang SC, et al.Midazolam regulated caspase pathway, endoplasmic reticulum stress, autophagy, and cell cycle to induce apoptosis in MA-10 mouse Leydig tumor cells[J].Onco Targets Ther, 2016, 27 (9) :2519-2533.
[3]Maluccio M, Covey A.Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma[J].CA Cancer JClin, 2012, 62 (6) :394-399.
[4]Wigmore TJ, Mohammed K, Jhanji S.Long-term Survival for Patients Undergoing Volatile versus IV Anesthesia for Cancer Surgery:A Retrospective Analysis[J].Anesthesiology, 2016, 124 (1) :69-79.
[5]康凯, 孙彤, 陈明.地佐辛联合咪达唑仑持续泵注在ICU机械通气中的镇静效果[J].广东医学, 2015, 36 (21) :3296-3298.
[6]刘清, 罗永胜, 王伟, 等.凋亡素联合阿霉素与顺铂对肝细胞癌的凋亡作用研究[J].广东医学, 2009, 30 (7) :1035-1037.
[7]Mishra SK, Kang JH, Lee CW, et al.Midazolam induces cellular apoptosis in human cancer cells and inhibits tumor growth in xenograft mice[J].Mol Cells, 2013, 36 (3) :219-226.
[8]Chen J, Dou Y, Zheng X, et al.TRPM7 channel inhibition mediates midazolam-induced proliferation loss in human malignant glioma[J].Tumour Biol, 2016, 37 (11) :14721-14731.
[9]Casellas P, Galiegue S, Basile AS.Peripheral benzodiazepine receptors and mitochondrial function[J].Neurochem Int, 2002, 40 (6) :475-486.
[10]王伟飞, 王新颖, 姜泊.以MAPK通路为靶向的肿瘤生物治疗[J].广东医学, 2010, 30 (1) :118-120.
[11]Li GZ, Tao HL, Zhou C, et al.Midazolam prevents motor neuronal death from oxidative stress attack mediated by JNK-ERKpathway[J].Hum Cell, 2018, 31 (1) :64-71.
[12]董育玮, 陆伦根.氧化应激在肝细胞癌中的研究进展[J].胃肠病学, 2013, 18 (5) :304-306.
- 相关内容推荐
- MiR-145表达水平变化对口腔癌细胞CAL27增殖凋亡的影响2014-05-24
- 联合检测甲胎蛋白异质体和甲胎蛋白诊断肝细胞癌2015-01-12





