摘 要: 激光散斑衬比成像(Laser Speckle Contrast Imaging, LSCI)是一种非扫描式实时血流动力学成像技术,具有高分辨率、快速实时成像、非接触、仪器结构较简单等优势。尽管由于深度分辨率的限制,LSCI主要用于浅表组织测量,但其在神经疾病、皮肤病等领域的基础研究及临床应用中展现出良好的应用潜力。本文简要地介绍了激光散斑衬比成像技术的基本原理与技术进展,综述了其在脑卒中、吸毒成瘾、阿尔兹海默症等脑疾病以及其他脑科学应用中的研究进展,并展望了其发展前景。
关键词: 激光散斑衬比成像; 血流动力学; 脑科学研究;
Abstract: Laser speckle contrast imaging (LSCI) is a powerful and simple non-scanning real-time hemodynamic imaging method, with the advantages of high spatial and temporal resolution, wide imaging field, high-speed imaging, low damage, relatively simple instrument structure. After decades of development, it already has had the ability to quantify flow changes with higher resolution. Although LSCI is limited to superficial tissue imaging due to the limitation of depth resolution, it has been playing an important role in the studies and clinical applications of biomedical fields such as dermatology and neurological disease research. This paper briefly introduces the basic principle, typical device and technical progress of LSCI, and reviews the recent progress in brain diseases such as stroke, drug addiction, Alzheimer's disease and other applications of brain science. Finally, we discuss the prospects for development of LSCI in the study of brain science.
Keyword: laser speckle contrast imaging; hemodynamic imaging; study of brain science;

引言
大脑的正常生理功能依赖于神经活动与血流动力学之间的紧密配合,这种机制称为神经血管耦合(neurovascular coupling, NVC)。神经血管耦合作为神经功能活动和代谢的基础,在调节局部脑血流(cerebral blood flow, CBF)以满足局部神经元活动能量需求中发挥重要功能[2]。其功能障碍可能与神经系统疾病(如脑卒中和神经退行性疾病)的发生和发展密切相关。因此,通过监测NVC功能可以实现神经系统疾病的早期诊断和评估。目前,诸如功能磁共振成像(functional Magnetic Resonance Imaging, fMRI)、功能近红外光谱术 (functional Near-Infrared Spectroscopy, fNIRS)、正电子发射计算机断层成像(Positron Emission Computed Tomography, PET)、多光子显微成像(Multiphoton Microscopic Imaging),以及激光多普勒灌注成像(Laser Doppler Perfusion Imaging, LDI)等常规神经血管影像工具极大地增进了我们对脑功能的理解[3]。大多数功能成像技术依赖于NVC来推断神经元活动的变化。例如,fMRI测量血氧水平依赖(Blood Oxygen Level Dependent, BOLD)信号、脑血容量(Cerebral Blood Volume, CBV)和CBF变化,PET测量CBF,fNIR测量脱氧血红蛋白(HbO2)和总血红蛋白(HbT)的变化。然而,这些成像技术各自具有一定的局限性,如fMRI、PET空间分辨率低,约1 mm,荧光成像需要荧光分子标记,双光子成像视野小,难以评估大体积皮层(>1 mm 3)中的神经元和血管网络等[4,5]。在活体脑中以大视野范围对大脑皮层进行长期的神经血管动力学成像成为一项挑战。激光散斑衬比成像技术是一种无需扫描的大视场血流成像技术,能够以数微米的空间分辨率对数平方毫米视野范围进行长期、动态评估神经元活动相关的血流动力学反应,相比于其他成像技术具有以下优势:
(1)具有较高的时空分辨率。激光散斑成像系统目前已经能够达到毫秒量级的时间分辨率和微米量级的空间分辨率,能够实时捕捉神经元激活引起的血流动力学反应,并能将动、静脉血管变化区分开来;
(2)成像无需扫描,可实时快速成像;
(3)成像无需造影剂,能够实现非接触成像,具有非侵入性;
(4)具有长期、动态测量血流动力学的能力。
早在十八世纪,牛顿就已经通过观察到的“恒星发光而行星不发光”的现象来说明了随机介质散射光会在空间形成干涉斑纹的现象。20世纪60年代初,随着激光器的发明,激光散斑现象逐渐开始被关注与研究[6,7] ,例如物体速度测量[8],表面粗糙度评估[9]等。1981年,Briers等[10]发展了将散斑衬比和散射光场去相关时间联系起来的理论模型,进而获得血流的相对流速。LSCI逐渐应用于诸多生物医学领域,如视网膜[11]、皮肤[12]及脑部[13]的疾病诊断与研究等。由于LSCI在NVC动力学成像方面的特色,其在脑科学研究领域中展现出巨大的潜力。
1 、激光散斑衬比成像技术的基本原理与技术进展
1.1、 基本原理
光学粗糙的表面被激光照射后,反射或背向散射光由于到达成像面的光程差不同而互相发生干涉,产生由暗点和亮点组成的颗粒状图案,称为散斑[14]。如果受照样品是静态的,散斑图案将保持不变(静态散斑图案)。如果样品中存在运动的散射体,如血红细胞,则图像中的各像素处的光强会随时间发生变化 (动态散斑图案)。散斑图案强度在空间和时间上的变化包含着运动散射体的速率信息,散射体运动速率越快,散斑图案波动越快,CCD相机或CMOS相机在曝光期间记录的散斑图案越模糊[15]。模糊程度可以通过计算散斑衬比值K来量化,K被定义为光强的标准偏差σ与光强平均值<I>的比值:
K=σ/<I>(1)
在空间域和时间域上分别计算K,分别可以得到空间散斑衬比值Ks与时间散斑衬比值Kt。对于完全散射静态散斑图案,其散斑衬比值在理想条件下为1。在实际成像情况中,0 ≤K≤ 1。对于动态散斑图案,在相同条件下测得的K越小,即散斑图案越模糊,则散射体运动速度越快。
根据动态光散射近似模型,散斑衬比值 K可以表示为散斑成像曝光时间T和电场去相关时间τc的比值(T/τc)的函数:
K=βexp(?2T/τc)?1+2T/τc2(T/τc)2???????????????√, (2)
其中β是一个用来校正由光源相干性、偏振特性,及探测器像素尺寸与散斑尺寸之比等因素引入的常数。一般认为:
v∝1/τc(3)
根据公式(2)和(3),就可以通过计算K2的变化来对散射体流速变化进行定量分析。当T ?τc 时,K2与τc近似呈线性关系。在流动血液中,直径5-8μm的运动血红细胞作为主要的运动散射体,LSCI通过探测器获取激光照射血管后散射形成的散斑图案,然后利用其散斑衬比值K来获取血液流速信息。
1.2、 典型装置
激光散斑成像系统结构分为反射式和透射式两种,其中反射式系统多用于组织样品的成像研究。典型的反射式成像系统装置如图1所示。将激光束扩束调节为所需的尺寸,使其均匀地照射感兴趣区域。照明区域散射粒子(如红细胞)的散射光相干形成的散斑信号通过光学成像系统成像到CCD或CMOS相机上。计算机采集获得原始散斑图像并通过衬比分析计算相关的血流分布。
图1 激光散斑衬比成像装置
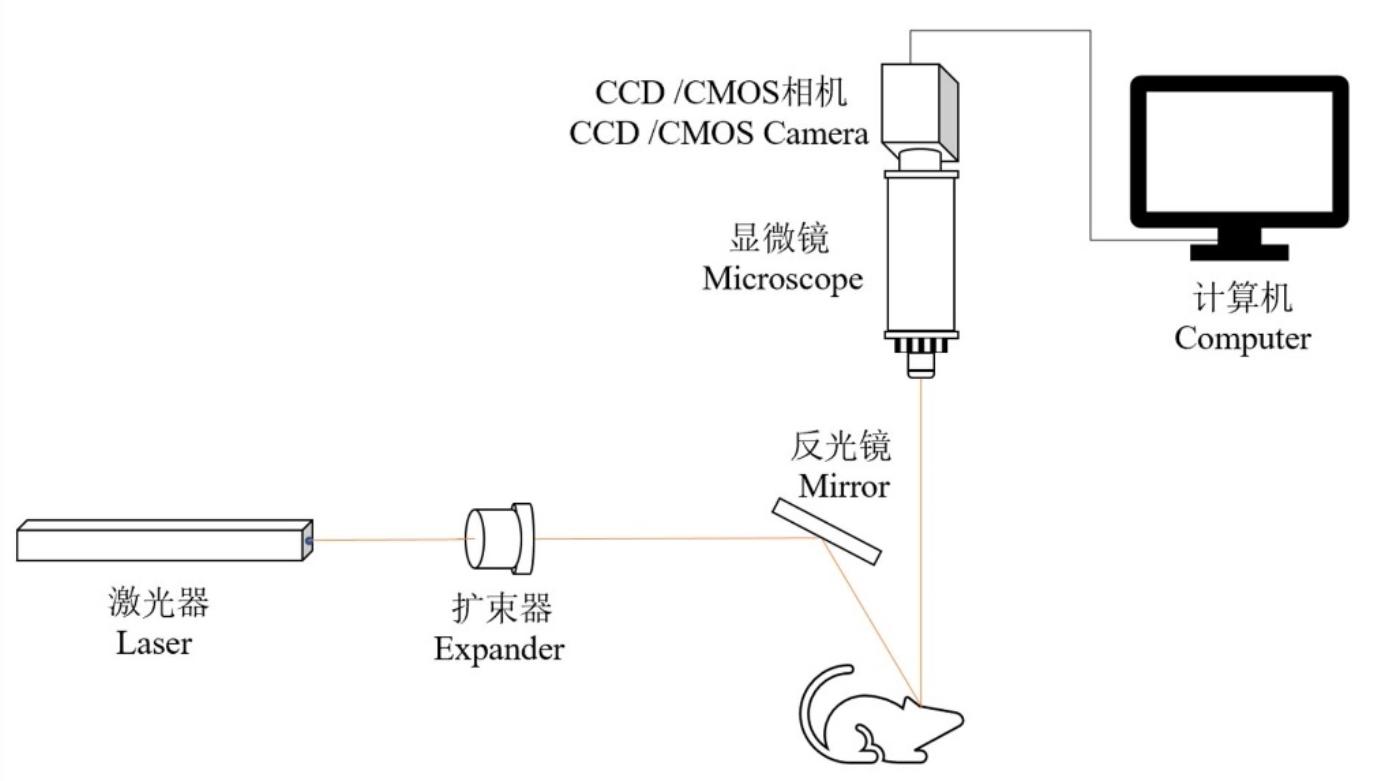
Fig.1 Laser Speckle Imaging Device
成像装置主要包括:Laser:激光器;;Expander:扩束器;Mirror:反光镜;Microscope:显微镜;CCD/CMOS Camera:CCD/CMOS相机;Computer:计算机
1.3 、技术进展
随着在生物医学领域应用的发展,激光散斑成像系统要求具有更高的成像质量、更大的成像视野、更小的成像装置体积,以及更快的处理速度。对比度、时空分辨率、信噪比和成像深度等指标通常用于衡量激光散斑血流成像的质量[16]。Qiu等[17]通过在不同帧数和空间窗口的条件下,使用时空激光散斑对比度分析(STLASCA)方法计算得到了最大的散斑对比度。该优化方案通过空间和时间统计来降低图像噪声,同时保持可接受的时空分辨率。Hong等[18]基于在实际测量中不同的采样帧数对时间散斑衬比计算值的影响,建立了一个采样帧数矫正模型,并给出了采样帧数和统计噪声的关系式,在给定信噪比的情况下为选取尽量少的采样帧数提供了依据。Skipetrov等[19]给出了在不同散斑尺寸下空间散斑衬比的平方的波动与采样帧数之间的关系式。为了更精确地消除采样帧数的影响,Hong等[20]提出了一种基于自逆协方差的激光散斑流速估计方法。这种方法测得的流速均值不受采样帧数的影响,而且相较于LSCI,该方法具有更低的统计噪声和更快的计算速度。Li等[21]提出了将波前整形技术与激光散斑时间对比度分析相结合来估计运动物体相对速度变化的方法,基于散射介质的光学记忆效应,通过对光的相位进行空间控制来补偿随机散射引起的相位畸变,从而实现对散射光的实时宽场成像。深度成像方面,通过使用梯度折射率透镜[22]、利用扩散光子的衬比分析[23,24] 或光透明技术[25],LSCI能够对于更深组织进行成像。此外,研究者们还提出了通过血流组织与周围组织的散射比值校准法、基于广义差分算法的散斑衬比算法、多幅图像加权平均计算法等成像优化算法来提升图像质量[26,27]。
在适合成像的条件下,散斑衬比值K与血液流速呈反比关系,因此可以通过K定性或半定量地分析血流速度。Li 等[28]使用散斑衬比的频域函数分析方法,部分消除了光源强度变化对定量测量流速的影响。Miao 等[29]使用背向散射图像量化了局部散射特性对流速估计的影响,校正了由于散射特性的不均匀分布造成的估计偏差。Buijs等[30]利用傅立叶变换的新处理算法,将原始散斑图样转换为微观运动图,能够快速定量成像,且比现有的定量方法快几个数量级。然而,由于静态组织散射光的存在,单次曝光LSCI难以量化基线或绝对血流,LSCI测量血流变化的定量精度可能会受到限制。Zakharov等[31]提出了一个静态散射矫正模型,通过使用连续的两帧散斑图案计算得到静态成分所占比重,然后代入模型中就可以消除静态散射的影响,恢复真实的流速估计值。Parthasarathy等[32]提出利用散斑衬比对相机曝光时间的依赖性来获取静态散射成份,进而消除其对流速测量的影响,该方法被称为多曝光散斑成像(Multi-Exposure Speckle Imaging,MESI)。Wang等[27]通过时间散斑衬比和空间散斑衬比来计算动态散射光占总光强的比率,在单一曝光时间下,消除了静态散射对流速测量准确性的影响。
曝光时间是影响LSCI方法最终结果的一个重要因素。不同的曝光时间对不同的散射体速度敏感度不同。较短的曝光时间更适合于分析快速移动的散射体,因为在短曝光时间内,只有快速移动才会造成模糊。相反,较长的暴露时间对较慢的流量更为敏感。然而,曝光时间变短或过长都会以不同的原因降低信噪比。Kazmi等[33]对最佳曝光时间的测量及优化进行了深入研究,以缩短采集时间。为了避免重复的体外校准,已经提出了利用MESI来映射散斑对比度值与相机曝光时间的依赖关系以提高精度[34,35]。Wang等[36]通过对散斑衬比成像中的噪声进行分析,指出了探测系统噪声是曝光时间影响速度测量灵敏度的重要原因,流速测量的灵敏度随着速度增大会逐渐降低,严重影响了LSCI定量检测的准确性,同时,该作者提出了一种噪声矫正模型,扩大了流速的线性响应范围,提高了LSCI的灵敏度。
激光散斑成像系统组成结构较为简单,适合于与其他成像技术结合构成多模式光学成像平台(multimodal optical imaging platform, MIP),以实现多参数测量。Gu等[37]构建了一种MIP,由多波长光谱荧光成像、三维光学相干层析成像以及激光散斑对比成像模块集成(MW-LSCI),能够同时进行血管造影、血流量测量、血红蛋白总量测量和神经元钙成像,以实时监测脑神经血管变化。另外,也有研究提出LSCI与离轴全息成像系统、空间频域成像技术、光学投影层析成像技术、临床内窥镜系统等相结合进行多模态成像[38],能够达到10 μm的深度分辨率。
研究者们就成像方式与算法进行了进一步研究。Liu等[39]通过图形处理器(graphics processing unit, GPU)对激光散斑成像的数据进行处理,将数据处理速度提高了12-60倍,实现了在个人计算机上对血流速度的快速和高分辨率可视化。Tang等[40]实现了一种基于数字信号处理器(digital signal processor, DSP)的便携式激光散斑灌注成像系统以及适用于DSP的算法。通过高度集成的DSP和算法,在保持较高处理速度的同时,显着减小了系统的尺寸和重量以及能耗。该便携式激光散斑灌注成像系统可以每秒25帧的速度获取分辨率为640×480像素的血流图像。Jiang等[41]提出了一种用于在现场可编程门阵列(Field programmable gate array, FPGA)中实时处理激光散斑成像的专用数字电路,以及基于片上系统解决方案的LSCI系统,该系统能够利用大约100帧640×480原始图像中的整个数据来实现高速实时LSCI处理。这种处理方案非常适合用于设计紧凑的手持LSCI系统,因为其体积小且功耗低,具有高性能和稳定性。图像处理技术、数据智能算法及成像装置小型化的发展扩大了LSCI的应用领域,如术中监测或临床诊断等,使个性化及穿戴式医疗成为可能[42]。
2 、激光散斑成像技术在脑卒中研究中的应用
2.1、 脑卒中的病理特征
脑卒中是全球导致死亡和残疾的主要疾病之一,每年致死人数约占全世界死亡人数的12%[43]。脑卒中是由脑血管的出血或闭塞引起的病理状态,分为出血性脑卒中(包括脑出血和蛛网膜下腔出血)和缺血性脑卒中(包括脑梗塞和脑血栓)。其中,缺血性脑卒中更为常见,约占所有病例的85%。大多数卒中患者因血液供应异常而患有不可逆转的神经功能缺损或永久性残疾,表现为面部或单侧肢体麻木无力、言语不清、视物障碍、意识障碍等,最终导致严重的脑损伤、瘫痪甚至死亡[44]。对于脑卒中患者,受干扰的脑血流和输氧量直接损害正常脑功能。监测这些血液动力学参数可以清晰地了解脑卒中的病理学进展,以指导治疗手段。在以往的研究中已经使用了激光多普勒血流测量技术、MRI和PET测量脑卒中动物模型中的脑血流变化,但是这些技术的空间和时间分辨率通常不足以实现血流动力学研究[45]。LSCI能够以高时空分辨率量化卒中过程中空间与时间上的血流变化,对于脑卒中的病理学分析具有重要意义。
2.2 、激光散斑成像技术在脑卒中模型研究中的应用
软脑膜吻合(Leptomeningeal Anastomose,LMA)是连接大脑中动脉、前动脉和后动脉的一个辅助血管网络[46]。缺血性脑卒中后,大脑侧支循环(存在于大脑动脉之间的吻合网络)有助于维持脑血流量(CBF)。当主要血管通路被阻断时,可以部分维持流向缺血组织的血流量,为闭塞动脉区域的皮质层提供了血流补充。在临床上,软脑膜侧支的血流决定了皮质梗塞半暗带(缺血核心和正常组织之间的区域)的缺血程度,从而影响梗塞的发展、预后和治疗反应[47]。Biose等[48]通过观察动脉闭塞大鼠模型的脑侧支循环灌注量变化,来研究卒中危险因素(急性高血糖和慢性高血压)对卒中的影响。采用激光散斑成像技术(LSCI)观察自发性高血压卒中易感大鼠和血压正常的永久性大脑动脉闭塞大鼠,卒中及其并发症对皮层动脉及侧支血流灌注(CBF)的影响。结果显示,在无动脉闭塞的大鼠中,皮层灌注保持稳定。在动脉闭塞的大鼠中,动脉闭塞后30min内,皮层灌注量显着减少,随后的3.5h内通过皮质侧支逐渐增加,对侧非缺血性半球的灌注量不随时间变化,而急性高血糖和慢性高血压则减弱了动脉闭塞后皮质灌注的恢复。因此,动脉闭塞时的高血糖或既往存在的高血压损害了动脉闭塞后皮质侧支的动态血流补充,而侧支血流补给的阻碍可能会进一步恶化卒中的不良影响。Pan等[49]研究了右大脑半球初级躯体感觉前肢皮质区的局灶性光血栓性缺血(Photothrombotic Ischemic,PTI)卒中大鼠,观察了经前肢电刺激后,其通过侧支循环增加到缺血半暗带及初级躯体感觉皮质的CBF,以研究电刺激法对于局灶性缺血性卒中治疗的有效性。结果表明,特异性电刺激法可以通过增强大脑前动脉-大脑中动脉的动脉间吻合介导的侧支循环,进一步恢复卒中模型的脑血流量(如图2),该方法为卒中康复提供了一种可行的治疗干预措施。雷帕霉素是一种哺乳动物雷帕霉素靶蛋白(mammalian Target Of Rapamycin,mTOR)的抑制剂,可以通过调节一氧化氮的释放来调节脑疾病引起的脑血流量变化[50]。Wang等[51]通过LSCI测量发现,雷帕霉素治疗后,动脉闭塞小鼠的大脑皮层后动脉-中动脉之间及大脑前动脉-中动脉之间的侧支数量和灌注水平均增加(如图3),表明雷帕霉素可促进卒中诱导的缺血区侧支循环灌注。Leardini等[52]通过评估脑缺血模型大鼠的微血管CBF,发现在脑缺血初期进行有氧运动训练能够有效预防由于脑灌注不足引起的微血管病变。年龄也是决定缺血性卒中预后的关键因素之一,脑缺血发作后软脑膜侧支的动态变化可能随年龄而变化。Ma等[53]采用LSCI对幼年和老年雄性大鼠大脑中动脉远端闭塞过程中大脑前动脉-中动脉之间的软脑膜侧支灌注进行了监测。组织学分析显示,老龄大鼠缺血损伤体积明显大于青年大鼠;同时,脑侧支灌注随时间而下降,而且这种下降在老年大鼠中更为显着。因此,与年轻成年大鼠相比,老年大鼠的软脑膜侧支动力学明显受损,侧支衰竭更为严重。Bo等人的研究旨在探讨缺血性脑卒中急性期的神经血管耦合损伤。应用LSCI技术研究了正常和缺血大脑感觉运动神经元对光遗传刺激的血流动力学反应。结果表明,无论静止期CBF有无变化,急性期光遗传学刺激引起的血流动力学反应降低,局部CBF反应与离缺血核心的距离有关。同时,缺血后24h兴奋性神经元的刺激可促进神经血管耦合的恢复[54]。
图2[49] 接受电刺激前后大鼠右脑前肢体感皮层PTI卒中区域的激光散斑血流变化成像
![图2[49] 接受电刺激前后大鼠右脑前肢体感皮层PTI卒中区域的激光散斑血流变化成像](/uploads/allimg/210304/36-21030410062aI.jpg)
Fig.2[49] CBF in PTI stroke area of right forelimb sensory cortex of rats by LSCI before and after electrical stimulation
对照组、电刺激前肢组和电刺激后肢组的前肢体感皮层PTI卒中区域CBF随时间(每隔15分钟)的相对变化。
图3[51] 激光散斑脑血流成像显示雷帕霉素改善了大脑中动脉区域的血液供应。
![图3[51] 激光散斑脑血流成像显示雷帕霉素改善了大脑中动脉区域的血液供应。](/uploads/allimg/210304/36-210304100G0I0.jpg)
Fig.3[51] CBF by LSCI showed that rapamycin improved the blood supply in the middle cerebral artery (MCA)territory
激光散斑成像显示对照组与雷帕霉素组的小鼠大脑中动脉阻塞(MCAO)前后、注射盐水/雷帕霉素后10分钟和60分钟、再灌注后10分钟和120分钟的皮质侧支循环血流变化。箭头表示新形成的侧支循环。
除了脑血流量之外,其他血液动力学及神经元活动参数,如血红蛋白氧合、血流速、神经元细胞钙离子变化等也经常用于脑疾病研究[55]。由于LSCI的测量对激光波长相对不敏感,它可以与其他光学技术相结合,实现动脉与静脉的血流和其他血液动力学参数同时成像[56]。另外,由于LSCI能够长期实时成像,它可以为结合的其他成像技术提供精准的成像时间点,以便于更为精确地观察脑血流动力学的变化。Liu等[57]采用LSCI和可见光光学相干断层扫描(Visible-light Optical Coherence Tomography,Vis-OCT)相结合的多模态成像方法,对啮齿类动物大脑中动脉闭塞模型急性期的动态血管反应进行研究。LSCI提供全场Vis-OCT实时成像指导和动态CBF监测,Vis-OCT提供深度分辨血管造影和氧饱和度(sO2)测量。结果显示动脉闭塞后脑皮质CBF迅速下降,且动脉CBF的下降程度大于静脉。同时,动脉和小动脉中sO2含量变化不大,而静脉和小静脉中sO2含量下降。在动脉闭塞后再灌注期,大部分静脉中sO2继续下降,可能因为再灌注后从血液到组织的氧气释放增加,其中较高分支度的静脉产生更大程度的sO2下降。Sullender等[58]将LSCI与数字微镜器件(DMD)相结合,利用基于磷光猝灭剂的氧敏感探针进行磷光信号定位,监测动脉阻塞期间脑皮层动脉静脉的灌注量与氧分压(pO2)的变化。对缺血性病变进行8天的长期追踪,结果显示其迅速产生恢复,目标血管完全再灌注,pO2在5天内恢复到基线值。梗塞周围去极化(peri‐infarct depolarizations,PIDs)是在缺血性损伤后自发产生的,发生于半暗带区,导致半暗带细胞死亡,影响侧支循环的血流供应,缺血损伤程度也随之进一步增加[59]。Rakers等[60]结合LSCI与多光子显微镜证明PID与星形胶质细胞和神经元细胞内钙的强烈增加有关,而与局部CBF变化无关,表明其细胞钙途径可能是卒中治疗的潜在靶标。此外,为了在动物自由活动的状态下进行多参数监测血流动力学,研究人员发展了小型化便携式的监测设备。Levy等[61]提出了一种新的成像系统,其使用最小的光学元件,可以很容易地改装成便携式系统,用于连续监测皮质血流动力学。它结合了LSCI和本征光学信号成像两种技术,利用聚集的激光源,以高时间采集率进行全场监测皮层缺血情况。他们进一步证明了联合使用散斑对比度和氧合测量能够确定绝对流速,以及在统计上区分静脉和动脉。该系统是利用应用于680 nm、795 nm和850 nm的垂直腔面发射激光器的相干降低技术来实现的。以上结果表明,以LSCI为导向的多模态成像系统或将成为脑卒中疾病中血液动力学研究的有利工具。
近年来,LSCI基于无损伤成像且便携的优势,也逐渐应用于临床脑血流监测[62]。通过开发的无创模块化工具,可将高分辨率LSCI直接传输到手术显微镜的目镜上,实现手术野的活体形态学监测[63]。缺血性脑损伤是神经外科手术的主要并发症,术中实时监测脑血流可以即时检测到患者的脑缺血状况[64],而脑灌注的阈值限制可用于识别具有缺血损伤风险的脑组织。Hecht等[65]采取了非侵入性术中激光散斑成像(intraoperative LSCI,iLSCI)对22例恶性半球脑卒中减压手术患者进行了脑梗塞预测。术中用iLSCI实时记录皮层灌注。根据MRI图像,将成像场内的实体梗塞形态范围叠加到iLSCI血流图上,并进行扩散加权成像重建。基于梗塞与非梗塞区iLSCI灌注值的频率分布,计算了最终梗塞或非梗塞的标准化CBF预测的概率曲线和灌注阈值。根据确定的灌注阈值将所有的标准化CBF划分为三个组,分析显示梗塞(CBF变化量≤40%)和非梗塞(CBF变化量≥110%)灌注值覆盖整个皮质表面区域的62%和11%,共占皮质区域的73%,而这些阈值之间的灌注值(≥40%,≤110%)仅占皮质区域的27%。结果显示,iLSCI能够为73%的皮层区域提供可靠的预测(准确率>95%),而在27%的脑组织中,灌注值显示恶性半球脑卒中患者的预后不确定。结果表明iLSCI对术中人脑血流变化的评估是有效的,并且可以用于识别大部分在缺血性卒中过程中的梗塞风险组织。为了避免术后缺血性并发症,在血管实质内肿瘤和动静脉畸形等病变的切除手术中监测动脉血流变化是必要的。Makoto等[66]对12例肿块病变相关动脉、脑肿瘤或动静脉畸形患者行iLSCI检查。使用便携式iLSCI装置连续记录动脉暂时阻断前后的相对CBF。根据CBF波动情况将动脉分为供血动脉(Feeding Artery,FA)、流通动脉(Passing Through Artery,PA)和FA-PA联合动脉(FA+PA)三种类型,再分类监测记录,使得不同类型的动脉CBF波动引发的状况均能及时得到适当的处理。检查结果显示,在12例患者中,FA(n=8)、PA(n=2)和FA+PA(n=2)三类动脉暂时中断后,观察到CBF下降,脑血流量平均下降15.3%±29.0%。其中,11名患者(92%)没有产生缺血性并发症,只有1名患者因其在经动脉切除术中由于LSCI成像深度限制而无法实时监测血流,导致术后产生了缺血性病变。iLSCI可以在术中无创、快速地实时识别大量的脑皮层病变相关血管,能够有效避免缺血并发症的发生。
3 、激光散斑成像技术在吸毒成瘾研究中的应用
3.1、 吸毒成瘾的病理特征
吸毒成瘾是一种神经精神障碍疾病,可以定义为对可卡因、海洛因、大麻、摇头丸等麻醉或精神类成瘾药物的使用失去控制,尽管面临不利后果但仍强迫性地寻求和服用药物。全球每年吸毒致死的人数高达20万,丧失劳动能力的人约1000万,严重破坏经济和社会发展[1]。截至2018年底,我国现有吸毒人员约240.4万名。早在18世纪后期,本杰明·拉什(Benjamin Rush)提出吸毒成瘾是意志力的道德失败的想法。直到1994年,成瘾疾病才逐渐被全面地定义为由心理生理学变化(耐受性和戒断)与认知能力障碍共同导致[67]。通过神经成像技术观察到,当患者吸食毒品(如可卡因)后,其作用于脑内多巴胺神经通路中的多巴胺能神经元, 增加多巴胺释放,并作用于多巴胺受体,使大脑产生快乐和满足感,从而完成奖赏效应,最终导致药物成瘾[68]。腹侧被盖区 (Ventral Tegmental Area, VTA),伏隔核 (Nucleus Accumbens, NAc)以及内侧前额叶皮层 (medial Prefrontal Cortex, mPFC)等多个脑区共同组成奖赏通路。目前,fMRI[69]、fNIRS[70]、PET[71]、LSCI等成像技术均可用于吸毒成瘾研究中的神经血流成像,LSCI以其高分辨率、无损伤、成像速度快等优势在吸毒成瘾模型中的研究发挥了重要的作用。
3.2、 激光散斑成像技术在成瘾模型研究中的应用
可卡因是最常滥用的成瘾药品之一,长期使用可卡因会导致脑血管系统损坏。目前,大多数研究可卡因对大脑影响的临床前影像学研究都是在麻醉下进行的,这可能会影响研究结果[72]。为了解决这个问题,Du等[73]利用多波长光谱和激光散斑技术构成的光学成像系统对小鼠大脑的体感皮层成像,该多模态成像系统可以利用不同波长的红外光源同时测量神经元活动和各项血液动力学的变化,以评估小鼠大脑在清醒状态和麻醉状态下对可卡因的反应。为了评估大脑体感皮层中的血流动力学,测量了氧合血红蛋白([HbO2]),脑血流速度(CBFv)和血管直径(Δ?)的动态变。为了评估神经元活性,使用AAV1.Syn.GCaMP6f.WPRE.SV40病毒在体感皮层中表达GCaMP6f钙离子探针,以监测细胞内神经元活动标记物(Ca2+)的活性。结果显示麻醉剂使小鼠脑血管扩张,脑血流量增加,神经元Ca2+活性降低;而急性可卡因(1 mg/kg iv)使麻醉状态下小鼠脑血管(动脉和静脉)收缩,脑血流量和氧合血红蛋白降低,神经元细胞内Ca2+积累(活性增加),这可能是由于可卡因引起的血管收缩导致短期血流中断并减慢血液流速,从而限制了组织的氧气供应。以上结果表明血管和神经元对可卡因的反应都受到麻醉剂(异氟醚)的影响,进一步明确了在研究可卡因或其他药物对大脑的影响时,对清醒动物成像的重要性。
前额叶皮层(prefrontal cortex, PFC)是与人的思维活动和执行功能密切相关的脑区。可卡因成瘾与前额叶皮层的功能障碍有关,可促进复发和强迫性服药[74]。前额叶功能障碍部分归因于可卡因引起的多巴胺纹状体回路的破坏,而可卡因对脑血管的直接破坏也可能导致和加剧前额叶功能低下。为了评估可卡因是否通过影响神经元和血管活性而导致PFC功能障碍,以及它们是否在可卡因戒断后恢复,Du等[75]在大鼠自我给药和小鼠非偶发模型(如图4A)中使用集成光学成像系统进行研究。集成光学成像系统由多波长光谱荧光成像、三维光学相干层析成像以及激光散斑对比成像模块组成,以测量脑血流量(CBF)、脑血流速(CBFv)、血管直径(Δ?)、新生血管密度以及神经元细胞的Ca2+活性。结果显示,在两种动物模型中,可卡因引起显着的PFC血管收缩和CBF减少(如图4B-E),并且随着可卡因的慢性暴露和摄入量增加而加剧,表明无论以何种方式摄入可卡因,其均会对PFC的功能产生一定影响。在血管收缩区域观察到有明显的血管增生,可能是由于脑血流量减少而产生的补偿现象。使用Ca2+拮抗剂硝苯地平进行毒品戒断后,大鼠的神经元活动显着降低(如图4F-G)。然而,即使在可卡因戒断一个月之后,CBF仍然没有恢复到初始状态,表明可卡因引起的PFC功能缺陷在戒毒后至少一个月仍持续存在。以上结果表明,可卡因通过诱导CBF减少导致神经元缺陷,从而导致额叶下垂和成瘾时强迫性可卡因摄入,并且该功能障碍在戒毒后至少一个月内尚无法恢复。
图4[75] 可卡因诱导的小鼠PFC血流速度与神经元活动的变化
![图4[75] 可卡因诱导的小鼠PFC血流速度与神经元活动的变化](/uploads/allimg/210304/36-210304100J5210.jpg)
Fig.4[75] Cocaine-induced changes in PFC blood flow velocity and neuronal activity of mice
A)小鼠非偶发模型可卡因给药方案;B)对照组小鼠急性生理盐水注射(0.1cc/100g,i.v.)后大脑PFC的动态CBFv图谱;C)慢性可卡因注射小鼠PFC对急性可卡因注射(1mg/kg, i.v.)反应的动态CBFv图;D)急性生理盐水注射后,小鼠CBFv随时间变化的过程;E)急性可卡因注射后,小鼠CBFv随时间变化的过程;F)代表性的Ca2+荧光图像;G)在时间为0时注射可卡因(1 mg/kg)后各组小鼠PFC钙离子随时间的变化曲线;
4 、激光散斑成像技术在其他脑疾病研究中的应用
4.1、 血管性认知障碍与阿尔茨海默症
越来越多的流行病学、临床和实验研究结果表明,脑微血管功能障碍和微循环损伤(神经血管耦合损伤)在多种的老年痴呆类疾病的发病机制中起着关键作用[76],包括血管性认知障碍(Vascular Cognitive Impairment, VCI)和阿尔茨海默症(Alzheimer’s Disease, AD)[77]。作为一种高分辨率、快速、微创显示局部脑微血管灌注变化的成像技术,LSCI为测量神经元激活引起的脑血流瞬间变化提供了较高的时空精度。
Tarantini等[78]给予野生型对照组(C57BL/6)和AD组(TG2576)小鼠对侧晶须机械或电刺激,采用LSCI对接受刺激后的两组小鼠体感晶须桶皮质的微血管灌注成像,结果显示AD组小鼠的CBF波动(约3%)显着低于野生型对照组(约11%),表明AD小鼠大脑的神经血管耦合可能发生损坏。通过神经血管耦合调节CBF对维持正常的认知功能具有重要作用[79]。在年迈的大脑中,氧化应激增加和脑血管内皮功能障碍损害了神经血管的耦合,可能导致年龄相关性的皮质功能下降。越来越多的证据表明,线粒体氧化应激在一系列与年龄相关的细胞损伤中起着关键作用[80]。Tarantini等[81]研究了线粒体氧化应激的衰减是否对衰老过程中的神经血管耦合反应产生有益影响(如图5)。向C57BL/6年老小鼠(24个月龄)施用细胞通透性线粒体靶向抗氧化肽(SS-31),通过LSCI测量对侧晶须刺激诱发的CBF反应来评估神经血管的耦合,并与年轻(3个月龄)、年老小鼠空白对照组比较。结果显示,与年轻小鼠相比,老年小鼠的神经血管耦合反应明显受损,而使用SS-31对其进行14天的治疗可显着提高其对于对侧晶须刺激的CBF响应,使神经血管耦合恢复至年轻小鼠中观察到的CBF水平,因为SS-31通过增加NO介导的脑血管扩张改善了神经血管耦合反应。因此,线粒体氧化应激导致了与年龄相关的脑血管功能障碍,加剧了认知功能的下降,而使用线粒体靶向抗氧化剂可能将成为预防或治疗老年相关血管性认知障碍(VCI)的微血管保护手段。
图5[81] 年轻、年老小鼠的脑皮质激光散斑血流成像图
![图5[81] 年轻、年老小鼠的脑皮质激光散斑血流成像图](/uploads/allimg/210304/36-21030410003a48.jpg)
Fig.5[81] CBF of cortex detected by LSCI in young and old mice
A)年轻、年老和SS-31治疗的年老小鼠的基线CBF代表性彩色激光散斑流量图;B)在对侧晶须刺激期间(30秒,5 Hz)各组小鼠体感晶须桶皮质区域中的相对CBF变化。
4.2 新生儿缺氧缺血性脑病及颅内出血
LSCI基于其成像的无损伤性,已经广泛应用于新生儿脑疾病的研究。新生儿缺氧缺血性脑病(Hypoxic‐Ischemic Encephalopathy, HIE)与围产期窒息引起的CBF改变有关[82]。CBF变化对损伤的影响程度,以及改善这些变化的治疗方法是否具有神经保护作用,目前尚不清楚。Wood等[83]建立了一种LSCI装置,能够同时对多个缺氧缺血性脑病啮齿动物模型进行CBF实时监测。对出生后10天(P10)的6只大鼠在单侧缺氧缺血(结扎左侧颈动脉,然后在8%氧气中缺氧)前、中、后同时连续监测脑血流量。结扎后,结扎侧的CBF较未结扎侧下降30%,缺氧导致双侧脑血流量减少55%,复苏后部分恢复。与空气复苏组比较,100%氧气复苏组结扎侧脑血流量增加45%。复苏实验1周后发现,与在空气中复苏相比,在100%氧气中复苏并没有影响大脑损伤面积及海马CA1区锥体神经元的计数。结果表明,100%的氧气复苏能够有效缓解新生儿HIE,其可能有助于收缩血管再通。同时,短期100%氧气复苏不影响神经病理学。
脑静脉循环障碍可作为新生儿应激性颅内出血(Intracranial hemorrhage, ICH)预后的信息指标,与脑动脉和微血管相比,大脑静脉对应激的有害影响更敏感[84]。因此,需要通过脑静脉血流量(CVBF)更好地了解脑出血前脑静脉系统发生的严重变化。患者时常表现为静脉血管松弛,进而引发过度脑血流灌注[85]。Pavlov等[86]利用LSCI研究了脑静脉肾上腺素依赖性舒张在新生儿脑出血发生中的作用机制,即异丙肾上腺素对肾上腺素依赖性扩张矢状窦的药理刺激对脑静脉血流动力学的影响。结果显示,新生小鼠应激性脑出血是由于血流速度(CBFv)减慢导致矢状窦扩张所致,CVBF变异性的内皮和非内皮交感成分的小波系数的方差增加,表示脑出血潜伏期的脑静脉血流动力学改变与矢状窦对异丙肾上腺素的高反应性有关。结果表明,新生小鼠对严重应激的肾上腺素能相关血管舒张反应的高度激活可能是脑出血发生的重要机制之一,与CVBF变异性的内皮和非内皮交感成分改变相关的静脉功能不全和脑血流量减少可作为出生后头几天脑出血风险的预后指标。
4.3 、其他脑疾病
家族性偏瘫偏头痛(Familial hemiplegic migraine, FHM)是最常见的神经系统疾病之一,分为家族性偏瘫偏头痛1型(FHM1)和2型(FHM2),症状表现为产生连续的低灌注和高灌注[87]。FHM1与电压门控Cav2.1钙通道的α1A亚单位突变相关,FHM2与Na,K-ATPaseα2亚型突变有关。Eikermann等[88]利用LSCI和多光子显微镜观察FHM1小鼠血流灌注、突触形态和Ca2+的变化,表现为脑血流灌注及血红蛋白量均降低,Ca2+升高和突触形态异常,这可能是偏头痛患者慢性神经退行性改变和缺血易感性增加的原因之一。Staehr等[89]应用LSCI和电生理脑片技术,比较FHM2小鼠(α2+/G301R突变型)和野生型小鼠的神经血管耦合,发现偏头痛发作时FHM2患者出现的高灌注症状是α2+/G301R小鼠内皮Kir2.1通道表达增加的结果。
创伤性脑损伤(traumatic brain injury, TBI)是一种日常和战争中均十分常见的损伤。据估计,全球每年约有1千万TBI患者[90,91]。虐待性头部创伤(Abusive Head Trauma, AHT)是TBI的一种,是婴幼儿外伤死亡的主要原因。Wang等[92]对12日龄幼鼠进行90°头伸屈矢状摆动以形成AHT动物模型。在60次反复摇头之后,幼鼠即刻出现呼吸暂停或心动过缓。LSCI评估发现损伤后幼鼠的脑血流灌注即刻显着减少,脉搏血氧仪中观察到急性氧饱和度下降,24小时内无明显改善。伤后9天开始出现可逆性感觉运动功能,到28天时完全恢复。结果显示,所有被试幼鼠均出现硬膜/蛛网膜下腔出血、脑血屏障损伤和脑实质水肿,促炎反应和反应性胶质增生上调,以此揭示了AHT引发缺氧/缺血的潜在机制。且目前已有研究者将LSCI与光谱分析法相结合,能够通过同时测量TBI小鼠的CBF和含氧血红蛋白变化(ΔHbO2)以进行更为全面的血液动力学分析。
自闭症是一种严重的发展性认知障碍,以社会交往障碍、语言和交流困难以及限制性和重复性行为为特征[93]。各种研究显示自闭症患者中枢神经系统特定区域(如海马区)的结构和功能出现异常,而脑血流异常在自闭症神经生理功能障碍的发病机制中起重要作用[94]。Abookasis等[95]利用双波长激光散斑成像(DW-LSCI)评估了BTBR基因自闭症谱系障碍小鼠模型和对照(C57BL/6J)小鼠的CBF变化,发现BTBR小鼠表现出CBF和脑氧代谢的减少。通过测量齿状回中表达双皮质素或细胞增殖标记Ki-67的神经元的数量,发现了CBF与神经发生标记之间存在很强的正相关。因此,他们发现在体脑皮质CBF的测量可以预测海马神经发生的速率,这项新的发现将皮层CBF确定为海马神经发生的预测参数。
5 、激光散斑成像技术在其他脑科学研究中的应用
5.1 、淋巴管成像
外周淋巴管系统是免疫系统的一部分,是由淋巴管和淋巴结组成的复杂网络。淋巴本身是一种液体,由大分子、白细胞和活化的抗原呈递细胞组成,其从盲端毛细淋巴管运输到集合淋巴管,再通过淋巴静脉连接返回血液循环,以此构成淋巴血管系统[96]。淋巴血管系统在人体中起着关键作用,对于组织液体的稳态、脂肪吸收、免疫反应以及病理状态调控都是必不可少的,如肿瘤转移、淋巴水肿、炎症的调控等[97]。淋巴管成像可用于许多生物学研究中,包括伤口愈合过程中的淋巴管生成、定量淋巴管和肿瘤进展,分子治疗策略对淋巴管功能紊乱的疗效评价及其他许多应用。
鉴于淋巴系统的重要作用,开发淋巴管的高分辨率无创成像技术成为一种发展趋势。传统的淋巴管成像是基于使用荧光材料的常规成像方式[98]。荧光淋巴管造影术[99]目前常用于图像引导手术中,其需要体内注射荧光标记物,由于其生化特性,大大限制了观察时间。最近,已有学者开发了脑膜淋巴管的OCT成像技术[100],但OCT和光声成像[101]的共同缺陷是对研究对象的非预期运动具有很高的灵敏度,无法对于直径低于50微米的淋巴管或流速低于100μm/s的淋巴流量进行监测。激光散斑淋巴管成像技术有望成为一种颇具潜力的体内淋巴管无创生理研究方法。Kalchenko等[102]开发了一种对于活体小鼠头部耳血管和淋巴管进行无创无标记的LSCI技术方法。通过延长成像系统探测器的曝光时间(超过200ms),以提高成像灵敏度,能够对直径为50-150μm的淋巴血管系统内的慢速流动液体(毛细血管血流或淋巴流)大视野成像。结果表明,长曝光时间的LSCI技术可以对缓慢流动的小径血管及淋巴管的脉动流成像,当造影剂的使用受到限制时,长曝光时间的LSCI也可以作为纵向研究淋巴系统的一个方向。
5.2 、脑功能区成像
清醒神经外科的目标是最大限度地切除大脑病变,同时最大限度地减少对大脑功能区的损伤。利用LSCI与血氧仪等仪器结合能够实时记录大脑体感皮层在功能激活期间的脑血流、血管内和血管外氧张力等参数[103]。Klijn等[104]研究了LSCI脑功能区定位的可行性,在大脑神经外科手术过程中,打开患者硬脑膜后唤醒患者,指示其按照休息-运动-休息的方案执行握拳运动任务,同时使用LSCI对暴露的脑区进行成像。随后,使用标准的皮层电刺激法(electrocortical stimulation, ECS)将暴露的大脑区域绘制成功能性运动区的分布图。分析方案执行过程中的LSCI信号变化,并与ECS结果进行比较。结果显示,在ECS标测的手部功能运动区,握手时LSCI测得的皮质血流量从(2052±818)AU显着增加到(2471±675)AU,而对照区(ECS标测的无功能活动区)毛细血管血流量无明显变化。Lemée等[105]对一例颞叶后胶质瘤患者进行了术中LSCI语言功能区激活定位研究,得到了与上述研究相似的结果。研究结果表明,在神经外科手术中,使用LSCI测量皮质微循环血流变化来进行脑功能区定位的方法具有一定的可行性。
在静息状态下人脑存在一个默认网络,在无外界条件刺激时,默认网络中脑区间呈现很强的同步低频波动,而在某种认知任务状态下这些脑区的活动明显减弱[106]。因此,大脑功能可以通过静息状态功能连接图(resting-state functional connectivity,rs-fc)进行评估,最常用的方法是利用功能磁共振(fMRI)分析大脑血红蛋白浓度的动态变化以进行rs-fc成像。Bergonzi等[107]采用LSCI将CBF的动脉自旋标记测量与血氧水平依赖的测量相结合,以在人类的rs-fc分析中提供多个参数对比度,提供了更为全面的测定方法。使用空间和时间区块平均法充分提高了信噪比,以测量静息状态下CBF的微小自发变化。这类组合性的rs-fc图在疾病期间所呈现的脑功能连接网络变化可能有助于阐明疾病的发生机制。
6 、总结与展望
在过去的几十年中,LSCI逐渐发展为一种重要的生物医学成像监测技术,其基于较高的空间和时间分辨率、较快的成像速度、非入侵性等优势,已广泛应用于生物体血流变化成像等生物医学领域的研究。本文综述了LSCI的原理装置、技术进展、以及其在脑卒中、吸毒成瘾等脑疾病研究及其他脑科学研究中的应用。当然,LSCI技术仍然存在一定的局限性,如成像深度限制,通过与梯度折射率透镜或扩散光学相关谱技术的结合,LSCI的探测深度可以增加到数毫米到厘米量级[108]。但要对更深层次的脑区成像,还有待研究者们在成像深度拓展方面进一步探索。LSCI通常测量相对流速,即与测量初始状态相比的流速变化值,或给出无单位的流速指数,难以测量以每秒每组织体积内的流量(例如ml/ml/s)为单位的绝对流量。虽然校正光学系统、静态散射、噪声、曝光时间等诸多影响LSCI定量检测因素的研究已取得突出进展,但LSCI进行血流速度或血流量绝对值的测量及还需学者们付出更多努力。此外,LSCI与其他成像技术,如光学相干层析成像, 多波长内源光学信号成像,荧光成像等结合形成多模态成像系统,实现优势互补,以同时监测一系列生理参数。未来的发展还包括设计小型化组件,以开发便携式激光散斑皮质血流动力学监测设备,或将该技术集成到手术显微镜中,可以进一步优化术中工作流程和操作等。激光散斑成像技术是实现血流实时可视化的有力手段,促进了人们对于神经血管耦合功能更为深入的了解,随着技术的不断发展,相信其在脑科学研究领域的应用将会更为广泛。
参考文献
[1] Hsu J, Lin J-J, Tsay W-I. Analysis of drug abuse data reported by medical institutions in Taiwan from 2002 to 2011. Journal of Food and Drug Analysis, 2014, 22(2): 169-177
[2] Moshkforoush A, Longden T, Dabertrand F, et al. Kir mediates regenerative and directional conduction of hyperpolarization in brain capillaries: importance for neurovascular coupling. The FASEB Journal, 2018, 32(1): 712-721
[3] Wang Z, Liu Q. Progress on optical imaging of functional brain with high temporal and spatial resolution. Progress in Biochemistry and Biophysics, 2006, (05): 1-4
[4] Zhao R, Hu W, Tsai J, et al. Microglia limit the expansion of β-amyloid plaques in a mouse model of Alzheimer’s disease. Molecular Neurodegeneration, 2017, 12: 47
[5] Kubasch M L, Kubasch A S, Torres Pacheco J, et al. Laser doppler assessment of vasomotor axon reflex responsiveness to evaluate neurovascular function. Front Neurol, 2017, 8: 370
[6] Stetson K A. A review of speckle photography and interferometry. Optical Engineering, 1975, 14(5): 145482
[7] Stern M. In vivo evaluation of microcirculation by coherent light scattering. Nature, 1975, 254(5495): 56
[8] Asakura T, Takai N. Dynamic laser speckles and their application to velocity measurements of the diffuse object. Applied physics, 1981, 25(3): 179-194
[9] Yoshimura T, Kato K, Nakagawa K. Surface-roughness dependence of the intensity correlation function under speckle-pattern illumination. J Opt Soc Amer A, 1990, 7(12): 2254-2259
[10] Fercher A, Briers J D. Flow visualization by means of single-exposure speckle photography. Optics communications, 1981, 37(5): 326-330
[11] Kiyota N, Shiga Y, Takahashi H, et al. Large vessel area of the optic nerve head, measured with laser speckle flowgraphy, is significantly reduced in eyes with preperimetric glaucoma. Clinical & experimental ophthalmology, 2015, 43(9): 841-843
[12] Chen D, Ren J, Wang Y, et al. Relationship between the blood perfusion values determined by laser speckle imaging and laser Doppler imaging in normal skin and port wine stains. Photodiagnosis and Photodynamic Therapy, 2016, 13: 1-9
[13] Takatsugu A, Niizuma K, Kanoke A, et al. Metabolomic analysis of mouse brain after a transient middle cerebral artery occlusion by mass spectrometry imaging Neurologia medico-chirurgica, 2018, 58(9): 384–392
[14] Aminfar A, Davoodzadeh N, Aguilar G, et al. Application of optical flow algorithms to laser speckle imaging. Microvascular Research, 2019, 122: 52-59
[15] Heeman W, Steenbergen W, Van Dam G M, et al. Clinical applications of laser speckle contrast imaging: a review. Journal of biomedical optics, 2019, 24(8): 080901
[16] Cheng W, Liu X, Lu J, et al. Imaging processing of laser speckle contrast imaging of blood flow. Optics letters, 2020, 1(1): 1
[17] Qiu J, Li P, Luo W, et al. Spatiotemporal laser speckle contrast analysis for blood flow imaging with maximized speckle contrast. J Journal of Biomedical Optics, 2010, 15(5): 1-5
[18] Hong J, Wang Y, Chen X, et al. Fluctuations of temporal contrast in laser speckle imaging of blood flow. Opt Lett, 2018, 43(21): 5214-5217
[19] Skipetrov S E, Peuser J, Cerbino R, et al. Noise in laser speckle correlation and imaging techniques. Opt Express, 2010, 18(14): 14519-14534
[20] Hong J, Shi L, Zhu X, et al. Laser speckle auto-inverse covariance imaging for mean-invariant estimation of blood flow. Opt Lett, 2019, 44(23): 5812-5815
[21] Li Y, Liu R, Wang Y, et al. Detecting relative speed changes of moving objects through scattering medium by using wavefront shaping and laser speckle contrast analysis. Opt Express, 2016, 24(8): 8382-8390
[22] Chen M, Wen D, Huang S, et al. Laser speckle contrast imaging of blood flow in the deep brain using microendoscopy. Optics letters, 2018, 43(22): 5627-5630
[23] Bi R, Dong J, Lee K. Deep tissue flowmetry based on diffuse speckle contrast analysis. Optics letters, 2013, 38(9): 1401-1403
[24] He H, Tang Y, Zhou F, et al. Lateral laser speckle contrast analysis combined with line beam scanning illumination to improve the sampling depth of blood flow imaging. Opt Lett, 2012, 37(18): 3774-3776
[25] Zhang C, Feng W, Zhao Y, et al. A large, switchable optical clearing skull window for cerebrovascular imaging. Theranostics, 2018, 8(10): 2696-2708
[26] Humeau-Heurtier A, Mahé G, Abraham P J M R. Microvascular blood flow monitoring with laser speckle contrast imaging using the generalized differences algorithm. Microvascular Research, 2015, 98(1): 54-61
[27] Wang Y, Wen D, Chen X, et al. Improving the estimation of flow speed for laser speckle imaging with single exposure time. Optics letters, 2017, 42(1): 57-60
[28] Li H, Liu Q, Lu H, et al. Directly measuring absolute flow speed by frequency-domain laser speckle imaging. Opt Express, 2014, 22(17): 21079-21087
[29] Miao P, Chao Z, Feng S, et al. Local scattering property scales flow speed estimation in laser speckle contrast imaging. Laser Physics Letters, 2015, 12(7): 075601
[30] Buijs J, Van Der Gucht J, Sprakel J. Fourier transforms for fast and quantitative Laser Speckle Imaging. Scientific Reports, 2019, 9(1): 1-9
[31] Zakharov P, V?lker A C, Wyss M T, et al. Dynamic laser speckle imaging of cerebral blood flow. Opt Express, 2009, 17(16): 13904-13917
[32] Parthasarathy A B, Tom W J, Gopal A, et al. Robust flow measurement with multi-exposure speckle imaging. Opt Express, 2008, 16(3): 1975-1989
[33] Kazmi S S, Balial S, Dunn A K. Optimization of camera exposure durations for multi-exposure speckle imaging of the microcirculation. Biomedical optics express, 2014, 5(7): 2157-2171
[34] Dragojevi? T, Bronzi D, Varma H M, et al. High-speed multi-exposure laser speckle contrast imaging with a single-photon counting camera. Biomedical optics express, 2015, 6(8): 2865-2876
[35] Pain F, Soleimanzad H, Smekens F, et al. Wide field speckle imaging for the investigation of cerebral blood flow in vivo in murine model of obesity; proceedings of the Neural Imaging and Sensing 2019, F, 2019 [C] International Society for Optics and Photonics
[36] Wang Y, Lv W, Chen X, et al. Improving the sensitivity of velocity measurements in laser speckle contrast imaging using a noise correction method. Opt Lett, 2017, 42(22): 4655-4658
[37] Gu X, Chen W, You J, et al. Long-term optical imaging of neurovascular coupling in mouse cortex using GCaMP6f and intrinsic hemodynamic signals. NeuroImage, 2018, 165: 251-264
[38] Abdurashitov A, Bragina O, Sindeeva O, et al. Off-axis holographic laser speckle contrast imaging of blood vessels in tissues. Journal of biomedical optics, 2017, 22(9): 091514
[39] Liu S, Li P, Luo Q. Fast blood flow visualization of high-resolution laser speckle imaging data using graphics processing unit. Opt Express, 2008, 16(19): 14321-14329
[40] Tang X, Feng N, Sun X, et al. Portable laser speckle perfusion imaging system based on digital signal processor. The Review of scientific instruments, 2010, 81(12): 125110
[41] Jiang C, Zhang H, Wang J, et al. Dedicated hardware processor and corresponding system-on-chip design for real-time laser speckle imaging. J Biomed Opt, 2011, 16(11): 116008
[42] Lertsakdadet B, Dunn C, Bahani A, et al. Handheld motion stabilized laser speckle imaging. J Biomedical optics express, 2019, 10(10): 5149-5158
[43] Katan M, Luft A. Global burden of stroke; proceedings of the Seminars in neurology, F, 2018 [C] Thieme Medical Publishers
[44] Tiwari S K, Mishra P, Rajavashisth T. Inflammation, oxidative stress, and cerebral stroke: basic principles [M]. Advancement in the Pathophysiology of Cerebral Stroke. Springer. 2019: 11-21
[45] Shu X, Liu Q, Chen S, et al. Monitoring acute stroke in mouse model using visible-light optical coherence tomography; proceedings of the Optical Tomography and Spectroscopy, F, 2018 [C] Optical Society of America
[46] Winship I R. Cerebral collaterals and collateral therapeutics for acute ischemic stroke. Microcirculation, 2015, 22(3): 228-236
[47] Iwasawa E, Ichijo M, Ishibashi S, et al. Acute development of collateral circulation and therapeutic prospects in ischemic stroke. Neural regeneration research, 2016, 11(3): 368
[48] Biose I J, Dewar D, Macrae I M, et al. Impact of stroke co-morbidities on cortical collateral flow following ischaemic stroke. Journal of Cerebral Blood Flow & Metabolism, 2019, 1: 1-13
[49] Pan H-C, Liao L-D, Lo Y-C, et al. Neurovascular function recovery after focal ischemic stroke by enhancing cerebral collateral circulation via peripheral stimulation-mediated interarterial anastomosis. Neurophotonics, 2017, 4(3): 035003
[50] Lin A-L, Jahrling J B, Zhang W, et al. Rapamycin rescues vascular, metabolic and learning deficits in apolipoprotein E4 transgenic mice with pre-symptomatic Alzheimer’s disease. Journal of Cerebral Blood Flow & Metabolism, 2017, 37(1): 217-226
[51] Wang J, Lin X, Mu Z, et al. Rapamycin increases collateral circulation in rodent brain after focal ischemia as detected by multiple modality dynamic imaging Theranostics, 2019, 9(17): 4923-4934
[52] Leardini-Trist?o M, Borges J P, Freitas F, et al. The impact of early aerobic exercise on brain microvascular alterations induced by cerebral hypoperfusion. Brain research, 2017, 1657: 43-51
[53] Ma J, Ma Y, Shuaib A, et al. Impaired collateral flow in pial arterioles of aged rats during ischemic stroke Translational Stroke Research, 2019, 1: 1-11
[54] Bo B, Li Y, Li W, et al. Neurovascular coupling impairment in acute ischemic stroke by optogenetics and optical brain imaging proceedings of the 2020 42nd Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC), F 20-24 July 2020, 2020 [C]
[55] Oka F, Hoffmann U, Lee J H, et al. Requisite ischemia for spreading depolarization occurrence after subarachnoid hemorrhage in rodents. Journal of Cerebral Blood Flow & Metabolism, 2017, 37(5): 1829-1840
[56] Wang Z. Recent advances of optical imaging in animal stroke model. Frontiers of Optoelectronics, 2013, 6(2): 134-145
[57] Liu Q, Chen S, Soetikno B, et al. Monitoring acute stroke in mouse model using laser speckle imaging-guided visible-light optical coherence tomography IEEE Transactions on Biomedical Engineering, 2018, 65(10): 2136-2142
[58] Sullender C, Mark A, Clark T, et al. Imaging of cortical oxygen tension and blood flow following targeted photothrombotic stroke. Neurophotonics, 2018, 5(3): 035003
[59] Rakers C, Schmid M, Petzold G C. TRPV4 channels contribute to calcium transients in astrocytes and neurons during peri-infarct depolarizations in a stroke model. Glia, 2017, 65(9): 1550-1561
[60] Rakers C, Petzold G C. Astrocytic calcium release mediates peri-infarct depolarizations in a rodent stroke model. The Journal of clinical investigation, 2017, 127(2): 511-516
[61] Levy H, Ringuette D, Levi O. Rapid monitoring of cerebral ischemia dynamics using laser-based optical imaging of blood oxygenation and flow. Biomedical optics express, 2012, 3(4): 777-791
[62] Kanda H, Kunisawa T, Iida T, et al. Cerebral circulation during retrograde cerebral perfusion: evaluation using laser speckle flowgraphy. The Annals of thoracic surgery, 2019, 107(6): 1747-1752
[63] Mangraviti A, Volpin F, Cha J, et al. Intraoperative laser speckle contrast imaging for real-time visualization of cerebral blood flow in cerebrovascular surgery: results from pre-clinical studies. Scientific reports, 2020, 10(1): 1-13
[64] Venugopal K, Unni S N, Bach A, et al. Assessment of cerebral hemodynamics during neurosurgical procedures using laser speckle image analysis. Journal of Biophotonics, 2019, 12(9): e201800408
[65] Hecht N, Müller M-M, Sandow N, et al. Infarct prediction by intraoperative laser speckle imaging in patients with malignant hemispheric stroke. Journal of Cerebral Blood Flow & Metabolism, 2016, 36(6): 1022-1032
[66] Makoto I, Koji K, Koichi Y, et al. Avoidance of ischemic complications after resection of a brain lesion based on intraoperative real-time recognition of the vasculature using laser speckle flow imaging. Journal of Neurosurgery JNS, 2017, 126(1): 274-280
[67] Bienvenu O J, Needham D M, Hopkins R O. Diagnostic and statistical manual of mental disorders, fifth edition, and the impact of events scale-revised response. Chest, 2013, 144(6): 1974-1975
[68] Sutton L P, Muntean B S, Ostrovskaya O, et al. NF1-cAMP signaling dissociates cell type–specific contributions of striatal medium spiny neurons to reward valuation and motor control. PLOS Biology, 2019, 17(10): e3000477
[69] Tong Y, Yao J, Chen J J, et al. The resting-state fMRI arterial signal predicts differential blood transit time through the brain. Journal of Cerebral Blood Flow & Metabolism, 2019, 39(6): 1148-1160
[70] Herold F, Wiegel P, Scholkmann F, et al. Applications of functional near-infrared spectroscopy (fnirs) neuroimaging in exercise–cognition science: a systematic, methodology-focused review Journal of clinical medicine, 2018, 7(12): 466
[71] Ottoy J, Verhaeghe J, Niemantsverdriet E, et al. 18F-FDG PET, the early phases and the delivery rate of 18F-AV45 PET as proxies of cerebral blood flow in Alzheimer's disease: Validation against 15O-H2O PET. Alzheimer's & Dementia, 2019, 15(9): 1172-1182
[72] Allen C P, Park K, Li A, et al. Enhanced neuronal and blunted hemodynamic reactivity to cocaine in the prefrontal cortex following extended cocaine access: optical imaging study in anesthetized rats. Addiction Biology, 2019, 24(3): 485-497
[73] Park K, Chen W, Volkow N D, et al. Hemodynamic and neuronal responses to cocaine differ in awake versus anesthetized animals: Optical brain imaging study. NeuroImage, 2019, 188: 188-197
[74] Yargic I. Biological mechanisms underlying addiction. International Journal of Human and Health Sciences (IJHHS), 2018, 2(3): 107-111
[75] Du C, Volkow N D, You J, et al. Cocaine-induced ischemia in prefrontal cortex is associated with escalation of cocaine intake in rodents. Mol Psychiatry, 2018, 25(8): 1759-1776
[76] Fulop G A, Ahire C, Csipo T, et al. Cerebral venous congestion promotes blood-brain barrier disruption and neuroinflammation, impairing cognitive function in mice. GeroScience, 2019, 41(5): 575-589
[77] Yamazaki Y, Kanekiyo T. Blood-brain barrier dysfunction and the pathogenesis of alzheimer’s disease International Journal of Molecular Sciences, 2017, 18(9): 1965
[78] Tarantini S, Fulop G A, Kiss T, et al. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimer’s disease using functional laser speckle contrast imaging. GeroScience, 2017, 39(4): 465-473
[79] Zou W, Song Y, Li Y, et al. The role of autophagy in the correlation between neuron damage and cognitive impairment in rat chronic cerebral hypoperfusion Molecular Neurobiology, 2018, 55(1): 776-791
[80] Springo Z, Tarantini S, Toth P, et al. Aging exacerbates pressure-induced mitochondrial oxidative stress in mouse cerebral arteries The Journals of Gerontology: Series A, 2015, 70(11): 1355-1359
[81] Tarantini S, Valcarcel-Ares N M, Yabluchanskiy A, et al. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice. Aging Cell, 2018, 17(2): e12731
[82] Németh J, V T-S, V V, et al. Molecular hydrogen affords neuroprotection in a new translational piglet model of hypoxic-ischemic encephalopathy. J Physiol Pharmacol, 2017, 67(6): 677-689
[83] Wood T, Smit E, Maes E, et al. Monitoring of cerebral blood flow during hypoxia-ischemia and resuscitation in the neonatal rat using laser speckle imaging. Physiological Reports, 2016, 4(7): e12749
[84] Semyachkina-Glushkovskaya O, Pavlov A, Kurths J, et al. Optical monitoring of stress-related changes in the brain tissues and vessels associated with hemorrhagic stroke in newborn rats. Biomedical optics express, 2015, 6(10): 4088-4097
[85] Semyachkina-Glushkovskaya O V, Lychagov V V, Abdurashitov A S, et al. Changes in the cerebral blood flow in newborn rats assessed by LSCI and DOCT before and after the hemorrhagic stroke, F, 2015 [C] International Society for Optics and Photonics
[86] Pavlov A N, Semyachkina-Glushkovskaya O V, Zhang Y, et al. Multiresolution analysis of pathological changes in cerebral venous dynamics in newborn mice with intracranial hemorrhage: adrenorelated vasorelaxation. Physiological Measurement, 2014, 35(10): 1983-1999
[87] Staehr C, Hangaard L, Bouzinova E V, et al. Smooth muscle Ca2+ sensitization causes hypercontractility of middle cerebral arteries in mice bearing the familial hemiplegic migraine type 2 associated mutation. Journal of Cerebral Blood Flow & Metabolism, 2018, 39(8): 1570-1587
[88] Eikermann-Haerter K, Arbel-Ornath M, Yalcin N, et al. Abnormal synaptic Ca2+ homeostasis and morphology in cortical neurons of familial hemiplegic migraine type 1 mutant mice. Annals of Neurology, 2015, 78(2): 193-210
[89] Staehr C, Rajanathan R, Postnov D D, et al. Abnormal neurovascular coupling as a cause of excess cerebral vasodilation in familial migraine. Cardiovascular Research, 2019
[90] Nordstr?m P, Micha?lsson K, Gustafson Y, et al. Traumatic brain injury and young onset dementia: a nationwide cohort study. Annals of neurology, 2014, 75(3): 374-381
[91] Vaibhav K, Braun M, Alverson K, et al. Neutrophil extracellular traps exacerbate neurological deficits after traumatic brain injury. Science advances, 2020, 6(22): eaax8847
[92] Wang G, Zhang Y P, Gao Z, et al. Pathophysiological and behavioral deficits in developing mice following rotational acceleration-deceleration traumatic brain injury. Disease models mechanisms, 2018, 11(1): dmm030387
[93] Frith U. The neurocognitive basis of autism. Trends in Cognitive Sciences, 1997, 1(2): 73-77
[94] Peterson B S, Zargarian A, Peterson J B, et al. Hyperperfusion of frontal white and subcortical gray matter in autism spectrum disorder Biological psychiatry, 2019, 85(7): 584-595
[95] Abookasis D, Lerman D, Roth H, et al. Optically derived metabolic and hemodynamic parameters predict hippocampal neurogenesis in the BTBR mouse model of autism. Journal of Biophotonics, 2018, 11(3): e201600322
[96] Margaris K, Nepiyushchikh Z, Zawieja D, et al. Microparticle image velocimetry approach to flow measurements in isolated contracting lymphatic vessels. Journal of Biomedical Optics, 2016, 21(2): 025002
[97] Iliff J, Thrane A, Nedergaard M. The glymphatic system and brain interstitial fluid homeostasis. Primer on cerebrovascular diseases, 2017, 1: 17-25
[98] Watanabe J, Ota M, Suwa Y, et al. Evaluation of lymph flow patterns in splenic flexural colon cancers using laparoscopic real-time indocyanine green fluorescence imaging. International journal of colorectal disease, 2017, 32(2): 201-207
[99] Demidov V, Matveev L A, Demidova O, et al. Analysis of low-scattering regions in optical coherence tomography: applications to neurography and lymphangiography. Biomedical optics express, 2019, 10(8): 4207-4219
[100] Semyachkina-Glushkovskaya O, Abdurashitov A, Dubrovsky A, et al. Application of optical coherence tomography for in vivo monitoring of the meningeal lymphatic vessels during opening of blood–brain barrier: mechanisms of brain clearing. Journal of Biomedical Optics, 2017, 22(12): 121719
[101] Forbrich A, Heinmiller A, Zemp R J. Photoacoustic imaging of lymphatic pumping. Journal of biomedical optics, 2017, 22(10): 106003
[102] Kalchenko V, Kuznetsov Y, Harmelin A, et al. Label free in vivo laser speckle imaging of blood and lymph vessels. Journal of Biomedical Optics, 2012, 17(5): 050502
[103] Chong S, Ong Y H, Khatib M E, et al. Real-time measurements of cerebral blood flow, intra- and extravascular oxygen tension during functional activation; proceedings of the Biophotonics Congress: Biomedical Optics 2020 (Translational, Microscopy, OCT, OTS, BRAIN), Washington, DC, F 2020/04/20, 2020 [C] Optical Society of America
[104] Eva K, Hester C H, Rutger K B, et al. Laser speckle imaging identification of increases in cortical microcirculatory blood flow induced by motor activity during awake craniotomy. Journal of Neurosurgery JNS, 2013, 118(2): 280-286
[105] Lemée J, Abraham P, Ter-Minassian A, et al. Application of laser speckle to the identification of functional brain areas in awake surgery. Neuro-oncology, 2014, 16(Suppl 2): ii10
[106] Raichle M E, Macleod A M, Snyder A Z, et al. A default mode of brain function. Proceedings of the National Academy of Sciences, 2001, 98(2): 676-682
[107] Bergonzi K M, Bauer A Q, Wright P W, et al. Mapping functional connectivity using cerebral blood flow in the mouse brain Journal of Cerebral Blood Flow & Metabolism, 2015, 35(3): 367-370
[108] Yu H, Senarathna J, Tyler B M, et al. Miniaturized optical neuroimaging systems Handbook of Neurophotonics,, 2020: 1





