摘 要: 多光子成像技术是一种层析能力好、信噪比高的新型光学成像技术。在皮肤光学三维检测中, 多光子技术已经应用于无创在体成像, 且已得到产业化开发。本文将首先介绍多光子皮肤检测系统的若干核心技术, 即双光子自发荧光技术、二次谐波成像技术、荧光寿命成像技术、相干反斯托克斯-拉曼成像技术等, 然后简要介绍多光子成像系统在皮肤疾病成像检测上的应用, 最后分析该系统的优势和未来可能的发展趋势。
关键词: 皮肤组织成像; 多光子荧光成像; 荧光寿命成像; 相干反斯托克斯-拉曼; 皮肤衰老检测;
Abstract: Multi-photon imaging is a new technique for optical imaging with inherent optical sectioning abilities and a high signal-to-noise ratio. Multi-photon microscopy has applications in dermatological imaging for its non-invasive and in situ imaging capability. As such, it has been applied commercially. In this paper, we first introduce the core technologies of multiphoton microscopy including two-photon auto-fluorescence imaging, second-harmonic generation ( SHG) , fluorescence life time imaging ( FLIM) and coherent anti-Stokes Raman scattering ( CARS) . We then introduce its application on skin imaging analysis. Finally, we analyze the advantages and the possible future development of this technology.
Keyword: skin tissue imaging; multi-photon fluorescence imaging; fluorescence life time imaging; coherent anti-stokes raman scattering; skin aging detection;
1 引言
组织成像能为组织病理诊断提供直观的依据, 在医学病理检查中有着重要的地位。传统的医学病理检测通常需要切取一定大小的病变组织, 其制作病理切片, 最后用显微镜进一步检测病变组织, 检测过程耗时较长, 并且会为患者带来额外的痛苦。近几十年来, 有大量的研究者致力于开发新型组织成像技术, 活体光学成像由于具有无创性、成像实时性、可对统一组织区域进行长时间监测等优势[1], 成为研究的热点。现在常见的组织光学成像技术有荧光成像、光声成像[2]、光学相干层析成像 (OCT) [3]等。
1990年, Winfried Denk[4]等人创造性地提出了双光子荧光显微的概念, 继而发展出多光子荧光成像技术, 为活体组织光学成像提供了新的思路。相较于传统的单光子共聚焦荧光成像技术, 多光子荧光成像具有以下优势: (1) 激发光波长更长, 在组织中的散射系数较小, 具有很好的组织穿透性, 能够探测到更深的组织结构; (2) 多光子成像的聚焦性好, 焦平面外的荧光分子几乎不被激发; (3) 多光子技术的激发光光子能量更低, 细胞毒性小, 对组织的损伤更少, 具有很好的安全性[1]。因此, 多光子技术在活体组织成像, 尤其是皮肤组织的成像中得到了广泛的使用。近年来, 该技术也取得了产业化的成果:JenLab[5]已经推出基于多光子层析成像的皮肤检测系统, 在早期皮肤癌症诊断、皮肤衰老检测等方面均有着应用。本文将介绍多光子皮肤检测系统的主要技术原理, 以及其在皮肤组织病理性检测中的一些应用, 并简要探讨这项技术的优势与未来的发展趋势。
2 多光子皮肤检测系统的构成
多光子皮肤检测系统基于双光子自发荧光、二次谐波成像、荧光寿命成像等技术, 可以实现皮肤组织结构与功能上的成像[6]。同时, 相干反斯托克斯-拉曼散射光谱成像技术也被应用到该检测系统中, 以实现皮肤组织中非荧光物质 (如脂质) 的成像[7]。

2.1 双光子自发荧光
双光子自发荧光指基态荧光分子或原子吸收两个光子激发至激发态, 然后恢复到基态并发出荧光的过程。荧光分子在吸收第一个光子后, 将跃迁至一个虚态, 需要第二个光子在几飞秒内与处于虚态的荧光分子作用, 荧光分子才能从虚态跃迁到激发态[4]。
自发荧光物质是指生物细胞与组织内固有的荧光物质。当被合适波长的光激发时, 一些细胞和组织的内容物能够发出稳定的荧光信号, 它们也因此被称为内源荧光团[8]。一些内源荧光团分子 (图1) 广泛分布于细胞和组织之中, 例如NAD (P) H、卟啉类化合物、黄素、黑色素等。皮肤组织中NAD (P) H的含量与皮肤组织细胞内氧化还原与新陈代谢水平相关, 可作为皮肤衰老检测的分子标志物[9];皮肤黑色素瘤会使黑色素细胞的形态与边界发生变化。因此, 可以用多光子无标记成像实现对于皮肤疾病的早期探测以及对皮肤衰老的检测。
图1 主要内源荧光分子的 (a) 激发光谱; (b) 发射光谱[10]Fig.1 (a) Excitation spectra; (b) emission spectra of primary endogenous fluorophores[10]
![图1 主要内源荧光分子的 (a) 激发光谱; (b) 发射光谱[10]Fig.1 (a) Excitation spectra; (b) emission spectra of primary endogenous fluorophores[10]](/uploads/allimg/190301/36-1Z3010UI94L.jpg)
在多光子皮肤检测中, 用于成像的主要内源荧光团有角质层中的角质蛋白、颗粒层中的NAD (P) H、基底层中的黑色素、真皮层中的胶原蛋白与弹性蛋白等。由于多光子技术具有很好的共聚焦效应, 使用该技术可以获得不同深度的皮肤组织自发荧光成像 (图2) 。上述荧光团的单光子激发光波长大多位于紫外光波段 (340~400 nm) , 会对皮肤组织造成很大的损伤;而使用双光子激发则只需近红外光 (700~850 nm) , 光子能量较低, 大大减小了对活体组织的伤害[11], 也降低了光漂白对荧光成像的影响。同时, 自发荧光成像技术使得皮肤组织在成像时不需要外源荧光团的标记, 在临床应用上更加方便、安全。
图2 健康人体皮肤活体成像, 激发光波长760 nm: (a) 角质层, 0μm深:角蛋白自发荧光信号; (b) 颗粒层, 20μm深:角质细胞中的透明角质颗粒、NADPH、角蛋白自发荧光信号; (c) 棘层, 30μm深:角质细胞密度增大;激发光波长800 nm; (d) 真皮层, 85μm深:胶原蛋白、弹性蛋白自发荧光信号[11]Fig.2 In vivo healthy human skin imaging with excitation wavelength of 760 nm: (a) Stratum corneum, 0μm depth:auto-fluorescence signal of keratin; (b) Stratum granulosum, 20μm depth:auto-fluorescence signal of keratohyalin gran-ules, NADPH, and keratin in keratinocytes; (c) Stratum spinosum, 30μm depth:increased cellular density of ke-ratinocytes;800 nm excitation wavelength: (d) Dermis, 85μm depth:auto-fluorescence signal of collagen and elas-tin[11]
![图2 健康人体皮肤活体成像, 激发光波长760 nm: (a) 角质层, 0μm深:角蛋白自发荧光信号; (b) 颗粒层, 20μm深:角质细胞中的透明角质颗粒、NADPH、角蛋白自发荧光信号; (c) 棘层, 30μm深:角质细胞密度增大;激发光波长800 nm; (d) 真皮层, 85μm深:胶原蛋白、弹性蛋白自发荧光信号[11]Fig.2 In vivo healthy human skin imaging with excitation wavelength of 760 nm: (a) Stratum corneum, 0μm depth:auto-fluorescence signal of keratin; (b) Stratum granulosum, 20μm depth:auto-fluorescence signal of keratohyalin gran-ules, NADPH, and keratin in keratinocytes; (c) Stratum spinosum, 30μm depth:increased cellular density of ke-ratinocytes;800 nm excitation wavelength: (d) Dermis, 85μm depth:auto-fluorescence signal of collagen and elas-tin[11]](/uploads/allimg/190301/36-1Z3010UH0146.jpg)
图3 (a) 双光子激发荧光 (2PEF) 和 (b) 二次谐波成像 (SHG) 的Jablonski图[12]Fig.3 Jablonski image of (a) two-photon excitation fluorescence (2PEF) and (b) second harmonic generation (SHG) [12]
![图3 (a) 双光子激发荧光 (2PEF) 和 (b) 二次谐波成像 (SHG) 的Jablonski图[12]Fig.3 Jablonski image of (a) two-photon excitation fluorescence (2PEF) and (b) second harmonic generation (SHG) [12]](/uploads/allimg/190301/36-1Z3010UA4955.jpg)
2.2 二次谐波成像
二次谐波成像是一种非线性的光学过程, 在此过程中, 两个相同频率光子与非对称介质发生相互作用, 将其从基态激发至虚态。在从虚态恢复到基态的过程中, 释放频率增倍、波长减半的光子 (图3) 。由于其可将物质自发激发至虚态的特性, 二次谐波成像不需要荧光标记, 因此不会受到光漂白或光毒性的影响。与双光子荧光激发不同的是, 二次谐波成像中, 被激发物体吸收的能量和放出的能量大小相同, 因此, 若对同一物质进行双光子荧光成像与二次谐波成像, 所得的成像信号会出现在不同的频率范围。
在生物体中, SHG成像多发生在细胞的非对称结构上, 如胶原蛋白、微管蛋白等。在皮肤活体成像中, SHG成像也有着重要的应用。通常使用波长为800 nm左右的激发光, 对如真皮层中的胶原蛋白和弹性蛋白网络进行成像[4]。如图4所示, 绿色荧光信号是真皮层中弹性蛋白的自发荧光信号, 蓝色荧光信号是胶原蛋白纤维的SHG信号。与自发荧光相同的是, 这些蛋白的微结构与皮肤疾病的发展密切相关, 有研究表明, 在皮肤表浅性基底细胞癌中, 胶原蛋白纤维的排布状态与正常皮肤不同[13]。因此SHG提供了另外一种监测疾病的成像模态。
图4 真皮层中胶原蛋白纤维的SHG信号 (蓝) 与弹性蛋白纤维的自发荧光信号 (绿) [14]Fig.4 SHG signal of collagen fibers (blue) and autoflu-orescence signal of elastic fibers (green) in the dermis (Scale bar:20μm) [14]
![图4 真皮层中胶原蛋白纤维的SHG信号 (蓝) 与弹性蛋白纤维的自发荧光信号 (绿) [14]Fig.4 SHG signal of collagen fibers (blue) and autoflu-orescence signal of elastic fibers (green) in the dermis (Scale bar:20μm) [14]](/uploads/allimg/190301/36-1Z3010U55T60.jpg)
2.3 荧光寿命成像
荧光寿命指分子受光脉冲激发后返回基态之前在激发态平均停留的时间, 即激发停止后, 分子的荧光强度降到激发时最大强度的1/e所需的时间。由于多光子成像需要采用脉冲飞秒激光器, 因此特别适合于提取荧光寿命信号。荧光寿命与荧光的初始强度无关, 而和荧光分子所处的微环境有关。荧光寿命通常使用时间相关单光子计数 (TCSPC) 技术来测量, 可以达到皮秒级的分辨率[1]。荧光寿命成像就是将不同荧光寿命进行可视化区别的技术。由于荧光寿命和荧光分子所处的微环境条件、与蛋白的结合、辅酶的代谢能力等一系列组织生理因素有关, 荧光寿命成像技术为组织生理情况的检测 (如是否可能患有癌症) 提供了可能[15]。例如, Yuri Dancik[16]等人结合多光子断层成像与荧光寿命等技术, 对亚洲与非洲人种的皮肤颗粒层与基底层进行成像 (图5) , 发现亚洲人种皮肤颗粒层的分子荧光寿命显着高于基底层以及非洲人种, 研究者此后也分析了色素含量与荧光寿命以及荧光强度的相关性, 并由此计算出了亚洲人种与非洲人种不同皮肤组织深度中黑色素含量的关系, 即非洲人皮肤中的黑色度含量约为亚洲人的4~5倍。
图5 不同深度皮肤组织自发荧光强度影像与荧光寿命影像对比.亚洲志愿者的: (a) 颗粒层、 (b) 基底层;非洲志愿者的: (c) 颗粒层、 (d) 基底层[16]Fig.5 Contrast of auto-fluorescence intensity maps and lifetime color maps:Asian volunteer's (a) stratum granulosum; (b) stratum basal;African volunteer's (c) stratum granulosum; (d) stratum basal[16]
![图5 不同深度皮肤组织自发荧光强度影像与荧光寿命影像对比.亚洲志愿者的: (a) 颗粒层、 (b) 基底层;非洲志愿者的: (c) 颗粒层、 (d) 基底层[16]Fig.5 Contrast of auto-fluorescence intensity maps and lifetime color maps:Asian volunteer's (a) stratum granulosum; (b) stratum basal;African volunteer's (c) stratum granulosum; (d) stratum basal[16]](/uploads/allimg/190301/36-1Z3010U5322N.jpg)
2.4 相干反斯托克斯-拉曼散射成像
前面提到的双光子自发荧光技术、二次谐波成像技术和荧光寿命成像技术在对某些非荧光物质, 如脂质等的成像中存在一定的限制。基于拉曼散射的成像技术能够提供这些非荧光物质的信息, 并且具有很好的分子识别度[7]。
相干反斯托克斯-拉曼成像是一个三阶非线性光学过程, 需要抽运激光束、斯托克斯激光束以及探测激光束等3种激光束与同一样品发生作用, 最后产生相干光学信号 (图6) 。由于共振激发作用, 相干反斯托克斯-拉曼 (CARS) 能够比线性拉曼过程提供更强的信号[7];同时, CARS信号波长相对激发光有明显蓝移, 因此, 这项技术具有高峰值、高灵敏度的特点。CARS已经应用于皮肤活体成像系统中, 主要提供皮肤组织中脂质分布的成像 (图7) 。鳞状细胞癌 (SCC) 能够使皮肤细胞形态发生变化, 在CARS成像中无法观察到清晰的细胞边界, 与正常的皮肤组织成像存在区别, 因此CARS成像可作为SCC的一种辅助诊断方式[17]。
图6 相干反斯托克斯-拉曼 (CARS) 的Jablonski图: (a) 拉曼散射; (b) 受激拉曼散射; (c) 相干反斯托克斯-拉曼Fig.6 Jablonski image of coherent anti-Stokes Raman scattering (CARS) : (a) Raman Scattering; (b) Stimulated Raman Scattering; (c) Coherent Anti-Stokes Raman Scattering
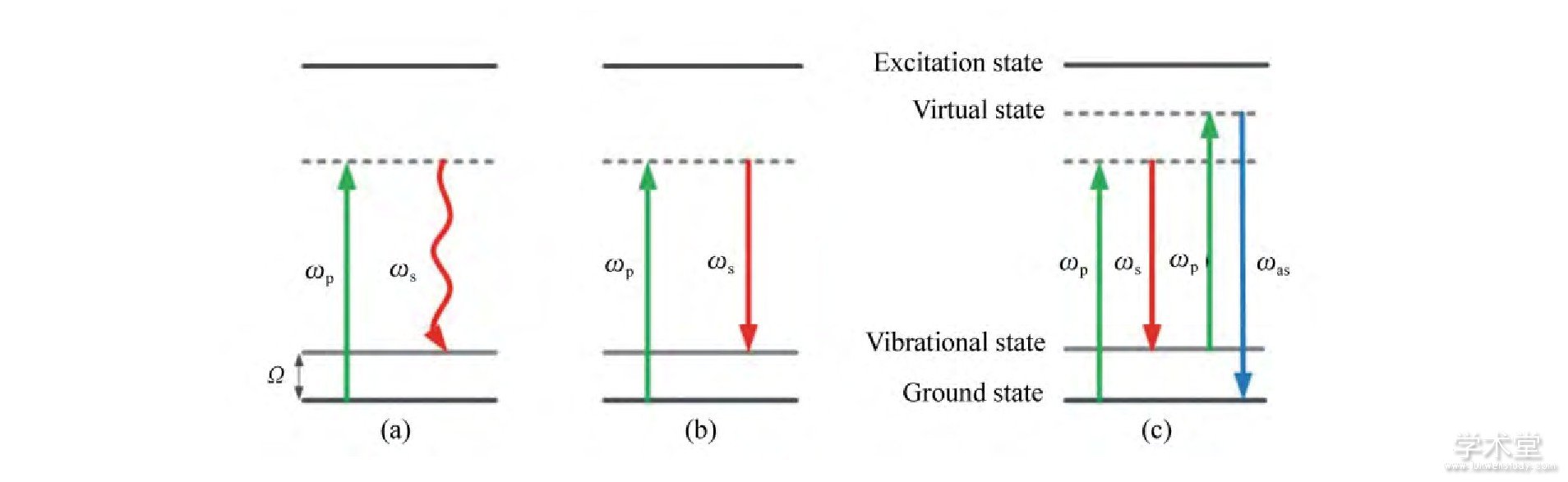
图7 健康人体皮肤活体成像: (a) CARS成像信号; (b) 双光子激发荧光/SHG成像信号; (c) CARS-双光子激发荧光/SHG成像信号叠加[7]Fig.7 In vivo skin imaging of healthy people: (a) CARS imaging signal; (b) two-photon excitation fluorescence/SHG ima-ging signal; (c) signal overlay of CARS-two-photon excitation fluorescence/SHG imaging[7]
![图7 健康人体皮肤活体成像: (a) CARS成像信号; (b) 双光子激发荧光/SHG成像信号; (c) CARS-双光子激发荧光/SHG成像信号叠加[7]Fig.7 In vivo skin imaging of healthy people: (a) CARS imaging signal; (b) two-photon excitation fluorescence/SHG ima-ging signal; (c) signal overlay of CARS-two-photon excitation fluorescence/SHG imaging[7]](/uploads/allimg/190301/36-1Z3010U4203M.jpg)
3 产业化及应用
德国JenLab公司已经实现了多光子皮肤检测技术的产业化 (图8) 。其产品使用近红外飞秒激光脉冲对皮肤组织进行照射, 可得到自发荧光、SHG、CARS的3种成像信号, 形成对皮肤组织结构成分的图像;同时, 利用荧光寿命成像技术能够得到皮肤组织的微环境信息, 以分析活体组织的生理、病理性状况[3]。由于双光子技术具有很好的共聚焦效应, 且长波长光具有较小的吸收和散射系数, 这一系统能够得到深度范围较大 (能够达到几百微米级别) 的光学层析成像, 因此能够检测分析皮肤组织各个层次的结构与生理情况。同时, 近红外光对生物组织和荧光团的损伤均极小[1], 因此这一系统具有很好的安全性与无创性, 并大大减轻了光漂白对荧光成像的影响。
图8 Jen Lab的多光子皮肤检测系统MPTflex[5]Fig.8Multi-photon skin screen system of Jen Lab—MPTflex[5]
![图8 Jen Lab的多光子皮肤检测系统MPTflex[5]Fig.8Multi-photon skin screen system of Jen Lab—MPTflex[5]](/uploads/allimg/190301/36-1Z3010U356450.jpg)
多光子皮肤检测系统在早期皮肤癌症影像诊断、皮肤衰老检测等方面均发挥着一定的作用[18], 下面以检测皮肤衰老为例, 简要介绍该检测系统的应用。
在人体皮肤衰老的过程中, 真皮层中的胶原蛋白纤维与弹性蛋白纤维的形态、网络结构会发生改变。同时, 胶原蛋白纤维与弹性蛋白纤维的分布也会发生改变[11]。图9展示了在多光子层析成像中, 纤维形态与伸展的不同状态, SHG信号由胶原蛋白纤维产生, 自发荧光信号由弹性蛋白纤维产生。
图9 不同纤维形态的多光子层析成像图对比 (左:SHG信号;右:自发荧光信号) [19]Fig.9 Contrast of different fiber morphology MPT images (left:SHG signal;right:auto-fluorescence signal) [19]
![图9 不同纤维形态的多光子层析成像图对比 (左:SHG信号;右:自发荧光信号) [19]Fig.9 Contrast of different fiber morphology MPT images (left:SHG signal;right:auto-fluorescence signal) [19]](/uploads/allimg/190301/36-1Z3010U333126.jpg)
在SHG成像中, 衰老皮肤真皮层的胶原蛋白纤维呈丝状 (图9 (a1) ) , 而年轻皮肤的胶原蛋白纤维却是不定型的 (图9 (a2) ) 。这可能是由于年轻皮肤真皮层中的胶原蛋白纤维含量丰富, 纤维组织紧实致密, 因而呈现出不定型的外表;而衰老皮肤中的胶原蛋白含量减少, 排列较为稀疏, 因此呈现出丝状。同时, 衰老皮肤真皮层中的胶原蛋白表现为弯曲伸展 (图9 (c2) ) , 中年皮肤的胶原蛋白表现为直线伸展 (图9 (c1) ) , 而年轻皮肤的胶原蛋白纤维排列致密, 难以分辨伸展情况。在自发荧光成像中, 衰老皮肤真皮层中的弹性蛋白纤维排列结构混乱 (图9 (b2) ) , 并且弯曲伸展 (图9 (d2) ) ;而年轻皮肤中的弹性纤维具有良好的网络结构 (图9 (b1) ) , 且直线伸展 (图9 (d1) ) [19]。对于胶原蛋白纤维和弹性蛋白纤维的分布, 年轻皮肤真皮层中两者信号呈均匀的散状分布, 而在衰老皮肤真皮层中, 弹性蛋白纤维信号大大增强, 而胶原蛋白信号仅能在基底膜下很小的区域被检测到[20]。这也与随着皮肤衰老, 胶原蛋白纤维减少而弹性蛋白纤维增多的组织学结论相符合[10]。
4 结论
多光子皮肤检测技术具有诸多优点。首先, 多光子技术具有很好的共聚焦特性, 因此能够对皮肤组织进行较好的层析成像;其次, 双光子荧光技术需要的激发光波长为普通单光子激发波长的两倍, 能量较低, 对组织的损伤小, 使安全的活体检测成为可能;同时, 较长波长的光具有较小的散射与吸收系数, 相比一般的共聚焦技术, 能够探测到更深的组织结构;最后, 该技术将荧光强度的探测成像与荧光寿命的探测成像结合起来, 不仅能够对组织内部物质的形态进行成像, 也能分析组织的物质组成、代谢以及生理病理情况, 实现多种模态的结合, 使得检测结果更具有应用价值。
当然, 此技术也存在一些不足。由于荧光寿命成像相对传统荧光成像而言所需的时间较长, 在成像期间, 被检测者必须保持完全静止不动才能获得较好质量的图像[11]。因此, 缩短成像的时间能改善图像质量, 并提高患者的就医体验。同时, 此系统的单次成像区域相对临床上实际待检区域 (例如皮肤损伤区域) 而言面积较小, 若能开发算法实现图像的连续获取与自动整合, 实现较大区域范围内的皮肤成像[11], 将对临床诊断大有裨益。
多光子皮肤检测系统也可通过结合其他种类的影像技术, 实现更多模态的检测。例如中国科学院深圳先进技术研究院医工所生物医学光学与分子影像研究室在2016年实现了光声、双光子、二次谐波成像3种技术的集成, 成功对皮肤组织的微血管、细胞、胶原纤维进行了无标记在体成像[21], 为皮肤组织的临床检测提供更全面的生理信息。此外, 该系统也可通过进一步集成皮肤血管血流量、血氧检测等手段, 为病理检测提供关键的生物特征信息。最后, 在智能医疗快速发展的今天, 将此多光子皮肤检测系统与机器学习、图像自动分割相结合, 实现一些病灶的自动检出, 辅助医生进行诊断, 不失为此类医学影像系统的未来发展方向之一。
参考文献:
[1] KONIG K, RIEMANN I.High-resolution multiphoton tomography of human skin with subcellular spatial resolution and picosecond time resolution[J].J.Biomed Opt., 2003, 8 (3) :432-439.
[2] ZHANG Y, HONG H, CAI W.Photoacoustic imaging[J].Cold Spring Harb Protoc, 2011, 2011 (9) :1015-1025.
[3] HUANG D, SWANSON E A, LIN C P, et al..Optical coherence tomography[J].Science, 1991, 254 (5035) :1178-1181.
[4] DENK W, STRICKLER J H, WEBB W W.Two-photon laser scanning fluorescence microscopy[J].Science, 1990, 248 (4951) :73-76.
[5] KONIG K.Multiphoton Tomography[OL].[2018-02-20].http:www.mpt-tomography.de.
[6] KONIG K.Clinical multiphoton tomography[J].J.Biophotonics, 2008, 1 (1) :13-23.
[7] BREUNIG H, WEINIGEL M, BUCKLE R, et al..Clinical coherent anti-Stokes Raman scattering and multiphoton tomography of human skin with a femtosecond laser and photonic crystal fiber[J].Laser Physics Letters, 2013, 10 (2) :025604.
[8]MONICI M.Cell and tissue autofluorescence research and diagnostic applications[J].Biotechnol Annu Rev, 2005, 11:227-256.
[9]席鹏, 刘宇嘉, 姚志荣, 等.用于皮肤影像诊断的光学成像方法[J].中国激光, 2011, 38 (2) :7-19.XI P, LIU Y J, YAO ZH R, et al..Optical imaging techniques in skin imaging diagnosis[J].Chinese Journal of Lasers, 2011, 38 (2) :7-19. (in Chinese)
[10] JAMME F, KASCAKOVA S, VILLETTE S, et al..Deep UV autofluorescence microscopy for cell biology and tissue histology[J].Biol.Cell, 2013, 105 (7) :277-288.
[11]SEIDENARI S, ARGINELLI F, BASSOLI S, et al..Multiphoton laser microscopy and fluorescence lifetime imaging for the evaluation of the skin[J].Dermatol Res Pract, 2012, 2012:810749.
[12]GIBSON E A, MASIHZADEH O, LEI T C, et al..Multiphoton microscopy for ophthalmic imaging[J].Journal of Ophthalmology, 2011, 2011:870879.
[13] BALU M, ZACHARY C B, HARRIS R M, et al..In Vivo multiphoton microscopy of basal cell carcinoma[J].JAMA Dermatol, 2015, 151 (10) :1068-1074.
[14]TSAI T H, JEE S H, DONG C Y, et al..Multiphoton microscopy in dermatological imaging[J].J.Dermatol Sci., 2009, 56 (1) :1-8.
[15] KONIG K.Fluorescence Lifetime Imaging[OL].[2018-02-20].http://mpt-tomography.de/fluorescence-lifetime-imaging
[16] DANCIK Y, FAVRE A, LOY C.J, et al..Use of multiphoton tomography and fluorescence lifetime imaging to investigate skin pigmentation in vivo[J].J.Biomed Opt., 2013, 18 (2) :26022.
[17] WEINIGEL M, BREUNIG H G, KELLNER-HFER M, et al..In vivo histology:optical biopsies with chemical contrast using clinical multiphoton/coherent anti-Stokes Raman scattering tomography[J].Laser Physics Letters, 2014, 11 (5) :055601.
[18] KONIG K.In-Vivo Clinical Applications[OL].[2018-02-20].http://mpt-tomography.de/vivo-clinical-applications.
[19] KOEHLER M J, HAHN S, PRELLER A, et al..Morphological skin ageing criteria by multiphoton laser scanning tomography:non-invasive in vivo scoring of the dermal fibre network[J].Exp.Dermatol, 2008, 17 (6) :519-523.
[20] LIN S J, WU R, J R, TAN H Y, et al..Evaluating cutaneous photoaging by use of multiphoton fluorescence and secondharmonic generation microscopy[J].Opt.Lett., 2005, 30 (17) :2275-2277.
[21] SONG W, XU Q, ZHANG Y, et al..Fully integrated reflection-mode photoacoustic, two-photon, and second harmonic generation microscopy in vivo[J].Sci.Rep., 2016, 6:32240.





