摘 要: 农杆菌介导的植物稳定遗传转化技术已经在植物基因工程领域得到广泛应用.本文介绍了一种由农杆菌介导的新型植物遗传转化技术—发芽种子真空侵染法.应用此方法将表达载体p BI121-HC-Pro转化到烟草植株中, 并优化了农杆菌的浓度及真空侵染的条件.半定量RT-PCR (Reverse transcription-PCR) 方法检测结果表明这种转化方法可以使HC-Pro在烟草中表达, 具有广泛的应用前景.
关键词: 新型遗传转化技术; 发芽种子真空侵染法; 半定量RT-PCR; HC-Pro;
Abstract: Agrobacterium-mediated plant stable genetic transformation technology has been widely used in plant genetic engineering. In this paper, a new technology of plant genetic transformation mediated by Agrobacterium was introduced. The vector pBI121-HC-Pro into tobacco plants was transformed by using vacuum infiltration of germinated seeds, and optimized the concentration of Agrobacterium and the condition of vacuum infiltration.The results of semi-quantitative RT-PCR showed that HC-Pro gene could be stably expressed in tobacco plants by the technology. The new technology has broad application prospects.
Keyword: stable transformation; vacuum infiltration; semi-quantitative RT-PCR; helper component-proteinase;
随着植物基因工程的迅速发展, 植物遗传转化的方法越来越多样, 例如农杆菌介导法、基因枪法、超声波法、电转化法和花粉管通道法等多种方法, 其中农杆菌介导的转基因方法是目前植物遗传转化的重要方法之一[1].农杆菌介导的植物遗传转化中, 叶盘转化法以转化效率高, 转化稳定等优点, 应用最为广泛.叶盘转化法也存在诸多问题, 如转化周期长, 需培养过程较为复杂, 而且有一定的的污染率, 及由激素[2,3]、阳离子[4]、培养环境[5]等导致的畸形苗和玻璃化问题[6].
蚜传辅助因子HC-Pro (helper component-proteinase) 是一种RNA沉默抑制子[7], 是由烟草蚀纹病毒 (TEV) 和马铃薯Y病毒 (PVY) 编码的[8].可抑制植物的基因沉默, 反式激活其他病毒的复制, 增强其致病性, 使其他病毒的危害加重, 植物病毒间的协生作用就是由此引起的[9].HC-Pro蛋白能通过阻止21-24nt siRNA的形成或干扰siRNA的稳定性在抵抗宿主的基因沉默效应中起作用[10,11], 其抵御外源基因和病毒的入侵, 并且保持自身基因组稳定[12,13].基因沉默效应广泛的存在于植物生长发育的各个阶段[14], 已有实验证明HC-Pro蛋白在马铃薯Y病毒属相关的协同作用中起着重要作用[15].
本文中介绍了一种植物遗传转化的新型技术, 利用烟草的发芽种子真空侵染法获得转基因烟草, 通过半定量RT-PCR鉴定检测到HC-Pro的表达.并对这种新技术进行了优化实验, 以提高外源基因的表达效率, 为我们进行HC-Pro蛋白的功能研究奠定了实验基础.

1 、实验材料
1.1、 植物材料与表达载体
野生型烟草 (Nicotiana benthamiana L.) 和DH5a, EHA105等菌种为本实验室保存, 表达载体p BI121-HC-Pro由本实验室成员构建.
1.2、 实验试剂
反转录试剂盒、La-Taq等酶试剂购自大连宝生物;各种试剂、药品购于北京鼎国生物公司.
2 、实验方法
2.1、 发芽种子培养及菌液的准备
烟草种子用30%的84消毒液进行消毒, 消毒时间为10 min, 再用无菌水清洗3次后播种在MS固体培养基上, 光照培养箱中培养2 d.烟草种子发芽时, 准备侵染.取构建成功的带有表达载体和目的基因的农杆菌菌种, 将1 m L菌种活化在5 m L LB加入5μL Kana霉素母液和5μL福利平母液的培养液中, 28℃条件下, 180 rpm过夜培养.次日, 扩摇100 m L LB, 按比例加入抗生素, 并加入乙酰丁香酮40μL/100 m L, 菌液OD600值达到0.6~1.0时备用.
2.2、 烟草发芽种子的真空侵染
菌液在5 000 rpm条件下离心10 min, 倒掉上清液后用配制好的100 m L MMA溶液重悬收集的菌体, 室温避光放置1~3 h待用.将重悬的菌液倒入培养皿中, 约20 m L, 放入已发芽的烟草种子, 分别在不同压力条件下 (0.05、0.06、0.07、0.08 MPa) , 抽真空3 min.清水冲洗后移栽到花盆中, 覆盖黑色塑料袋避光1 d.继续培养幼苗7~15 d后观察转基因植物表型并鉴定.
2.3、 转HC-Pro基因的烟草植株的RT-PCR鉴定
为检测转基因植株中的目的基因是否在转录水平上得到表达, 我们采用RT-PCR的方法对侵染后的植株进行检测.利用Trizol法提取植物总RNA, 用30μL灭菌的ddH2O进行RNA溶解.总RNA样品进行预变性, 加入反转录酶及反转录酶缓冲液和RNA酶抑制剂进行反转录反应获得cDNA, 42℃60 min后置于冰上;取2μL cDNA为模板进行PCR扩增和电泳检测.
3 、结果与分析
3.1 转HC-Pro基因的烟草植株差异表型的观察
播种后两天的烟草发芽种子并且抽出子叶节时进行侵染, 真空侵染后的发芽种子栽种到土壤生长中.生长过程中逐渐有部分幼苗较弱小甚至死亡现象.成活的烟草有植株生长缓慢、细弱的特点, 栽种后15 d左右, 植株有叶片蜷缩不舒展叶缘不规则缺刻 (如图1 (A) ) , 转基因苗出现叶片严重蜷曲变形的表型 (如图1 (B) ) , 并且伴随部分株系败育的现象.子代转基因烟草植株叶片与野生型植株烟草叶片对比后发现, 转基因烟草子代植株与野生型烟草的株型差异不大但是其叶片仍有卷曲缺刻的现象.
图1 HC-Pro转基因烟草植株表型

(A) 侵染后的烟草幼苗; (B) 栽种后有明显表型特征的转基因烟草苗
3.2、 HC-Pro转基因烟草及子代的RT-PCR鉴定
利用发芽种子抽真空的方法将表达载体p35S-HC-Pro转化到烟草植株中, 我们获得了大量HC-Pro转基因烟草;并对这些转基因植株进行了转录水平的检测.选取有转基因表型的植株, 进行RT-PCR检测分析.结果表明:被检测的植株中HC-Pro获得较高水平的表达 (如图2 (A) ) , 重复检测结果与其一致, 如图2 (B) 所示.
图2 转基因植株中HC-Pro基因的表达检测
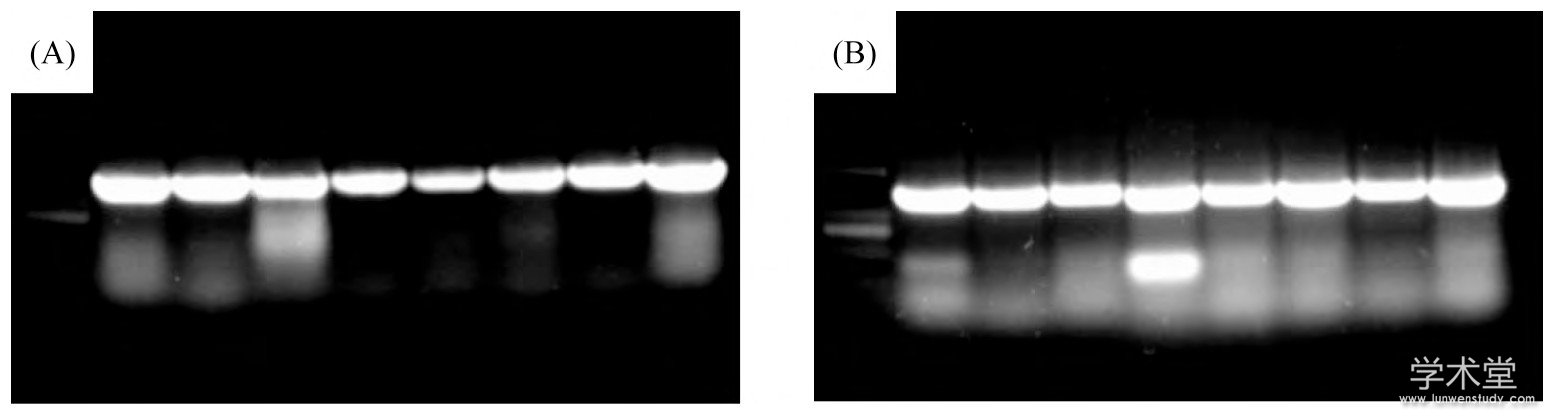
(A) RT-PCR检测HC-Pro基因的表达; (B) HC-Pro基因的重复检测结果
4、 讨论
农杆菌介导的植物侵染和基因表达研究的已经较为深入[16,17,18,19].实验中农杆菌的菌液浓度和侵染压力是使目的基因成功转化的主要影响条件[20,21,22].我们设置农杆菌在MMA重悬溶液中的OD600, 分别为0.4、0.6、0.8、1.0和1.2, 对发芽的烟草种子进行侵染.结果表明:在OD600为0.4时转化效率过低, 当OD600为1.2时会使烟草幼苗的死亡率升高;最适宜的农杆菌重悬液浓度范围为OD600=0.6~1.0, 能够有效提高转化的效率.
此外, 我们对真空侵染的压力条件进行了优化实验, 分别设置不同的压力:0.04、0.05、0.06、0.07、0.08 MP, 不同的压力梯度下进行侵染, 并观察植物表型.结果表明在0.06 MP压力下, 适当增加抽真空次数可以达到有效侵染的目的.但更多地实验条件的优化还需要进一步的研究.
参考文献
[1]姚冉, 石美丽, 潘沈元, 等.农杆菌介导的植物遗传转化研究进展[J].生物技术进展, 2011, 1 (4) :260-265.
[2]KATAEVA NV, ALEXANDROVA IG, BUTENKO RG, et al. Effect of applied and internal hormones on vitrification and apical necrosis of different plants cultured in vitro[J]. Plant Cell, Tissue and Organ Culture, 1991, 27 (2) :149-154.
[3]KADOTA M, NIIMI Y. Effects of cytokinin types and their concentra-tions on shoot proliferation and hyperhydricityin vitro pear cultivar shoots[J]. Plant Cell, Tissue and Organ Culture, 2003, 72 (3) :261-265.
[4]MONSALUD MJ, MATHEWS H, LITZ RE, et al. Control of hyperhydricity of mango somatic embryos[J]. Plant Cell, Tissue and Organ Culture, 1995, 42 (2) :195-206.
[5]SAHER S, PIQUERAS A, HELLIN E, et al. Prevention of hyperhydricity in micropropagated carnation shoots by bottom cooling:implications of oxidative stress[J]. Plant Cell, Tissue and Organ Culture, 2005, 81 (2) :149-158.
[6]亓建飞, 李付广, 张朝军, 等.植物组织培养中畸形苗发生机理的研究进展[J].棉花学报, 2004, 16 (4) :243-248.
[7] ANANDALAKSHMI R, PRUSS G J, GE X, et al. A viral suppressor of gene silencing in plants[J]. Proc Natl Acad Sci USA, 1998, 95 (22) :13079-13084.
[8]BRIGNETI G, et al. Viral pathogenicity determinants are suppressors of transgene silencing in Nicotiana benthamiana[J]. Embo J, 1998, 17 (22) :6739-46.
[9]李向东, 李怀方, 范在丰, 等.马铃薯Y病毒属病毒HC-Pro研究进展[J].山东农业大学学报 (自然科学版) , 2000, 31 (4) :437-440.
[10]蒋琳, 魏春红, 李毅.病毒基因沉默抑制子及其作用机制[J].中国科学, 2012, 42 (1) :16-28.
[11]VANCE V B, ANANDALAKSHMI R, PRUSS G J, et al. A viral suppressor of gene silencing in plants[J]. Proc Natl Acad Sci USA, 1998, 95:13079-13084.
[12]BOUTET S, VAZQUEZ F, LIU J, et al. Arabidopsis HEN1:A genetic link between endogenous miRNA controlling development and siRNA controlling transgene silencing and virus resistance[J]. Curr Biol, 2003, 13 (10) :843-848.
[13]HAN M H, GOUD S, SONG L, et al. The Arabidopsis double-stranded RNA-binding protein HYL1 plays a role in microRNA-mediated gene regulation[J]. Proc Natl Acad Sci USA, 2004, 101 (4) :1093-1098.
[14]PARK M Y, WU G, GONZALEZ-SULSER, et al. Nuclear processing and export of microRNA in Arabidopsis[J]. Proc Natl Acad Sci USA, 2005, 102 (10) :3691-3696.
[15]GAIL J P, CHRISTOPHER B L, TROY B, et al. The potyviral suppressor of RNA silencing confers enhance dresistance to multiple pathogens[J]. Virology, 2004, (320) :107-120.
[16]杨丽萍, 许亚男, 刘雨晴, 等.利用根部真空侵染法在烟草中瞬时表达外源蛋白[J].分子植物育种, 2016, 14 (12) :3385-3389.
[17]杨丽萍, 金太成, 徐洪伟, 等.植物中瞬时表达外源基因的新型侵染技术[J].遗传, 2013, 35 (1) :111-117.
[18]YANG L P, XU Y N, LIU Y Q, et al. HC-Pro viral suppressor from tobacco vein banding mosaic virus interferes with DNA methylation and activates the salicylic acid pathway, Virology, 2016, 497:244-250.
[19]杨丽萍, 金太成, 周晓馥, 利用农杆菌侵染新技术在豌豆中瞬时表达ha FGF[J].生物技术通报, 2013, 1 (10) , 71-75.7
[20]YANG L P, WANG H W, LIU J Y, Et al. A simple and effective system for foreign gene expression in plants via root absorption of agrobacterial suspension, Journal of Biotechnology, 2008, 134:320-324
[21]JIN T C, WANG J, ZHU X J, et al. A new transient expression system for large-scale production of recombinant proteins in plants based on airbrushing an Agrobacterium suspension, Biotechnology Report, 2015, 6:36-40.
[22]FAN Y J, LI W, WANG J J, et al. Efficient production of human acidic fibroblast growth factor in pea (Pisum sativum L.) plants by agroinfection of germinated seeds[J]. BMC Biotechnol, 2011, 11:45.





