
氟苯尼考( florfenicol,简称 F) 是一种新型的广谱抗生素. 作用机理和抗菌谱与甲砜霉素、氯霉素相似,但抗菌活性要优,且无再生障碍性贫血等不良作用,不易被耐氯霉素和甲砜霉素耐药菌株产生的乙酰转移酶破坏,现已成为兽用抗菌药物之一[1 -4]. 氟苯尼考胺( florfenicol amine,简称 FFa) 是 F 的主要代谢产物,我国[5]和欧盟[6]对动物源性食品中的 F 残留限 MRLs 值作了规定,并以 F 与 FFa 作为检出物.F 在畜禽体内药代动力学的研究已有不少[7 -10],但对其在大鼠体内吸收代谢产物鲜有报道. 本试验研究了氟苯尼考注射液在大鼠体内的药动学行为,为临床制定给药方案提供依据.
1 材料与方法
1. 1 实验动物
清洁级 SD 大鼠18 只,雌雄各半( 平均体重 200± 20 g) 随机分为 A、B、C 3 组,预饲 1 周后试验,给药前禁饲 12 h,给药后禁饲 4 h,自由饮水.
1. 2 药品和试剂
试验品: 氟苯尼考注射液( F 含量 30%) ,批号为 120725,由烟台绿叶动物保健品有限公司提供.
对照品: 纽弗罗注射液( F 含量 30%,) 批号为RKPB1586,美国先灵葆雅制药有限公司.
标准品: 氟苯尼考( 含量99. 9%) ,批号为 CDCT- C13665000,德国 Dr. 盐酸氟苯尼考胺( TRC,含量99. 9% ) ,批号为 CDDM - F405770,多伦多研究院.氯霉素( 含量 99. 6%) ,中国兽医药品监察所提供.其他: 冰醋酸为分析纯,乙腈为色谱纯.
1. 3 主要仪器
Agilent1200 高效液相色谱仪,VWD 检测器,自动进样器,XW -80 A 涡旋混合器,HSC -24 A 氮吹仪,pH 计,十万分之一电子天平,微量移液器,Ther-mo 微量高速离心机等.
1. 4 试验方法
1. 4. 1 给药和血样采集 试验 A 组尾静脉注射氟苯尼考注射液,B、C 两组分别腿部肌肉注射氟苯尼考注射液和纽弗罗注射液,给药剂量均为 30 mg/kg,A 组于给药前及给药后 0. 083、0. 25、0. 5、1. 5、2、4、6、8、12、24 h 眼眶静脉丛采血 0. 4 mL; B 组、C 组于给药前及给药后 0. 25、0. 5、1. 5、2、4、6、8、12、24 h眼眶静脉丛采血 0. 4 mL,置含肝素钠抗凝剂的离心管中,混匀,3 600 r/min 离心 10 min,吸取上层血浆,置 -20 ℃保存.
1. 4. 2 血浆样品的处理 取血浆 200 μL 置 10 mL玻璃离心管中,加入 300 μg/mL 的氯霉素 10 μL 作为内标物,再加入 pH 7. 0 的磷酸盐缓冲液 1 mL 涡旋1 min,加入3 mL 乙酸乙酯,涡旋混合3 min,离心分离上层有机相于另一离心管内,重复提取一次,合并乙酸乙酯层提取液,45 ℃下氮气吹干. 用 100 μL流动相复溶残渣,以 13 000 r/min 离心 10 min,取上清液进样.
1. 4. 3 色谱条件 色谱柱: Phenomenex luna - C18( 5μm,4. 6 ×250 mm) ; 流动相为乙腈 - 水 - 冰醋酸( 100: 197: 3,V/V/V) ,VWD 检测器,检测波长 223nm,流速 1. 0 mL / min,柱温 35 ℃[6].
1. 4. 4 方法学研究 取空白血浆 200 μL 置 10 mL离心管中,以标准品氟苯尼考与氟苯尼考胺配制浓度均为0. 05 ~16. 0 μg/mL 的含药血浆,按1. 4. 2 项下操作,以 F 与内标峰面积比对 F 浓度做权重系数为 1/c2的加权回归,得 F、FFa 的标准曲线分别为: y= 0. 176 1x + 0. 055 4,r = 0. 991 2; y = 0. 163 1x +0. 051 3,r = 0. 993 5,结果表明 F 及 FFa 在 0. 05 ~ 16μg /mL 范围内线性关系良好,定量下限均为 0. 05μg /mL,最低检测限按信噪比 S /N = 3 计算均为0. 025 μg / mL.
另取空白血浆200 μL 置10 mL 离心管中,配制浓度为 0. 125、1、8 μg/mL 的含药血浆,按 1. 4. 2 项下操作,考察得血浆中 F 与 FFa 的日内和日间精密度分别在 1. 29% ~ 3. 12% 和 3. 89% ~ 5. 01% 范围内; 回收率分别为( 103. 1 ± 5. 27) % ~ ( 96. 15 ±3. 40) % 及( 105. 2 ± 3. 76) % ~ ( 94. 31 ± 2. 67) % ,符合生物样品分析要求.
2 数据处理
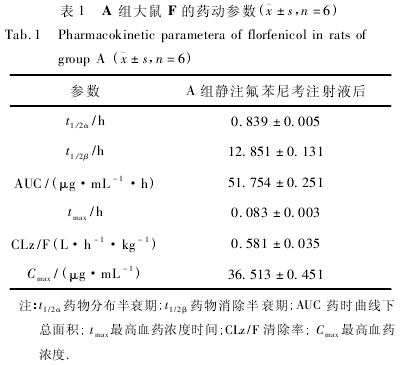
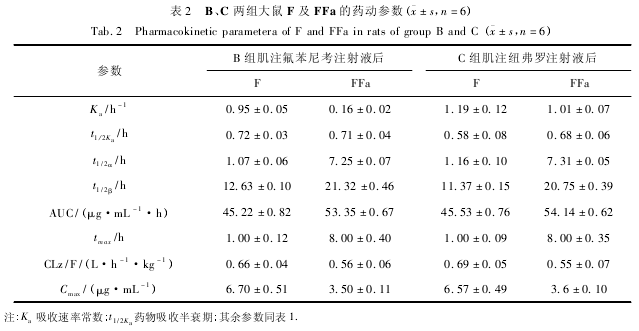
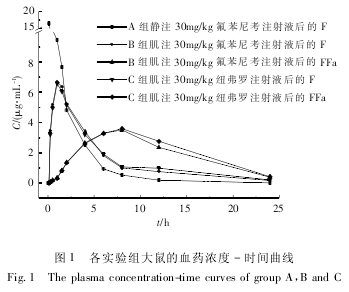
用 DAS2. 1. 1 软件计算 A、B、C 3 组大鼠血浆中F 及 FFa 的药物动力学参数,结果见表 1、表 2,药时曲线见图 1.
3 讨 论
3. 1 静注给药的药动学特征
健康大鼠静注氟苯尼考注射液( 30 mg/kg) 后,F 的药动学行为符合二室开放模型,与 F 在牛体内的药代动力学研究相符[11 -12]. 大鼠静注后,深室分布较快,分布半衰期为 t1 /2α为0. 84 h,AUC 为 51. 75mg / L·h,Cmax为 36. 51 μg/mL.
据相关报道,F 在牛[11 -12]、奶山羊[13]、猪[9,14]体内消除半衰期分别为 2. 3 ~ 4. 1 h、2. 3 h 和 6. 72h,本试验中 F 在大鼠体内的消除缓慢,t1 /2β为 12. 85h; F 在牛[11 -12]、奶山羊[13]、马[15]和猪[9,14]体内的全身清除率分别为 0. 15 ~0. 26、0. 47、0. 40 和 0. 23 L/( h·kg) ,与试验确定的 F 在大鼠体内的 CLz/F 为0. 58 L / ( h·kg) 相近. AfifiNA 等认为,F 在动物体内清除率低,消除缓慢是由于 F 化学结构中 - OH被 - F 取代,阻遏葡萄糖醛酸的结合,从而延缓了动物体内 F 的排泄所致[16].
3. 2 肌注给药的药动学特征
大鼠肌注氟苯尼考注射液及对照品纽弗罗注射液( 30 mg/kg,按氟苯尼考载药量计算) 后,药动学行为均符合一室模型,与文献报道其在牛[11 -12]、马[15]、鸡[16]的研究结果一致. 吸收较快且完全,吸收半衰期分别为 0. 72、0. 58 h,在 1 h 均达到最大吸收,分别为 6. 70、6. 57 μg/mL; 在大鼠体内消除缓慢,消除半衰期分别为 12. 63、11. 37 h; 肌注氟苯尼考注射液与对照品纽弗罗注射液后药动学参数无显着差异,F 的相对生物利用度为 99. 32%,绝对生物利 用 度 为 87. 38%,比 牛[11 -12]( 78. 5%) 、鸭[17]( 73. 03%) 、马[15]( 81%) 和山羊[18]( 65. 72%) 高,比鸡[16]( 96. 6%) 和猪[9,14]( 96. 86%) 低.
3. 3 肌注后代谢产物的药动学特征
F 的代谢物主要是 FFa[19],目前没有报道显示其有抗菌活性,但是 F 用于可食性动物源时,FFa 是残留检测的重要指标之一[5 -6]. B 组大鼠肌注氟苯尼考注射液后代谢产物 FFa 在给药后 0. 5 h 浓度即达到 0. 1 μg/mL 以上,8 h 达到最高峰,与 C 组大鼠肌注对照品纽弗罗注射液后代谢物 FFa 药动学参数无显着差异.
4 结 论
本试验研究了静注及肌注氟苯尼考注射液与对照品纽弗罗注射液后 F 在大鼠体内的药代动力学特征,结果表明 F 吸收迅速,消除缓慢( 12 h 仍能维持 0. 5 μg/mL) ,据报道 F 对其敏感菌的 MIC 均为0. 5 μg / mL 左右[20],本品( 氟苯尼考注射液) 能在较长时间内维持药效浓度.
肌注氟苯尼考注射液后代谢物 FFa 在大鼠体内消除缓慢,分布均匀,氟苯尼考注射液的相对生物利用度为 99. 32%,绝对生物利用度为 87. 38%,试验品氟苯尼考注射液与对照品纽弗罗注射液在大鼠体内的药动学参数无显着差异,为氟苯尼考注射液进一步临床试验提供了参考依据.
参考文献:
[1] Cannon M,Harford S,Davies. A comparative study on theinhibitory actions of chloramphenicol,thiamphenicol and somefluorinated derivatives[J]. Jantimicrob Chemother,1990,26( 3) : 307-317.
[2] Salmon S A,Watts J L. Minimum inhibitory concentrationdeterminations for various antimicrobial agents against 1570bacteiral isolates from turkey poults[J]. Avain Diseases,2000,44( 1) : 85-88.
[3] Graham R,Palmer D,Pratt B C,et al. In vitro activity offlorfenico1[J]. Eur J Cl in Microbiol Infect Dis,1988,7 ( 5) :691-694.
[4] Ayling R D,Baker S E,Peek M L,et a1. Compairson ofin vitro activity of danolfoxacin,florfenicol,oxteracycline,specti-nomycin and tilmicosin against recent field isolates of Mycoplas-ma bovis[J]. Veterinary Record,2000,146( 26) : 745-747.
[5] 中国兽药典委员会. 中华人民共和国兽药典( 一部)[S]. 北京: 中国农业出版社,2010: 160-161.
[6] EMEA-EU. Committee for veterinary medicinal products:Florfenicol( extension to all food producing species) ,summaryreport( 6) [Z / OL]. London,UK.
[7] Harrs V D,Lockwood P W,Katz T,et a1. Efficacy of flor-fenicol in the treatment of bovine respiratory disease-Results ofclinical trials in Europe [J]. Praktische Tierarzt,1995,76( 9) :124803-807.
[8] Nordmo R,Varma K J,Sutherland I H,et al. Florfenicol inAtlantic Salmon,Salmo Salar: field evaluation of efficacy furun-culso is in Norway[J]. Journalof Fish Disaeses,1994,17 ( 3) :239-244.
[9] Ueda Y,Ohtsuki S,Narukawa N. Efficacy of florfenicol onexperimental Actinobacillus pleuropneumonia in pigs[J]. Journalof Veteirnary Medical Science,1995,57( 2) : 261-265.
[10] Byung-Kwon Park,Jong-Hwan Lim,Myoung-Seok Kim,et al. Pharmacokinetics of florfenicol and its metabolite,florfeni-col amine,in dogs [J]. Research in Veterinary Science,2008,84( 1) : 85-89.
[11] Adams P E,Vanna X I,Powers T E,et al. Tissue con-centration and pharmacokinetics of florfenicol in male veal calvesgiven repeateddoses[J]. Am J Vet Rese,1987,12: 1725-1732.
[12] Vanna K J,Adams P E,Powers T E,et al,Pharmacoki-netics of florfenicol in vea1 calvse[J]. J Vet Pharmacol Therap,1986,9: 412-425.
[13] Lavy E,Ziv G,Soback S,et al. Clinical pharmacology offlorfenicol in lactating goats[J]. Acta Vet Scand,1991,87( Sup-pl) : 133-136.
[14] 蒋红霞,冯淇辉,曾振灵. 氟甲砜霉素在猪体内的药物动力学研究[J]. 中国兽医学报,2001,1( 21) ,86-89.
[15] Mckeller Q A,Vamra K J. Phamacokinetics and toler-ance of florfenicol in Equidae[J]. Equine Vet J,1996,28( 3) :209-213.
[16] Afifi N A,Aboel-Sooud K A. Tissue concentrations andpharmacokinetics of florfenicol in broiler chickens[J]. BirtishPoultry Sciense,1997,38( 4) : 25-428.
[17] el-Banna H A. Pharmacokinetics of florfenicol in normaland Pasteurella-infected Muscovy ducks[J]. British Poultyr Sci-ence,1998,39: 492-496.
[18] Atef M,el-Gendi A Y,Aziza M M,et a1. Pharmacokinet-ics properties of florfenicol in Egyptian goats[J]. Deutsche Tier-ortliche Wochencshrift,2000,107( 4) : 147-150.
[19] Hormazabal V,Steffenak I,Yndestad M. Simultaneousdetermination of residues of florfenicol and the metabolite florfen-icol amine in fish tissues by high-performance liquid chromatog-raphy[J]. Journal of Chromatography B: Biomedical Sciencesand Applications,1993,616( 1) : 161-165.
[20] 江丽,雷淑珍. 氟苯尼考与多种抗菌药物联合应用对大肠杆菌的体外抑菌试验 [J]. 广东畜牧兽医科技,2008,3( 8) : 98-101





