
糖尿病是因自身免疫失调、基因或代谢异常而引起胰岛素缺乏和/或糖异生增加、血糖升高的一类内分泌疾病。国际糖尿病基金会的研究表明全球1 型和 2 型糖尿病的患病率为 8.3%。1 型和多数 2型糖尿病患者由于胰岛 β 细胞损伤或功能失调均需给予胰岛素治疗。重组人胰岛素是以重组 DNA技术合成的一种多肽类激素,其分子结构中包含 51个氨基酸残基,与人胰岛 β 细胞生成的天然人胰岛素结构相同。为实现特定的药动学和药效学特征,满足不同患者的治疗和应用需求,各种重组胰岛素制剂和重组胰岛素类似物不断涌现。重组人胰岛素注射液 Insulin R 和 Humulin R 均通过 Escherichacoli 菌株生产而得,制剂中未加入其他改变药物吸收速率和作用时间的物质。通过以美国 Lilly 公司的 Humulin R 为对照品,评价国产重组人胰岛素注射液Insulin R供试品在正常Beagle犬体内的相对生物利用度,并对两者进行生物等效性评价。
1 材料和方法
1.1 实验材料
1.1.1 受试药物 重组人胰岛素注射液(InsulinR),规格 3 mL∶300 U,批号 20111202,合肥天麦生物科技发展有限公司提供。重组人胰岛素注射液(优泌林 R,Humulin R),规格 3 mL∶300 U(笔芯),1 支/盒,批号 A850900C,分包装批号 L02227,法国礼来公司生产。
1.1.2 试剂 抑肽酶,比活>5 500 U/mg,规格 5mg/ 瓶,美国罗氏公司产品(进口分装),批号6247884,2~8 ℃保存。
1.1.3 放射免疫分析试剂盒 人胰岛素放射免疫分析试剂盒(Human Insulin Specific RIA Kit)为美国Millipore 公司产品,编号 HI-14K,该试剂盒主要用于定量测定血清、血浆中人胰岛素的含量。犬 C 肽放射免疫分析试剂盒(Canine C-Peptide RIA Kit)为美国 Millipore 公司产品,编号 CCP-24HK,该试剂盒主要用于定量测定血清、血浆中犬C肽的含量。
1.1.4 仪器 Thermo Scientific Sorvall ST 16R 低温离心机,为美国 Thermo 公司产品。GAMMA—C12γ计数仪,为美国德普公司产品(附数据处理软件)。
Accu-Chek Performa 卓越型血糖仪及配套血糖试纸,均为罗氏公司产品。
1.1.5 实验动物 健康成年 Beagle 犬,12 只,雌雄各半,体质量 8~10 kg,7~8 月龄,由安徽省阜阳市维光实验动物中心提供,实验动物生产许可证号 SCXK(皖)2011-001,实验动物质量合格证0000399。实验动物单笼饲养于全封闭观察室,适应期 1 个月。观察室温度:16~26 ℃,湿度:40%~70%,光照:昼夜明暗交替时间为 12 h/12 h,通风:换气次数不低于8次/h,实验动物使用许可证SYXK(津)2011-0005。
1.2 方法
1.2.1 剂量设计 Humulin R 的临床剂量(代偿期)为 0.1~0.5 U/(kg·d?1),餐前 0.5 h 给药,3 次/d。按体表面积折合 Beagle 犬等效剂量约为 0.17~0.86U/(kg·d?1),考虑采用健康 Beagle 犬作为实验动物,最终选择 0.5 U/kg 剂量作为 Insulin R 和 Humulin R药动学的给药剂量。
1.2.2 试验分组及给药 12 只健康成年 Beagle 犬在适应期结束后,随机分成 2 组,每组 6 条,雌雄各半。第 1 次试验,第 1 组动物于犬颈背部 sc 受试药 Insulin R,剂量为 0.5 U/kg,给药体积 0.1 mL/kg;第 2 组动物 sc 同剂量同体积的对照药 Humulin R。
经 15~16 d 清洗期后进行第 2 次试验,交叉给药,即第 1 组 sc Humulin R,第 2 组 sc Insulin R,剂量和给药体积同前。动物给药后 6 h 统一饲喂。
1.2.3 样品收集与存放 受试动物于颈背部 scInsulin R 和 Humulin R,给药体积为 0.1 mL/kg。于0 h(药前)、0.17、0.33、0.5、1、1.5、2、2.5、3、4、5、6 h(药后),从前肢头静脉采血约 2 mL,一滴全血即刻用于血糖测定,其余肝素钠抗凝,低温(4 ℃)3 000 r/min 离心 20 min,制备血浆,分装 2管。其中 1 管加入抑肽酶(500 kU/mL 血浆)以防C 肽发生蛋白水解。所有待测样品于?20 ℃保存,直至测定。
1.2.4 Beagle 犬校正后血药浓度测定 由于正常动物体内含内源性胰岛素,将干扰血药浓度测定。通常胰岛素和 C 肽在体内是等分子分泌,测定血浆中犬 C 肽水平可用于校正内源性胰岛素的水平。本研究采用定量检测特异性犬 C 肽试剂盒,与胰岛素同步检测血浆中犬C肽浓度以扣除犬内源胰岛素对外源性胰岛素测定的影响。具体方法为:Iex(t)=It0(t)-[C(t)I(t=0)/C(t=0)],其中 Iex(t)是注射后 t 时间的校正胰岛素浓度,It0(t)是注射后 t 时间的总胰岛素浓度,C(t)是 t 时的 C 肽浓度,I(t=0)]是初始内源性胰岛素浓度,C(t=0)是初始时 C 肽浓度[6-7]。采用 RIA 法测定的各时间点胰岛素浓度减去相应时间点的 C 肽浓度后,得到校正后的胰岛素浓度。
1.2.5 药效学/药动学参数及生物等效性计算 所有试验数据均以?x ± s 表示,血药浓度–时间测定数据采用 DAS 3.0(北京博之音科技有限公司)药动程序,非房室模型拟合计算药动参数,包括清除率(CLz)、表观分布容积(Vz)、消除半衰期(t1/2),达峰时间(tmax)和峰浓度(Cmax)采用实测值,药时曲线下面积(AUC)采用统计矩法计算。药效参数最低葡萄糖浓度(Cmin)和达到最低浓度所需时间(tmin)采用实测值。生物利用度以 F 表示,F=AUC(0~t) Insulin R/AUC(0~t) Humulin R×100%,并采用双向单侧 t 检验、90%置信区间分析对两种制剂进行生物等效性评价。
2 结果
2.1 血糖测定结果
12 只健康 Beagle 犬交叉 sc 受试药 Insulin R 和对照药 Humulin R 后吸收迅速,药后 10 min 血糖水平已显着低于给药前水平(4.9/3.7 mmol/L vs 4.9/3.9mmol/L),随后血糖水平持续降低,并于 0.5~2 h达到谷值(1.9 mmol/L vs 1.8 mmol/L),2 h 后血糖水平逐步回升,于 5~6 h 恢复至给药前水平。两药平均血糖浓度–时间曲线的比较见图 1。【1】
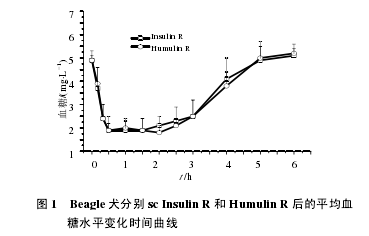
2.2 RIA 法测定血浆胰岛素浓度
2.2.1 标准曲线、线性范围和最低定量限 标准曲线是用药盒提供的胰岛素对照品溶液(Insulin,kit)、Insulin R 和 Humulin R 分别配制,其终浓度分别为3.125、6.25、12.5、25、50、100、200 μU/mL。按“Millipore 人胰岛素特异试剂盒测定原理及方法”项下测定各标准管的 cpm 值,每个浓度双复管。结果按机内程序选用自动二次拟合程序进行数据处理,绘制标准曲线。在 3.125~200 μU/mL 时,药物浓度对数与 B/B0呈 Logistic 线性相关。结果显示,胰岛素对照品、Insulin R 和 Humulin R 标准曲线基本平行。每批试验均制备各自标准曲线。Insulin R和 Humulin 平均标准曲线方程分别为:Y=6.806+87.515/[1+(X/30.755)1.301](n=16 条)和 Y=6.365+88.087/[1+(X/30.889)1.267](n=14 条)。本方法的最低定量限为标准曲线的最低浓度点,即3.125 μU/mL。
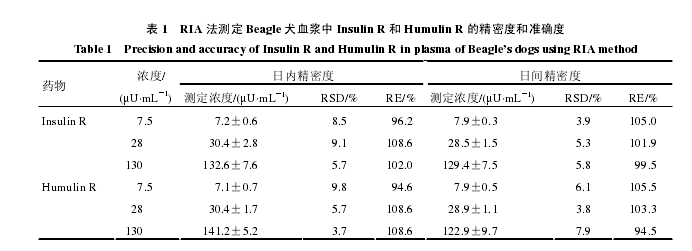
2.2.2 精密度和准确度试验 在标准曲线范围内用对照品稀释液将 Insulin R 和 Humulin R 稀释成低、中、高浓度(7.5、28、130 μU/mL),测定批内和批间的精密度和准确度,每个浓度重复测定 6 次。结果见表 1。【2-3】
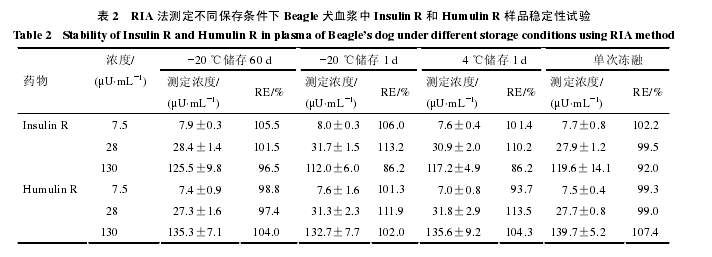
2.2.3 稳定性试验 分别配制 7.5、28、130 μU/mLInsulin R 和 Humulin R 质控样品,分别在?20 ℃储存 60 d、?20 ℃储存 1 d、4 ℃储存 1 d 和单次冻融4 种不同条件下保存,次日上午室温下解冻后立即测定,每个样本重复测定 4 次,见表 2。结果显示,在?20 ℃条件下,保存 60 d、1 d、或中途在 4 ℃下解冻 1 d 再冻存,以及在 4 ℃保存 1 d,各浓度样品的测定结果与?20℃条件下保存 1 d 样品的测定比较,差异均无显着性。2.2.4 稀释度试验 制备高浓度 Insulin R 和Humulin R 的犬血浆样品(400 μU/mL),用犬空白血浆倍比稀释,稀释度分别为 1∶4、1∶8、1∶16,稀释后样品用本方法测定。检测实测值与期望值间的关系,并计算期望指数(实测值/期望值×100%)。
Insulin R 和 Humulin R 期望指数分别在 94.0%~86.6%、108.5%~83.7%,结果表明当稀释度不大于1∶16 时,用犬空白血浆稀释样品对测定结果影响不大。
2.2.5 特异性试验 选择胰岛素原、胰高血糖素、生长抑素、促黄体生成素、卵泡刺激素 5 种多肽或蛋白类激素进行特异性试验。配制相当于 Insulin R和Humulin R标准曲线最高浓度的20、5、0.8倍(4.0、1.0、0.16 mU/mL)进行测定。结果显示,所测定的浓度值均低于本方法的最低定量限,表明上述被检蛋白对测定结果均不存在明显干扰。
2.3 RIA 法测定 Beagle 犬血浆 C 肽水平
2.3.1 标准曲线、线性范围和最低定量限 标准曲线是用药盒提供的犬 C 肽标准品,制备其终质量浓度为 0.172、0.344、0.688、1.375、2.75、5.5、11、22 ng/mL。按“Millipore 犬 C 肽试剂盒测定原理及方法”项下测定各标准管的 cpm 值,每个浓度双复管。结果按机内程序选用自动二次拟合程序进行数据处理,制得标准曲线。在此浓度范围(0.172~22ng/mL)时,药物浓度对数与 B/B0呈 Logistic 线性相关。每次试验均制备一条标准曲线,平均标准曲线方程为 Y=0.498+98.325/[1+(X/2.407)1.054]。本方法的最低定量限为标准曲线的最低浓度点,即0.172 ng/mL。
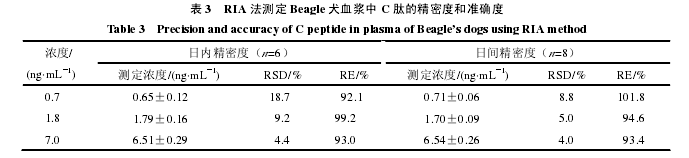
2.3.2 精密度和准确度试验 用标准品稀释液配制犬 C 肽浓度,即在标准曲线范围内选择低、中、高浓度(0.7、1.8、7.0 ng/mL),测定 C 肽批内和批间的精密度和准确度,每个浓度重复测定 6 次和 8 次。
结果 C 肽批内和批间的精密度分别为(10.8±7.3)%、(5.9±2.5)%,批内和批间的准确度分别为(94.8±3.8)%、(96.6±4.6)%,见表 3。【4】
2.3.3 稳定性试验 分别配制 0.7、1.8、7.0 ng/mL C肽质控样品,分别在?20 ℃储存 60 d、?20 ℃储存1 d、4 ℃储存 1 d 和单次冻融 4 种不同条件下保存,次日上午室温下解冻后立即测定,每个样本重复测定 4 次。结果显示,在?20 ℃条件下,保存 60、1 d、抑或中途在 4 ℃下解冻 1 d 再冻存,以及在 4℃保存 1 d,各浓度样品的测定结果与?20 ℃条件下保存 1 d 样品的测定比较,差异均无显着性。2.3.4 稀释度试验 由于 C 肽为 Beagle 犬血浆中的内源性物质,血浆浓度较低,无需进行稀释,因此未进行 C 肽稀释度的考察。
2.3.5 特异性试验 本试剂盒与犬 C 肽交叉率为100%,人 C 肽为 15%,人前胰岛素为 0%。
2.4 Beagle 犬血浆中 Insulin R、Humulin R 及犬 C肽水平测定
由于正常动物体内含有内源性胰岛素,测定Beagle 犬血浆 C 肽浓度以校正内源性胰岛素水平。
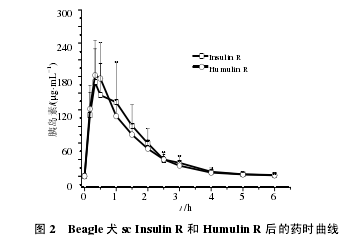
采用RIA法测定的各时间点胰岛素浓度减去相应时间点的 C 肽浓度后,得到校正后的胰岛素浓度,12只健康 Beagle 犬交叉 sc 受试药 Insulin R 和对照药Humulin R 后的平均药时曲线见图 2。
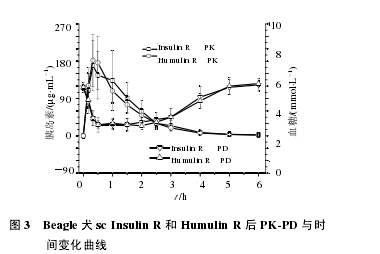
Beagle 犬分别 sc Insulin R 和 Humulin R 后,药物吸收较快,约在 0.5 h 到达峰浓度;在血药浓度升高的同时,伴随着血糖的降低,约在 1 h 时降至最低;随着血药浓度的降低,血糖水平也逐渐升高,药后 5 h 基本恢复到给药前的血糖基础水平,此时血药浓度仅维持在最高浓度的 1/50(个别动物已检测不到)。Insulin R 和 Humulin R 两者的变化趋势基本一致。见图 3。
2.5 药动学参数计算
将校正后的胰岛素浓度数据用 DAS 3.0 药动学计算程序进行数据处理,计算药动学参数,见表 4。
药时曲线下的残留面积 AUC6 h-∞占总面积 AUC0-∞比例的均值分别为(2.0±2.2)%、(1.3±0.8)%,符合小于 20%的要求,表明采样终点适宜,所得血药浓度及药动学参数均能反映这两种注射剂的动物体内代谢过程。【5-7】

2.6 Insulin R 与 Humulin R 的生物等效性检验
对 Insulin R 与 Humulin R 注射剂 3 个主要药动学参数 AUC0-6 h、AUC0-∞和 Cmax进行方差分析,结果显示 Insulin R 与 Humulin R 在药剂间、周期间和个体间差异均无显着性。并对 AUC0-6 h、AUC0-∞和Cmax进行双向单侧 t 检验和 90%置信区间分析,AUC0-6 h、AUC0-∞和 Cmax高侧和低侧 t 检验的等效性检验均合格(P<0.05),其 90%置信区间分别为93.8%~121.2%、94.9%~121.6%、83.5%~135%。
用非参数检验法(配对 Wilcoxon 检验)检验 tmax,Insulin R 与 Humulin R 的 tmax差异无显着性。该研究结果表明两种制剂具有生物等效性。
3 讨论
胰岛素是胰腺 β 细胞分泌合成的一种多肽类激素。其主要功能是通过调节细胞的葡萄糖摄取,糖原、脂肪合成及葡萄糖氧化等生化作用来调控血糖水平。胰岛素分泌进入血液循环主要受血糖水平的控制,但亦受其他因素影响,如神经、肠道激素和其他 β 细胞分泌激素。Millipore 生产的人胰岛素RIA 试剂盒,可用于测定人及犬血中的胰岛素。在进行血药浓度检测时,犬内源性胰岛素会干扰目标蛋白的测定结果。如何消除内源物质的干扰是研究胰岛素药动学的关键所在。由于胰岛素和 C 肽在体内是等分子分泌的,测定血浆中 C 肽水平可以校正内源性胰岛素的水平。本研究采用定量检测犬 C 肽试剂盒,与胰岛素同步检测血浆中犬 C 肽浓度以校正犬内源胰岛素对外源性胰岛素测定的影响。另外Beagle 犬给药 6 h 后统一进食,使基础胰岛素分泌相对较低和稳定,进而对药效学及药动学的影响相对较小。





