
射干合剂( SGHJ) 的临床疗效主要为宣肺清热,止咳祛痰平喘; 从目前已知的化学成分来分析,盐酸麻黄碱具有平喘功效,SGHJ 指纹图谱分析[1]可看到,SGHJ 的可测定化合物主要为盐酸麻黄碱和黄酮类化合物,本实验在多指标成分测定方法[2],动物血药浓度测定[3],SGHJ 多指标成分在体内回收率的基础上,采用给大鼠灌胃 SGHJ 并观察其主要指标成分盐酸麻黄碱在动物血清中 24h 浓度变化.目前,对 SGHJ 的临床疗效与指标成分浓度之间的研究还缺乏研究,本研究尝试在中药复方制剂的质量控制中引入指标成分的含量与临床疗效相关性的可能性; 为中药复方制剂的质量控制建立定量基础.
1 材料
1. 1 仪器与试剂
Agilent 6460 串联四极杆质谱,Agilent1200 高效液相色谱仪( 美国惠普公司) ; Labofuge 400R 高速离心机( 上海力新有限公司) ; XW-80 型旋涡混合器( 原上海医科大学仪器厂) ; Olympus BX50 光学显微镜( Olympus 公司) ; pHS-3TC 精密数显酸度计( 上海天达仪器有限公司) ; 电热恒温鼓风干燥箱( 上海跃进医疗器械厂) ; As3120B 超声波清洗器( 上海医用分析仪器厂) .
盐酸麻黄碱对照品 ( ephedrine hydrochloride,ED; 批号: 171241-201007; 含量: 99. 7% ) 、内标( IS)盐酸硫利达嗪对照品 ( thioridazine hydrochloride,TD; 批号: 100344-201002; 含量: 95. 2% ) 均购自中国食品药品检定研究院; 射干合剂 ( SGHJ,批号:111201,上海美优制药厂) ,规格: 100ml / 瓶; 甲醇、乙腈( 色谱纯,美国 Tedia 公司) ; 水为双蒸馏水,其余试剂均为分析纯; 全部溶剂均采用0. 22 μm微孔滤膜过滤.
1. 2 实验动物
清洁级 SD 大白鼠,体质量约( 250 ± 23) g,雄性; 实验前适应性饲养 3 d,动物房温度保持在 19 ~25℃ ,6: 00 ~ 18: 00 光照,18: 00 ~ 6: 00 黑暗交替.实验前12 h,动物禁食供水,由上海交通大学医学院附属新华医院实验动物中心提供,实验动物使用许可证号: SYXK ( 沪) : 2008-0052; 生产许可证号:SCXK( 沪) 2004-0001; 空白血清、尿液、粪便均采自未服用目标物的动物.
2 方法与结果
2. 1 样品测定及方法学考察
2. 1. 1 色 谱条件 分 析 柱: Capcell C18MGIII[2. 0 mm ×100 mm,5 μm,资生堂( 中国) 投资有限公司]; 流动相 A: 水,流动相 B: 乙腈,二元线性梯度洗脱[0 ~ 0. 5 min,A: B( 95%: 5%) ; 0. 5 ~ 5 min,A: B( 10% : 90% ) ; 5 ~ 6. 5 min,A: B ( 95% : 5% ) ,6. 5 ~ 10 min,A: B ( 95% : 5% ) ]; 流 速: 0. 3 ml ·min- 1; 进样体积 5 μl.
2. 1. 2 质谱条件 电喷雾离子源,正离子扫描; 雾化气: 50 kPa,气帘气: 20 kPa,碰撞气: 48 kPa,离子源电压: 4 500 V,离子源温度: 500℃,为正离子多离子反应监测( MRM) 扫描方式.在上述色谱、质谱条件下,通过质谱参数优化,分别得到 ED 和 IS( TD)的离子选择通道分别为 m/z 166. 2 →148. 2、m/z371. 2→126. 2.见图 1.
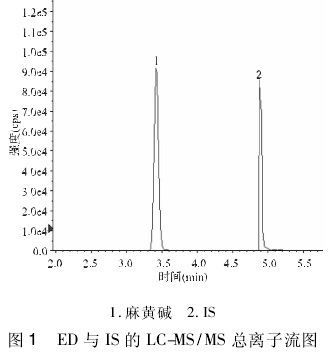
2. 2 标准溶液的配制
分别精密配制 ED、IS 标准品配制质量浓度为0. 1 mg·ml- 1的标准储备液,储存于 -20℃备用; 各对照品的工作液浓度: 0. 1 μg·ml- 1.
2. 3 空白血清及含药血清样品的预处理
2. 3. 1 血清的预处理 取大鼠空白、含药全血0. 3 ml在 3 000 r·min- 1条件下离心 10 min,取 45μl 上层血清,加 IS 5 μl 混匀,加甲醇 150 μl,旋涡振荡,离心3 000 r·min- 1,上清液10 μl 加50 μl 水稀释,涡旋混合 3 min,取 5 μl 进样.
2. 3. 2 尿液 取空白、给药尿样,用甲醇稀释 10 倍体积,离心,然后取 IS 10 μl( 0. 1μg·ml- 1) ,加 10μl 稀释尿液,再加水 80 μl,混匀,取 5 μl 进样.
2. 3. 3 粪便 称取空白、粪样约0. 1 g,加 1 ml 甲醇,超声处理( 500 W,40 kHz) 30 min,离心,然后取100 μl 内标( 0. 1 μg·ml- 1) ,加稀释液5 μl,再加水895 μl,混匀,进样,最终浓度相当于稀释 200 倍.
2. 4 实验方案将 8 只大鼠分为两组,6 只为试验组,2 只为对照组; 对照组大鼠禁食供水 12 h,分别灌胃蒸馏水1. 0 ml /100 g; 实验组大鼠禁食供水 12 h,分别灌胃SGHJ 1. 0 ml /100 g,大鼠分别放入代谢笼中,分别在给药后不同的时间静脉采血0. 3 ml; 两组大鼠均在给药前和给药后0. 5,1. 0,1. 5,2. 0,4. 0,6. 0,8. 0,12. 0,18. 0,24. 0 h经大鼠眼球后静脉丛采集静脉血0. 3 ml,收集于普管中,4 000 r·min- 1离心 10 min,分离血清; 按"2. 3"项下方法处理后,保存于 -20℃待测; 两组大鼠均在给药前和给药后 1,2,4,6,8,10,12,14,18,24 h 收集尿液,按"2. 3. 2"项下方法处理尿液; 在 4,8,12,16,20,24 h 收集粪便,按"2. 3. 3"项下方法处理粪便.
2. 5 SGHJ 中 ED 的含量测定
取 SGHJ 1 ml 加甲醇至 10 ml,混匀,离心,取上清液 100 μl,用双蒸馏水稀释至 1 ml,混匀,然后取10 μl IS( 0. 1 μg·ml- 1) ,加稀释液 10 μl,再加 80μl 水,混匀,0. 22 μm滤膜过滤,进样体积 5 μl; 将测定值代入各自标准曲线,得到 SGHJ 中 ED 的含量为375. 00 μg·ml- 1.
2. 6 方法学考察
2. 6. 1 标准曲线制备 分别取空白血浆、尿液、粪便加入不同浓度的 ED,按"2. 3"项下方法处理后,进样,其标准曲线的回归方程 Y = 9. 536 × 10- 3+5. 253 × 10- 3X,r = 0. 998 9,线性范围: 0. 05 ~ 50. 00μg·ml- 1,最低检测限为0. 05 ng·ml- 1.
2. 6. 2 方法的专属性 空白血清、尿液、粪便中无ED 和 IS 峰出现,证明空白样品不干扰本方法的测定.
2. 6. 3 方法的精密度与准确度 用空白血清、尿液、粪便配制 ED 加 IS 高、中、低 3 个浓度( 0. 05、5. 00、25. 00 mg·L- 1) 的质量控制样品,每一浓度进行 6 样本分析,连续测定 3 d,结果表明 ED 的日间和日内精密度≤7. 6%,准确度在≤5. 4%.
2. 6. 4 提取回收率 同"2. 6. 3"项下操作,用空白血清、尿液、粪便配制 ED 加 IS 高、中、低 3 个浓度( 0. 05,5. 00,25. 00 mg·L- 1) ,同时用水配制相应浓度的回收率 100%样品.每一浓度均进行 5 样本分析,按样品与水中相应物质面积比得到计算回收率在0. 05 mg·L- 1浓度时平均回收率为( 94. 2 ±2. 1) % ,在 5. 00 mg · L- 1浓度时平均回收率为( 93. 4 ±3. 2) %,在25. 00 mg·L- 1浓度时平均回收率为( 95. 3 ±4. 1) %.
2. 6. 5 样品的稳定性考察 取空白血清、尿液、粪便,同"2. 6. 3"项下操作,配制 ED 加 IS 高、中、低 3个浓度的质量控制样品( 0. 05,5. 00,25. 00 mg·L- 1) ,考察稳定性,每一稳定性考察进行 6 样本分析.结果表明 ED 血清样品经历 3 次冷冻、解冻循环后室温放置 24 h,3 个浓度样品均稳定( RSD≤4. 5% ) .
2. 7 大鼠血中 ED 浓度变化按"2. 4"项下实验方案,给实验组大鼠灌胃SGHJ 1 ml /100 g,在给药后不同时间静脉采血0. 3 ml,按"2. 3"项下方法处理后,检测大鼠血清样品中 ED 含量.以采血时间为横坐标,ED 血浓度为纵坐标绘制药时曲线,灌胃给药后药时曲线见图 2.
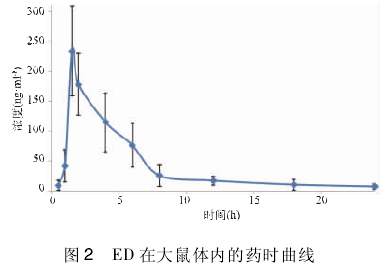
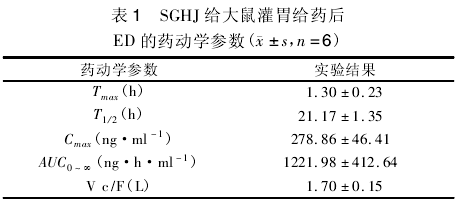
应用《药代动力学参数计算及其临床应用》统计软件程序( PK-Graph) ,分别对上述血药浓度测定数据进行拟合并计算其药物代谢动力学参数,结果见表 1.
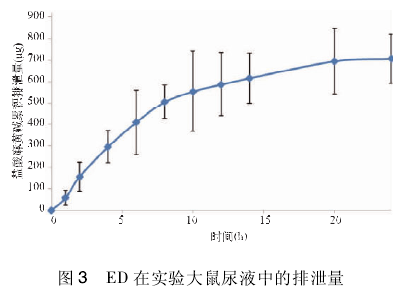
2. 8 大鼠尿液及粪便中 ED 浓度变化
按"2. 4"实验方案,测得 ED 大鼠在尿中 24 h可基本排泄完,结果见图 3.粪便中未能测定 ED.
3 讨论
中药的活性成分研究方法目前有血清药物化学法[4],活细胞萃取技术[5],代谢组学[6],本文对SGHJ 采用灌胃方法,测定可入血活性成分,通过实验证明 ED 可被大鼠吸收进入血液,且 ED 在吸收进入体内 24 h 基本从尿中回收,粪便中不能测得.这一现象说明: ①ED 在体内基本不经过肝胆循环; ②ED 在体内很少蓄积,很快排出体外,与文献报道一致[7,8],且与文献报道人体在服用麻黄碱后 24 h 检测到麻黄生物碱量基本相符[7 ~9],说明在服药 24 h后大部分麻黄生物碱随尿排出.
本实验 ED 的达峰时间为1. 33 h,文献[7]为 2h,文献[8]为0. 66 h,可能与复方中药成分影响麻黄碱的药动学参数有关[10],还需进一步证实.对 ED尿中 24 h 排泄率不同的文献[7 ~9]报道也有区别,但影响不大.
参 考 文 献.
1 唐跃年,金梁,张青,等. 射干合剂的 HPLC-UV 指纹图谱分析[J]. 中国临床药学杂志,2012,21( 5) : 283-286
2 唐跃年,金梁,张青. HPLC 法测定射干合剂中多指标成分的含量[J]. 中国临床药学杂志,2010,19( 4) : 233-336
3 唐跃年,陈婷,魏昕,等. LC-MS / MS 法测定动物血清中射干合剂多指标成分的浓度[J]. 中国药师,2013,16( 2) : 190-193
4 常存库,王喜军. 中药血清药物化学理论与方法的意义[J]. 世界科学技术---中医药现代化,2010,12( 4) : 635-637
5 董倩倩,李萍,闻晓东. 丹参成分在 Caco-2 细胞中吸收的研究[J]. 中国天然药物,2007,5( 1) : 59-62
6 王喜军. 基于药物代谢组学的中药及方剂中组分间协同增效作用[J]. 中国天然药物,2009 ,( 7) 2: 90-94
7 贺丰,罗佳波,陈飞龙,等. GC-MS 法研究麻黄汤中麻黄碱、伪麻黄碱的人体内过程[J]. 中药新药与临床药理,2004,15( 5) : 336-347
8 龙锐. 小青龙颗粒中麻黄碱_伪麻黄碱在大鼠体内的药动学及药效学研究[D]. 北京: 北京中医药大学硕士学位论文,2008
9 陈燕,朱全红,罗佳波,等. 麻黄汤中麻黄生物碱在人尿中的排泄研究[J]. 中国实验方剂学杂志,2007,13( 11) : 55-60
10 沈群. 麻黄汤不同配伍对麻黄碱和伪麻黄碱在小鼠体内药代动力学的影响[D]. 广州: 第一军医大学硕士学位论文,2002





