摘 要: 目的 探讨依托泊苷对pristane诱导的弥漫性肺泡出血(diffuse alveolar hemorrhage, DAH)小鼠肺组织细胞凋亡的影响。方法 24只小鼠随机分为对照组、模型组和依托泊苷组,每组8只。模型组和依托泊苷组腹腔单次注射0.5 mL pristane制备DAH模型,对照组给予等量PBS。造模成功后,依托泊苷组腹腔注射10 mg/kg依托泊苷,对照组和模型组腹腔注射等量PBS,均1次/d,连续14 d。14 d后,取3组小鼠肺组织进行组织病理检查,HE染色观察小鼠肺组织出血情况和炎症细胞浸润情况,采用TUNEL染色试剂盒检测3组小鼠肺组织细胞凋亡率,采用Western blot法检测3组小鼠肺组织caspase-3、Bax、Bcl-2蛋白相对表达量。结果 对照组小鼠肺组织大体呈正常粉红色,模型组为暗红色,依托泊苷组可见散在出血点。对照组小鼠肺泡结构完好,肺泡腔清晰,肺组织炎症细胞浸润不明显;模型组小鼠肺泡腔出现大量红细胞,伴大量中性粒细胞、巨噬细胞等炎症细胞浸润;依托泊苷组肺泡腔无明显红细胞,肺泡壁增厚。模型组小鼠肺组织细胞凋亡率[(7.87±0.79)%]及Bax、caspase-3蛋白相对表达量(0.87±0.01、2.11±0.17)高于对照组[(0.78±0.13)%、0.24±0.02、0.19±0.01]和依托泊苷组[(1.49±0.24)%、0.32±0.01、0.83±0.06](P<0.05),依托泊苷组高于对照组(P<0.05);模型组小鼠Bcl-2蛋白相对表达量(0.75±0.07)低于对照组(2.86±0.19)和依托泊苷组(5.62±0.21)(P<0.05),依托泊苷组高于对照组(P<0.05)。结论 依托泊苷对DAH小鼠有治疗作用,可明显改善小鼠肺组织肺泡出血和炎症细胞浸润,降低肺组织细胞凋亡率,其机制可能与调节Bax、Bcl-2和caspase-3蛋白表达有关。
关键词: 弥漫性肺泡出血; 依托泊苷; 细胞凋亡; 小鼠;
Abstract: Objective To investigate the effect of etoposide on lung tissue cells apoptosis in mice with diffuse alveolar hemorrhage induced by pristane. Methods Twenty-four mice were randomly pided into control group, model group and etoposide group, with 8 mice in each group. The mice in model group and etoposide group were given a single intraperitoneal injection of 0.5 mL of pristane to prepare DAH models, and the mice in control group were given the same amount of PBS buffer. After successful modeling, the mice in etoposide group were intraperitoneally injected with 10 mg/kg etoposide, and the mice in control group and model group were given the same amount of PBS buffer, once a day for 14 consecutive days. After 14 days, the lung tissues were obtained for histopathological examination. HE staining was used to observe the hemorrhage and inflammatory cell infiltration in the lung tissues, TUNEL staining kit was used to detect the apoptosis rate, and Western blot method was used to detect the relative expressions of caspase-3, Bax and Bcl-2 proteins in the lung tissues of three groups. Results The lung tissues were generally in normal pink in control group, were in dark red in model group, and were found scattered bleeding points in etoposide group. The mice in control group had intact alveolar structure, clear alveolar cavity, and unobvious infiltration of inflammatory cells in the lung tissues. The mice in model group had a large number of red blood cells in the alveolar cavity, accompanied by a large number of neutrophils, macrophages and other inflammatory cells infiltration. The mice in etoposide group had no obvious red blood cells in the alveolar cavity, and the alveolar walls were thickened. The apoptosis rate of lung cells and the relative expressions of Bax and caspase-3 proteins were higher in model group((7.87±0.79)%, 0.87±0.01, 2.11±0.17) than those in control group((0.78±0.13)%, 0.24±0.02, 0.19±0.01) and etoposide group((1.49±0.24)%, 0.32±0.01, 0.83±0.06)(P<0.05), and higher in etoposide group than those in control group(P<0.05). The relative expression of Bcl-2 protein was lower in model group(0.75±0.07) than that in control group(2.86±0.19) and etoposide group(5.62±0.21)(P<0.05),and lower in etoposide group than that in control group(P<0.05).Conclusion Etoposide has a therapeutic effect on DAH mice.It can significantly alliviate alveolar hemorrhage and inflammatory cell infiltration in the lung tissues of mice,and reduce the apoptosis rate of the lung cells.The mechanism might be correlated with regulating the expressions of Bax,Bcl-2 and caspase-3 proteins.
Keyword: diffuse alveolar hemorrhage; etoposide; apoptosis; mice;
弥漫性肺泡出血(diffuse alveolar hemorrhage, DAH)是一种以咯血、缺铁性贫血和弥漫性肺泡浸润为特征的临床综合征[1],多种自身免疫性疾病均可引起DAH,系统性红斑狼疮引起的占多数[2]。系统性红斑狼疮并发DAH虽较罕见,但病死率较高,为50%~70%[3,4,5]。DAH在临床中常用皮质类固醇缓解,联合采用血浆置换免疫吸附疗法,约50%患者复发,需采用皮质类固醇联合免疫抑制剂维持[6]。依托泊苷临床用于巨噬细胞活化综合征[7]和噬血细胞综合征[8]的治疗,未在自身免疫疾病中应用。采用pristane诱导C57BL/6小鼠发生狼疮DAH模型,肺毛细血管炎症在形态上与人系统性红斑狼疮相关的DAH相似[9]。本研究探讨DAH的可能机制及依托泊苷对DAH小鼠的抗凋亡作用,报道如下。
1、 材料与方法
1.1、 一般材料
清洁的雌性C57BL/6小鼠24只,8~12周龄,体质量18~20 g, 购自北京维通利华实验动物技术有限公司[动物实验许可证号:SCXK(京)2020-0004]。将小鼠饲养于郑州大学生命科学院SPF级别的动物房中,室温(23.0±0.5)℃,昼夜节律12 h, 小鼠可自由获取清洁的水和食物,适应性喂养1周后进行实验。24只小鼠随机分为对照组、模型组和依托泊苷组,每组8只。本研究经郑州大学人民医院动物实验伦理委员会审核批准(伦理批准号:2019178)。
1.2 、方法
1.2.1 、主要试剂
依托泊苷(索莱宝生物科技有限公司),pristane(美国Sigma公司),BCA蛋白浓度测定试剂盒、TUNEL试剂盒(上海碧云天生物技术有限公司),兔抗鼠Bax、Bcl-2、caspase-3一抗及二抗(美国Abcam公司)。
1.2.2、 小鼠DAH模型建立及实验方法
模型组和依托泊苷组小鼠腹腔单次注射0.5 mL pristane建立DAH模型,对照组给予等量PBS。造模成功后,依托泊苷组小鼠腹腔注射10 mg/kg依托泊苷,对照组和模型组小鼠腹腔注射等量PBS,均1次/d, 连续14 d。
1.2.3、 标本采集与小鼠肺组织病理检查
药物干预14 d后,小鼠实施安乐死取肺组织。左肺组织固定于体积分数4%多聚甲醛中固定48 h, 常规石蜡包埋,切成3.5 μm切片。将切片依次放入二甲苯和梯度乙醇,冲洗后,苏木精染色5 min, 体积分数5%乙酸分化1 min, 伊红染色1 min, 梯度乙醇中脱水,晾干,滴上中性树胶封片,显微镜下观察肺组织形态,采集图像。
1.2.4 、TUNEL法检测小鼠肺组织细胞凋亡率
石蜡包埋的小鼠肺组织切片在二甲苯、无水乙醇、乙醇中进行脱蜡脱水,滴加蛋白酶K 37 ℃孵育25 min, PBS液摇洗3次,破膜液破膜后洗涤,加入TUNEL试剂盒内试剂1(TdT)、试剂2(dUTP)和试剂3(buffer)按1:5:50混合,37 ℃孵育2 h后PBS洗涤3次,滴加DAPI染液,避光室温孵育10 min。采用抗荧光淬灭封片剂封片,于荧光显微镜下观察并采集图像,应用Halo v3.0.311.314软件分析各组细胞凋亡图像。计算细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.5、 Western blot法检测凋亡相关蛋白相对表达量
取右肺组织20 mg剪碎,加入200 μL RIPA匀浆,冰上裂解30 min, 4 ℃,12 000×g离心20 min, 取上清,采用BCA法检测蛋白浓度,取30 μg蛋白样品SDS-PAGE电泳,电转至PVDF膜,质量分数5%脱脂牛奶封闭1 h, 分别加入一抗β-actin(1:1 000)、Bax(1:1 000)、Bcl-2(1:1 000)、caspase-3(1:1 000),4 ℃过夜,TBST洗3次,加入二抗抗兔IgG-HRP(1:1 000),常温孵育1 h, TBST洗3次,使用ECL显色试剂盒显示蛋白条带并应用Image J软件处理并拍照,采用Gel-Pro Application进行分析,以β-actin为内参,计算Bax、Bcl-2、caspase-3蛋白相对表达量。实验重复3次。
1.3 、统计学处理
应用SPSS 24.0软件进行统计分析,计量资料以均数±标准差(x?±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD检验;检验水准α=0.05。
2 、结 果
2.1、 3组小鼠组织病理检查结果
(1)大体:对照组小鼠肺组织无出血点,呈正常粉红色;模型组小鼠肺组织呈暗红色;依托泊苷组小鼠肺组织可见出血情况较模型组明显改善,呈少量出血点。见图1。(2)镜下:对照组小鼠肺组织肺泡结构清晰,肺泡壁光滑,肺组织炎症细胞浸润不明显;模型组小鼠肺组织结构异常,肺泡腔有大量红细胞浸润,间质可见大量中性粒细胞、巨噬细胞等炎症细胞浸润;与模型组比较,依托泊苷组小鼠肺组织出血明显减少,间质中炎症细胞浸润减少,肺泡壁增厚。见图2。
图1 3组小鼠肺组织大体观察图
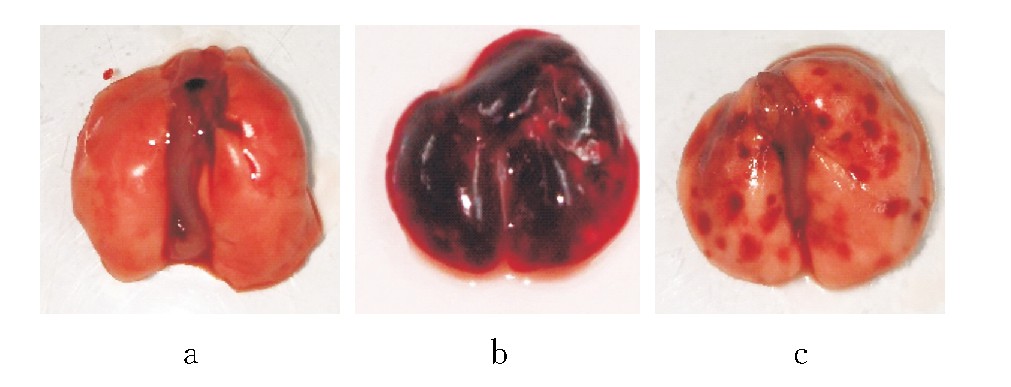
注:a为对照组,可见正常肺组织,呈淡粉色;b为模型组,可见严重出血肺组织;c为依托泊苷组,可见肺组织散在出血点。
图2 3组小鼠肺组织病理图(HE染色,×400)
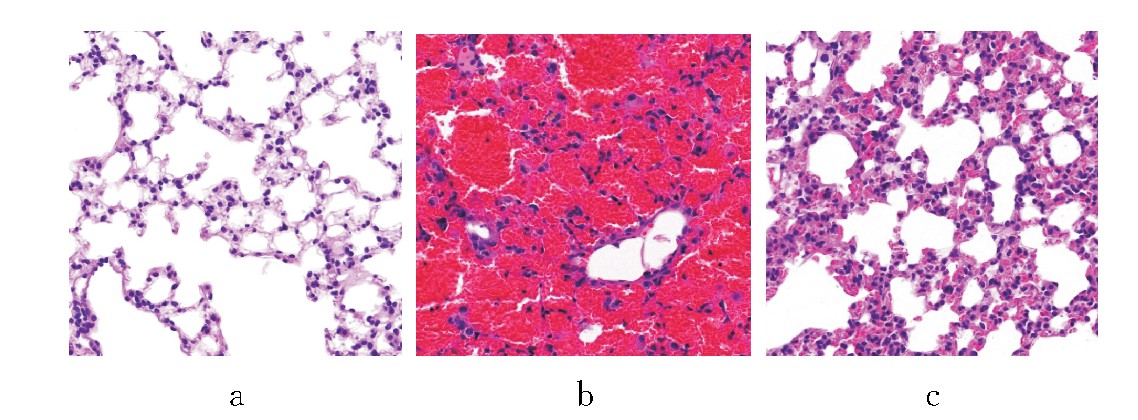
注:a为对照组,可见肺泡结构清晰;b为模型组,可见肺泡中大量红细胞,间质中大量炎症细胞浸润;c为依托泊苷组,可见肺泡壁增厚,间质中炎症细胞浸润较少。
2.2 、3组小鼠肺组织细胞凋亡率比较
3组小鼠肺组织细胞凋亡率比较差异有统计学意义(F=184.6,P=0.001)。模型组小鼠肺组织细胞凋亡率[(7.87±0.79)%]高于对照组[(0.78±0.13)%]和依托泊苷组[(1.49±0.24)%](P<0.05),依托泊苷组高于对照组(P<0.05)。见图3。
图3 3组小鼠肺组织细胞TUNEL染色图(TUNEL染色,×100)
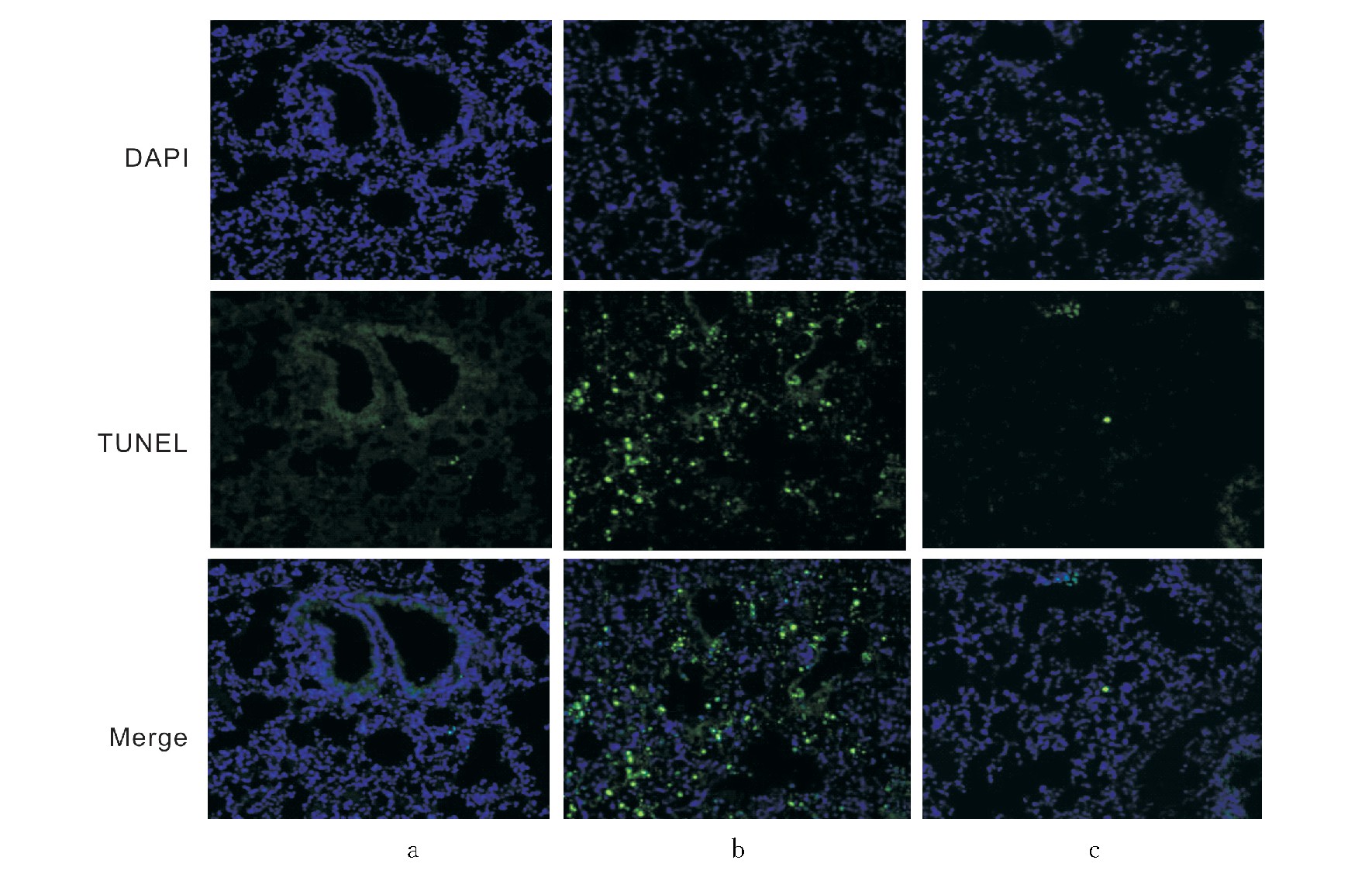
注:a为对照组,无凋亡细胞;b为模型组,可见大量凋亡细胞;c为依托泊苷组,可见少量凋亡细胞。绿色荧光为凋亡细胞。
2.3、 3组小鼠肺组织Bcl-2、Bax、caspase-3蛋白相对表达量比较
3组小鼠肺组织Bcl-2、Bax、caspase-3蛋白相对表达量比较差异有统计学意义(P<0.05)。模型组小鼠肺组织Bax、caspase-3蛋白相对表达量高于对照组和依托泊苷组(P<0.05),Bcl-2蛋白相对表达量低于对照组和依托泊苷组(P<0.05)。依托泊苷组小鼠肺组织Bax、caspase-3和Bcl-2蛋白相对表达量高于对照组(P<0.05)。见表1及图4。
表1 3组小鼠肺组织Bax、Bcl-2、caspase-3蛋白 相对表达量比较
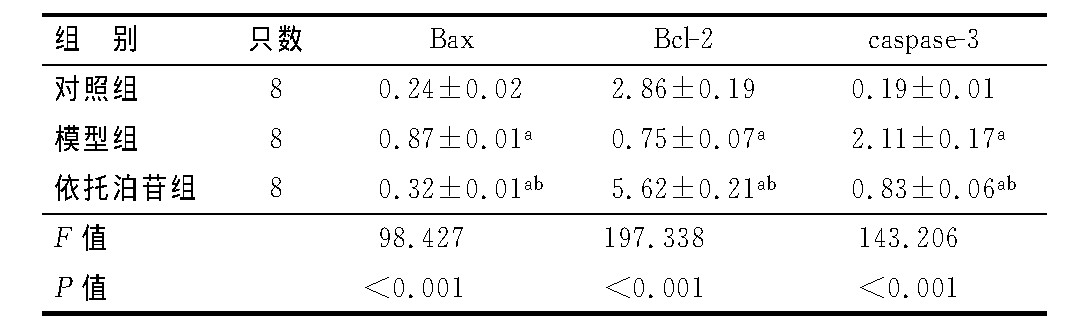
注:a与对照组比较,P<0.05;b与模型组比较,P<0.05。
图4 3组小鼠肺组织Bax、Bcl-2、caspase-3蛋白表达Western blot图
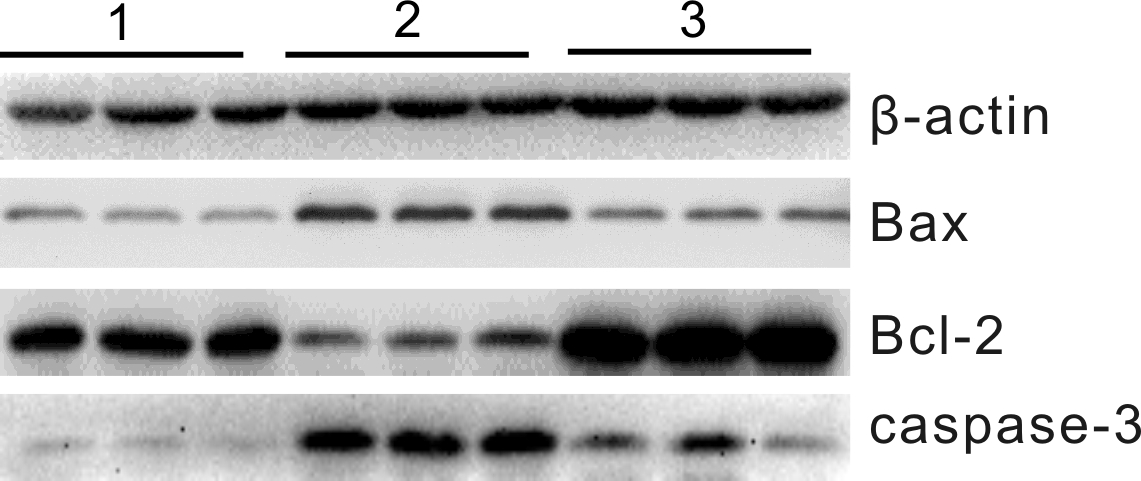
注:1为对照组;2为模型组;3为依托泊苷组。
3 、讨 论
DAH是系统性红斑狼疮罕见但致命的并发症,主要表现为咯血,伴不同程度的呼吸困难,广泛肺内出血及炎症细胞浸润[10],其发病机制目前尚未阐明。pristane可在啮齿动物中诱发狼疮,与人类疾病中系统性红斑狼疮具有共同的临床和病理特征,在C57BL/6小鼠中给予pristane可诱导DAH的动物模型[4]。本研究结果显示,模型组小鼠肺组织大面积出血,肺泡腔中大量红细胞渗出,伴有大量炎症细胞渗出,而对照组无红细胞,炎症细胞浸润不明显;提示DAH模型建造成功。
凋亡可能是DAH的始动环节[11]。由pristane诱导的凋亡细胞最初可产生自身免疫性底物,引起免疫耐受破坏,巨噬细胞清除不足,导致自身免疫疾病的发展,巨噬细胞浸润和细胞凋亡可能是引发DAH的关键因素[12]。本研究结果显示,模型组小鼠肺组织细胞凋亡率高于对照组和依托泊苷组,依托泊苷组高于对照组;说明模型组小鼠肺组织凋亡细胞明显增多,伴有严重肺组织损伤和肺部出血,而依托泊苷组凋亡细胞减少,肺部损伤和出血明显改善;提示抑制细胞凋亡可从始动环节抑制DAH进展,改善肺部损伤,为从抑制凋亡途径治疗自身免疫病提供新途径。pristane可通过激活caspase途径抑制细胞生长,诱导细胞凋亡[13],可通过线粒体途径诱导细胞凋亡,Fas参与其中。Bcl-2是主要的凋亡抑制因子,通过维持线粒体外膜的完整性,抑制线粒体凋亡途径的启动[14]。Bax是Bcl-2的同源基因,其高表达可促进细胞凋亡,加速DAH中肺组织损伤。Bcl-2可与Bax竞争性结合,抑制Bax活化,从而有效抑制细胞凋亡[15]。凋亡因子caspase-3参与细胞的生长、分化和凋亡,其表达上调可促进肺组织病变的发生和发展[16]。caspase-3是内源性凋亡途径和外源性凋亡途径的共同执行蛋白,caspase-3表达增强可作为启动凋亡的重要标志[17]。本研究结果显示,模型组肺组织Bax、caspase-3蛋白相对表达量高于对照组和依托泊苷组,Bcl-2蛋白相对表达量低于对照组和依托泊苷组;依托泊苷组小鼠肺组织Bax、caspase-3、Bcl-2蛋白相对表达量高于对照组;说明采用依托泊苷治疗的DAH小鼠肺组织Bax、caspase-3蛋白表达降低,Bcl-2表达增高;提示依托泊苷可通过促进线粒体诱导的凋亡途径中抑制凋亡因子Bcl-2表达减轻细胞凋亡,通过降低caspase-3表达抑制凋亡的启动,从而减轻肺损伤。
本研究结果显示,依托泊苷对DAH有明显治疗效果,其机制可能是调节Bax、Bcl-2、caspase-3蛋白表达,从而减轻肺组织细胞凋亡。DAH属自身免疫性疾病,在临床中多采用激素和免疫抑制剂进行治疗,仅部分有效,停药后易复发,无特效治疗方法。依托泊苷在DAH小鼠模型中的疗效可为临床DAH治疗提供新的方向,也可能扩宽依托泊苷在临床中的应用。
参考文献
[1] MITTOO S,FELL C D.Pulmonary manifestations of systemic lupus erythematosus[J].Semin Respir Crit Care Med,2014,35(2):249-254.
[2] PROST N D,PARROT A,CUQUEMELLE E,et al.Diffuse alveolar hemorrhage in immunocompetent patients:etiologies and prognosis revisited[J].Respir Med,2012,106(7):1021-1032.
[3] SANTOS-OCAMPO A S,MANDELL B F,FESSLER B J.Alveolar hemorrhage in systemic lupus erythematosus:presentation and management[J].Chest,2000,118(4):1083-1090.
[4] BARKER T T,LEE P Y,KELLY-SCUMPIA K M,et al.Pathogenic role of B cells in the development of diffuse alveolar hemorrhage induced by pristane[J].Lab Invest,2011,91(10):1540-1550.
[5] SMITH S,WU P W,SEO J J,et al.IL-16/miR-125a axis controls neutrophil recruitment in pristane-induced lung inflammation[J].JCI Insight,2018,3(15):e120798.
[6] STOOTS S A,LIEF L,ERKAN D.Clinical insights into diffuse alveolar hemorrhage in antiphospholipid syndrome[J].Curr Rheumatol Rep,2019,21(10):56.
[7] SEFSAFI Z,HASBAOUI B E,KILI A,et al.Macrophage activation syndrome associated with griscelli syndrome type 2:case report and review of literature[J].Pan Afr Med J,2018,29:75.
[8] KOBAYASHI R,TANAKA J,HASHINO S,et al.Etoposide-containing conditioning regimen reduces the occurrence of hemophagocytic lymphohistiocytosis after SCT[J].Bone Marrow Transplant,2014,49(2):254-257.
[9] CHOWDHARY V R,GRANDE J P,LUTHRA H S,et al.Characterization of haemorrhagic pulmonary capillaritis:another manifestation of pristane-induced lupus[J].Rheumatology (Oxford),2007,46(9):1405-1410.
[10] 张伟,包慎,马燕萍,等.急性早幼粒细胞白血病并发弥漫性出血性肺泡炎1例并文献复习[J].白血病·淋巴瘤,2020,29(4):246-249.
[11] ZHUANG H,HAN S,LEE P Y,et al.Pathogenesis of diffuse alveolar hemorrhage in murine lupus[J].Arthritis Rheumatol,2017,69(6):1280-1293.
[12] GAIPL U S,VOLL R E,SHERIFF A,et al.Impaired clearance of dying cells in systemic lupus erythematosus[J].Autoimmun Rev,2005,4(4):189-194.
[13] MARCHETTI F,PEARSON F S,BISHOP J B,et al.Etoposide induces chromosomal abnormalities in mouse spermatocytes and stem cell spermatogonia[J].Hum Reprod,2006,21(4):888-895.
[14] ROY M J,VOM A,CZABOTAR P E,et al.Cell death and the mitochondria:therapeutic targeting of the Bcl-2 family-driven pathway[J].Br J Pharmacol,2014,171(8):1973-1987.
[15] WANG H Q,NAKAYA Y,DU Z,et al.Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2[J].Hum Mol Genet,2005,14(13):1889-1902.
[16] 田香,邓德传,邓群艳.右美托咪啶对重症脓毒症患者炎性因子和凋亡因子及自噬相关蛋白的影响[J].中华实用诊断与治疗杂志,2019,33(11):1120-1123.
[17] 于丽芳,周大亮,耿硕,等.曲美他嗪对心肌缺血再灌注损伤后大鼠Bcl-2及caspase-3蛋白表达影响[J].中华实用诊断与治疗杂志,2015,29(9):855-857,861.





