
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是当今威胁早产儿生存质量和远期预后的主要疾病之一.内质网应激(endoplasmic reticulum stress,ERS)作为介导细胞适应性生存和凋亡的双刃剑,已被证实在阻塞性肺疾病、间质性肺疾病、肺癌等多种肺部疾病的发病过程中发挥重要作用[1 -3],但迄今为止有关其在 BPD 发生发展中的作用研究报道甚少.葡萄糖调节蛋白 78(glucose regulated protein 78,GRP78)是 ERS 的标志蛋白,它的生理意义在于应激状态下大量表达,在 ERS 早期可维持内质网稳定,减少细胞凋亡发生.鉴于细胞传代稳定性的要求,本研究选用具有相似生物学特性的 A549 细胞代替肺泡上皮细胞,应用高浓度氧建立 A549 细胞凋亡模型,通过转染小干扰 RNA (small interfering RNA,siRNA) 片段特异性沉默内质网应激相关因子 GRP78的表达,观察 GRP78 在上皮细胞凋亡中的作用及可能机制,为进一步研究 GRP78 在 BPD 中的调控作用奠定基础.
1 材料和方法
1. 1 材料 A549 人肺腺癌细胞为江苏大学附属医院中心实验室细胞库保存.DMEM 培养基购自 Gibco 公司; Opti-MEM低血清培养基、脂质体 LipofectamineTM2000 转染试剂、逆转录试剂盒、TRIzol 均购自 Invitrogen 公司; Real-time PCR 试剂盒购自 TaKaRa 公司; 兔抗大鼠 GRP78 多克隆抗体、兔抗大鼠C / EBP同源蛋白(C / EBP homology protein,CHOP) 多克隆抗体、兔抗β-actin 抗体、辣根过氧化物酶(horseradish peroxidase,HRP) 标记的山羊抗兔 IgG 均购自 Abcam 公司; BCA 试剂盒购自碧云天公司; ECL 试剂盒购自 Pierce 公司; annexinV-FITC / PI细胞凋亡检测试剂盒购自 BD 公司.CYS-1 数字式测氧仪为上海嘉定学联仪表厂产品.
1. 2 方法
1. 2. 1 siRNA 转染 根据预实验筛选出转染效率最高的GRP78-siRNA 靶序列如下: 正义链 5'-AAGAUCACAAUCAC-CAAUGACTT-3', 反 义 链 5'-GUCAUUGGUGAUUGUGAUCU-UTT-3',阴性对照 siRNA ( scramble siRNA ) 序列: 正义链5'-AAAUCAUAGCGUAUGGUGCUGTT-3',反义链 5'-CAGCAC-CAUACGCUAUGAUUUTT-3'( 上海吉玛制药技术有限公司) .按试剂说明书操作,选用50 nmol/L siRNA、5 μL LipofectamineTM2000 为每孔细胞的转染剂量,二者分别用 2 mL 无血清 DMEM稀释,在30 min 内将已稀释的 siRNA 和 LipofectamineTM2000 混匀,室温 20 min,转染前 24 h 在6 孔板中接种 A549 细胞,加入不含抗生素的适量 DMEM 培养液,细胞达到 60% ~70%汇合度时进行转染.转染后在 37℃ 培养箱中培养 8 h,吸除无血清混合液培养基,换入 DMEM 培养基培养 48 h.
1. 2. 2 细胞模型建立及分组 实验分为高氧空白组、阴性对照(阴性 siRNA)组和实验(GRP78-siRNA)组 3 组,将各组细胞接种于培养瓶内生长.当细胞达到 90% 汇合度时,给予50 mL / L CO2(5 L/min)10 min,然后迅速用封口胶密封培养瓶,置于 37℃、50 mL/L CO2培养箱中培养.给氧 48 h 后收获各组细胞,用 CYS-1 数字式测氧仪检测各培养瓶中氧浓度,将氧浓度低于 900 mL/L 的样本弃去.A549 细胞 24 h 后更换培养液1 次,换液后重复上述操作给氧.
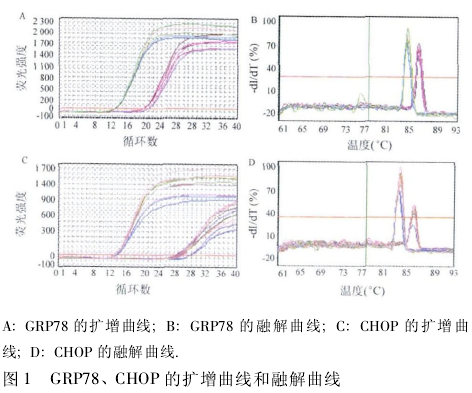
1. 2. 3 GRP78 和 CHOP mRNA 表达水平检测 采用实时定量 PCR,按 TRIzol 试剂一步法提取细胞总 RNA,用DNA/RNA测定仪检测 RNA 浓度和纯度,按 M-MLV 逆转录试剂盒说明书合成 cDNA 后,进行 PCR 反应.相应引物(上海生工公司)序列如下: CHOP 上游引物为 5'-CACTCTTGACCCTGCTTC-3',下游引物为 5'-AGTCGCCTCTACTTCCCT-3';β-actin 上游引物为 5'-GCACCGTCAAGGCTGAGAAC-3',下游引物为 5'-TGGT-GAAGACGCCAGTGGA-3'.反应条件为 95℃ 预变性 3 min,95℃ 20 s,56℃ 20 s,72℃ 20 s,40 个循环,72℃ 5 min.反应结束得到相应扩增曲线和融解曲线,记录各样本 Ct 值,以β-actin 作内参通过 2- △△Ct公式计算 GRP78 和 CHOP mRNA 的表达量.
1. 2. 4 Western blot 法检测 GRP78 和 CHOP 蛋白的表达 收集各时间点细胞,裂解离心后提取细胞总蛋白,按 BCA 蛋白测定法检测各组蛋白浓度.在垂直电泳仪中灌入 120 g/L 分离胶和 50 g/L 浓缩胶,按顺序在各泳道加入各时间点蛋白样品 45 μL,经 SDS-PAGE 后,半干式电转膜,然后 37℃ 封闭1 h,加入兔抗大鼠 GRP78 多克隆抗体 ( 1 ∶ 200 ) 、兔抗大鼠CHOP 多克隆抗体(1∶500) 、兔抗 β-actin 抗体(1∶1 000),4℃孵育过夜,洗膜后加入相应的 HRP 标记的山羊抗兔 IgG(1∶2 000)37℃ 孵育 1 h,采用 ECL 增强化学发光显色系统显色.用 GDS-8000 型凝胶成像分析系统扫描分析结果,以β-actin的表达水平作内参.
1. 2. 5 细胞凋亡检测 采用 annexin Ⅴ和 PI 双染色法.收集各组细胞,按试剂盒说明书操作,PBS 洗涤细胞 2 次,离心后用 1 μg/mL annexin V-FITC 和 PI 标记溶液重悬细胞,37℃避光孵 育 15 min,通 过 流 式 细 胞 仪 检 测 细 胞 凋 亡,应 用CellQuest 软件分析结果.
1. 2. 6 统计学分析 应用 SPSS12. 0 统计软件进行数据统计和分析.计量资料以 x ± s 表示,组间两样本均数比较采用t 检验.以 P < 0. 05 为差异有统计学意义.
2 结果
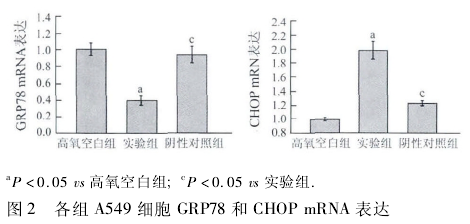
2. 1 A549 细胞 GRP78、CHOP mRNA 表达比较各组 GRP78 和 CHOP 基因的对应起峰时间基本一致,无明显杂峰(图 1),将所得 Ct 值通过 2- △△Ct公式计算后行统计学分析,结果显示,与高氧空白组相比,实验组细胞 GRP78 mRNA 表达含量显着降低,CHOP mRNA 表达含量显着增加,差异有统计学意义(P < 0. 05); 与实验组相比,阴性对照组细胞 GRP78mRNA 表达含量显着增高,CHOP mRNA 表达含量亦显着降低,差异均有统计学意义(P <0. 05,图 2).
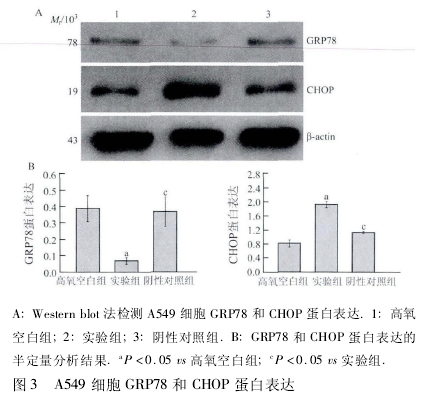
2. 2 A549 细胞 GRP78、CHOP 蛋白表达比较 实验组细胞 GRP78 蛋白表达含量较高氧空白组显着降低,CHOP 蛋白表达含量较高氧空白组显着增加,差异有统计学意义(P <0. 05); 阴性对照组细胞 GRP78蛋白表达含量较实验组显着增加,CHOP 蛋白表达含量较实验组显着降低,差异有统计学意义(P <0. 05,图 3).
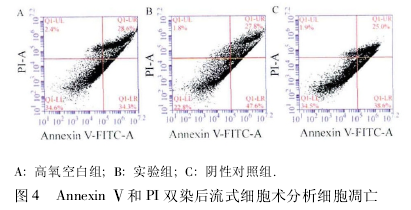
2. 3 A549 细胞凋亡率比较 检测各组 A549 细胞早期凋亡情况,高氧空白组的凋亡率为 34. 3%,实验组的凋亡率为 47. 6%,与高氧空白组相比差异有统计学意义 (P < 0. 05),阴性对照组的凋亡率为38. 6% ,与高氧空白组相比差异无统计学 意 义(P > 0. 05,图 4)。
3 讨论
BPD 仍是早产儿最常见的严重肺部并发症,目前认为其发病机制主要与围生期和出生后因素之间复杂的相互作用有关,后者包括机械通气、氧中毒、感染及炎性损伤[4 - 5].这些因素均可打破内质网的稳态,触发 ERS,我们前期研究已证实肺组织细胞具备发生 ERS 的条件和基础[6],此次研究发现体外肺细胞高氧损伤模型中存在 GRP78 基因表达,间接提示 ERS 参与了 BPD 的发病过程.
GRP78 具有两面性[7],在 ERS 早期,能转移内质网腔内的错误折叠蛋白以保护内质网稳态,是一种防御机制,ERS 过强过久时,GRP78 则成为未折叠蛋白反应的负调节蛋白,最终激活凋亡信号促进细胞凋亡.越来越多的研究[8 - 11]发现调控 GRP78 表达对肝细胞、黑素细胞、结肠上皮细胞、前列腺细胞等多种细胞凋亡起到关键作用.He 等[12]通过香烟烟雾提取物诱导慢性阻塞性肺疾病细胞模型实验表明 GRP78 基因沉默后可上调 caspase-3 表达并增加细胞凋亡率.由此我们猜想干扰 GRP78 基因表达亦可能影响肺损伤引发的凋亡效应.为了解沉默 GRP78表达对高氧诱导肺泡上皮细胞凋亡的可能作用,本研究利用小干扰 RNA 导入法封闭 GRP78 基因表达,并通过检测 GRP78 mRNA 和蛋白表达水平以观察沉默效应.结果发现,与高氧空白组、阴性对照组相比,siGRP78 组中 GRP78 mRNA 和蛋白表达水平均明显降低,这表明 siGRP78 在基因水平上发挥了封闭细胞内源性 GRP78 表达的特异性作用.进一步检测细胞凋亡发现,实验组早期细胞凋亡率明显增加,这验证了我们的猜想,并提示 siGRP78 下调 GRP78表达同时,也相应减弱了 GRP78 的细胞保护功能,从而加速了 ERS 反应性细胞凋亡.
ERS 通过 CHOP、c-Jun N 末端激酶 ( c-Jun N-terminal kinase,JNK)、caspase-12、Ca2 +等多条信号通路参与细胞凋亡的调控[13 -14],其中 CHOP 是介导ERS 诱导细胞凋亡的特异性转录因子,其表达情况可显着影响细胞的存活.Fan 等[15]研究发现,在卵巢上皮细胞中沉默 GRP78 基因能通过加速 CHOP 激活使细胞对死亡受体介导的凋亡更敏感.这一发现启示我们进一步检测肺损伤细胞中 GRP78 基因沉默后 CHOP 的表达情况.结果显示,siGRP78 组肺泡上皮细胞中 CHOP mRNA 和蛋白表达水平较高氧空白组和阴性对照组均明显升高,提示沉默 GRP78 表达可上调 CHOP 表达,这在一定程度上促进了 CHOP凋亡通路,诱导凋亡信号转导和肺泡上皮细胞凋亡.
目前认为 CHOP 凋亡途径主要与抗凋亡基因 Bcl-2 表达下调、谷胱甘肽减少、活性氧增加等因素有关[16],但 CHOP 通路如何介导细胞凋亡的具体机制仍未阐明.我们猜测应用 CHOP 凋亡途径中关键转录因子的抑制剂可能会阻碍高氧诱导的细胞凋亡发生发展.
本研究表明,应用基因沉默技术抑制 GRP78 表达可增强高氧活化的 CHOP 凋亡途径诱导的肺泡上皮细胞凋亡.如果应用基因过表达技术调控 GRP78表达可能会减少细胞凋亡,这可能对 BPD 的早期治疗有积极意义,尚待进一步研究.
参考文献:
[1]Somborac-Bacura A,van der Toorn M,Franciosi L,et al. Cigarettesmoke induces endoplasmic reticulum stress response and proteasomaldysfunction in human alveolar epithelial cells[J]. Exp Physiol,2013,98(1): 316 - 325.
[2]Tanjore H,Blackwell TS,Lawson WE. Emerging evidence for endoplasmicreticulum stress in the pathogenesis of idiopathic pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol,2012,302(8):L721 - L729.
[3]Yoon JW,Lee JS,Kim BM,et al. Catechin-7-O-xyloside inducesapoptosis via endoplasmic reticulum stress and mitochondrialdysfunction in human non-small cell lung carcinoma H1299 cells[J]. Oncol Rep,2014,31(1):314 - 320.
[4]Trembath A,Laughon MM. Predictors of bronchopulmonary dysplasia[J]. Clin Perinatol,2012,39(3):585 - 601.
[5]Madurga A,Mizíková I,Ruiz-Camp J,et al. Recent advances inlate lung development and the pathogenesis of bronchopulmonarydysplasia[J]. Am J Physiol Lung Cell Mol Physiol,2013,305(12):L893 - L905.
[6]高楚楚,卢红艳,唐 炜. 支气管肺发育不良大鼠肺 GRP78 及CHOP 表达与肺细胞凋亡的关系[J]. 临床儿科杂志,2013,31(10):959 - 963.
[7]Gewandter JS,Staversky RJ,O'Reilly MA. Hyperoxia augments ER-stress-induced cell death independent of BiP loss[J]. Free Radic BiolMed,2009,47(12): 1742 -1752.
[8]Chiou JF,Tai CJ,Huang MT,et al. Glucose-regulated protein 78 isa novel contributor to acquisition of resistance to sorafenib inhepatocellular carcinoma[J]. Ann Surg Oncol,2010,17 (2):603 - 612.
[9]Jiang CC,Mao ZG,Avery-Kiejda KA,et al. Glucose-regulated protein78 antagonizes cisplatin and adriamycin in human melanoma cells[J]. Carcinogenesis,2009,30(2): 197 -204.
[10]Thornton M,Aslam MA,Tweedle EM,et al. The unfolded proteinresponse regulator GRP78 is a novel predictive biomarker incolorectal cancer[J]. Int J Cancer,2013,133(6): 1408 - 1418.
[11]Bennett HL,Fleming JT,O'Prey J,et al. Androgens modulate autophagyand cell death via regulation of the endoplasmic reticulum chaperoneglucose-regulated protein 78 / BiP in prostate cancer cells[J / OL].Cell Death Dis,2010,1: e72.
[12]He B,Luo B,Chen Q,et al. Cigarette smoke extract induces theexpression of GRP78 in A549 cells via the p38 / MAPK pathway[J].Mol Med Rep,2013,8(6):1683-1688.
[13]刘宝琴,王华芹. 内质网应激与未折叠蛋白反应的研究进展[J]. 中华肿瘤防治杂志,2010,17(11): 869-872.
[14]Ansari N,Khodagholi F. Molecular mechanism aspect of ER stress inAlzheimer's disease:current approaches and future strategies[J].Curr Drug Targets,2013,14(1):114 - 122.
[15]范丽梅,苏 静,董 慧,等. 抑制葡萄糖调节蛋白 78 表达逆转人卵巢癌细胞顺铂耐药机制的分析[J]. 中华医学杂志,2013,93(17):1341 - 1344.
[16]Shen S,Zhang Y,Zhang R,et al. Sarsasapogenin induces apoptosisvia the reactive oxygen species-mediated mitochondrial pathway andER stress pathway in HeLa cells[J]. Biochem Biophys ResCommun,2013,441(2):519 - 524.





