
糖尿病视网膜病变( diabetic retinopathy,DR) 是糖尿病的最主要并发症之一,是严重致盲性眼病; 视网膜Müller 细胞是 DR 的主要参与细胞.而 ApoAI 是高密度脂蛋白( HDL) 的主要载脂蛋白,其在胆固醇逆向转运、抑制低密度脂蛋白( LDL) 的氧化修饰、前列环素的稳定、保护血管内皮细胞以及稳定细胞膜结构中发挥重要作用[1].最近研究表明,ApoAI 是主要的抗粥样硬化因子[2].国内已有报道中国糖尿病人群 ApoAI显着低于健康人群[3],而 apoB 与 ApoAI 的比值显着高于健康人群[4],作者拟研究 ApoAI 对 Müller 细胞增殖与凋亡的影响,以期探讨视网膜 Müller 细胞参与DR 的始动因素.
1 材料与方法
1. 1 人视网膜 Müller 细胞的原代培养
按朱茂丽等[5]报道的方法稍加改进进行细胞培养: 取角膜移植后的眼杯( 取自于苏州大学第三临床医学院眼科) ,自锯齿缘后 1 ~2 mm 处环形剖开眼球,去除眼前部组织及玻璃体,留后半眼球壁于 DMEM 培养液中,轻轻剥取视网膜组织,将视网膜组织放于含DMEM 培养基的一次性塑料培养皿中,在解剖显微镜下将视网膜组织剪成约 1 mm ×1 mm 大小的组织块制成组织块悬液,离心弃上清,加入 5 倍组织块体积的0. 25% 的胰酶悬浮组织块,细胞培养箱放置 5 min 后取出加入等体积的 20% FBS 的 DMEM 培养液后用移液器轻轻吹打 10 次,离心弃上清,加入 20% FBS 的DMEM 培养液再次制成组织块悬液接种于培养瓶中,置于恒温恒湿培养箱( 37 ℃,体积分数为 5CO2) 中培养,开始 1 周不换液,若培养液变黄则小心用移液器吸出部分培养液后加入新鲜培养液,待 1 周后细胞爬出后换液,见 80%以上的细胞融合以后传代培养.经免疫组化鉴定培养出的细胞为视网膜 Müller 细胞.
1. 2 实验分组与实验方法以 P3代对数生长期的人视网膜 Müller 细胞用于实验,当 Müller 细胞达 80% 以上融合状态时予以0. 25% 胰蛋白酶消化,用含 20% FBS 的 DMEM 培养液制成细胞悬液接种至 6 孔培养板中,置于饱和湿度、37 ℃ 、体积分数为 5% % CO2培养箱中孵育.24 h 后取出 6 孔培养板,小心吸弃原培养液,用无 FBS 的DMEM 培养液漂洗两次,不同 ApoAI 浓度组中分别加入浓度为 0、0. 01、0. 1、1 μg·ml- 1的 DMEM 培养液3 ml,置于饱和湿度、37 ℃ 、体积分数为 5% % CO2培养箱中继续孵育 24 h.
倒置显微镜下观察各组 Müller 细胞形态.流式细胞术检测 Müller 细胞的细胞周期,0. 25% 胰酶消化6 孔板中的细胞制成单细胞悬液并收集到流式管中,PBS 洗两次以除去其中的培养液和胰酶等物质,然后使用美国BD 公司的DNA 异倍体染色试剂盒,按照说明书依次加入 A、B、C 3 种试剂后上机检测.流式细胞术检测 Müller 细胞的凋亡,0.25%胰酶消化六孔板中的细胞制成单细胞悬液并收集到流式管中,PBS 洗两次以除去其中的培养液和胰酶等物质,将细胞悬液离心弃上清后加入 195 μl Annexin V-FITC 结合液轻轻重悬细胞,加入 5 μl Annexin V-FITC 轻轻混匀,室温( 20 ~25 ℃ ) 避光孵育 10 min.1 000 g 离心 5 min,弃上清,加入190 μl Annexin V-FITC 结合液轻轻重悬细胞.加入10 μl 碘化丙啶染色液轻轻混匀,冰浴避光放置,随即进行流式细胞仪检测.荧光显微镜下观察凋亡细胞形态,按上述步骤处理细胞最后一步不进行流式细胞仪检测,而是离心收集细胞后用 50 ~100 μl Annexin V-FITC 结合液轻轻重悬细胞,涂片后于荧光显微镜下观察.
1. 3 统计学处理
实验数据均以均数 ± 标准差表示,应用 SPSS 统计软件进行单因素方差分析,以 P <0. 05 表示差异有统计学意义.
2 结 果
2. 1 不同药物浓度组 Müller 细胞形态.
各组 Müller 细胞呈典型的多角形,大小均匀、边界清晰、形态无明显差异.见图 1.

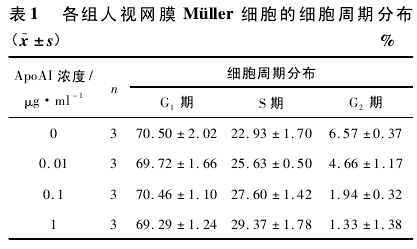
2. 2 不同药物浓度组人视网膜 Müller 细胞的细胞周期分布采用单因素方差分析的统计方法,药物处理后G1期细胞百分比无明显变化( F =0. 432,P > 0. 05) ,S 期细胞百分比明显增多 ( F = 11. 007,P < 0. 05) ,G2期细胞百分比明显降低( F = 20. 350,P < 0. 05) .见表 1.
2. 3 Annexin V-FITC /PI 细胞凋亡的检测结果
0、0. 01、0. 1、1 μg·ml- 14 个不同浓度组别人视网膜 Müller 细胞的凋亡数目百分比分别为( 10. 19 ±3. 49) % 、( 12. 90 ± 2. 35 ) % 、( 9. 86 ± 0. 50) % 、( 13. 91 ±4. 83) %,采用单因素方差分析的统计方法,药物处理后细胞凋亡百分比差异无统计学意义( F =1. 166,P = 0. 381)2. 4 荧光显微镜下晚期凋亡和早期凋亡细胞的形态荧光显微镜下 4 组凋亡细胞的数目及形态未见明显差异,见图 2.

3 讨 论
DR 是糖尿病最常见而严重的并发症之一,近几年国内外学者研究认为,Müller 细胞在视网膜血管病变之前其形态结构和生理功能就发生了变化,Müller细胞的这些变化在 DR 的发生发展中起重要作用[6].
Müller 细胞是视网膜的主要神经胶质细胞,该细胞从视网膜的内界膜延长至外界膜,贯穿于视网膜感觉神经全层,发挥着稳定视网膜的复杂结构、提供定向支架、从结构和功能上支持视网膜神经元和血管、阻止异常光感受器细胞迁移入视网膜下间隙的功能[7].因此,探讨微环境内外因素对视网膜 Müller 细胞的影响有利于我们认识该细胞在 DR 过程中的作用.
ApoAI 主要是由小肠和肝脏合成的一种载脂蛋白,其主要分布在血浆乳糜颗粒( CM) 、HDL2、HDL3中.成熟的人 ApoAI 由 243 个氨基酸组成,相对分子质量为 28 300.ApoAI 在胆固醇逆向转运、抑制 LDL的氧化修饰、前列环素的稳定、保护血管内皮细胞以及稳定细胞膜结构中发挥重要作用[8].国内已有报道中国糖尿病人群 ApoAI 显着低于健康人群,而 apoB 与ApoAI 的比值显着高于健康人群[9].
本实验中,加入 ApoAI 后处于 S 期的细胞比例明显增加,而相应的 G2期细胞明显减少,并且随着ApoAI 浓度的增加这种趋势更加明显.说明 ApoAI 可以抑制 Müller 细胞的增殖,使细胞增殖过程阻滞在 S期和 G2期之间.因此,ApoAI 可能是通过阻滞细胞的分裂来抑制细胞的增殖.
在本次细胞凋亡实验中,加入 ApoAI 的流式结果显示细胞凋亡比例没有明显变化,说明 ApoAI 对Müller 细胞的凋亡无明显作用,也表明 ApoAI 对Müller 细胞的作用应该是通过其它路径,即可能通过阻滞细胞的分裂来抑制细胞的增殖.
综上所述,ApoAI 可以抑制人视网膜 Müller 细胞的增殖,且这种抑制作用随着 ApoAI 浓度的增加而增强; ApoAI 对细胞凋亡无明显作用.由此我们可以推断,糖尿病状态下由于 ApoAI 的显着降低以及 apoB 与ApoAI 的比值显着增高,可能解除了对于视网膜Müller 细胞抑制作用,从而促进了 DR 的发生.
[参考文献]
[1]SAITO H,DHANASEKARAN P,NGUYEN D,et al. Alpha-he-lix formation is required for high affinity binding of humanapolipoprotein A- I to lipids[J]. The Journal of BiologicalChemistry,2004,279( 20) : 20974-20981.
[2]张扬,冉建民,徐刚. 2 型糖尿病患者高密度脂蛋白水平变化分析[J]. 中国基层医药,2007,14( 7) : 1196-1197.
[3]王慧,王晓琴. 糖尿病合并急性脑梗死老年患者的血脂分析[J]. 实用医学杂志,2011,28( 3) : 193-195.
[4]AYYOBI A F,BRUNZELL J D. Lipoprotein distribution in themetabolic syndrome,type 2 diabetes mellitus,and familialcombined hyperlipidemia[J]. The American Journal of Cardi-ology,2003,92( 4A) : 27J-33J.
[5]朱茂丽,刘瑶,陈平圣,等. 糖基化终产物对视网膜 Mailer细胞表达血管内皮生长因子的影响[J]. 中国糖尿病杂志,2008,16( 11) : 691-693.
[6]GUIDRY C,KING J L,MASON J O. Fibrocontractive Mullercell phenotypes in proliferative diabetic retinopathy[J]. Inves-tigative Ophthalmology & Visual Science,2009,50 ( 4 ) :1929-1939.
[7]NEWMAN E,REICHENBACH A. The Muller cell: a functionalelement of the retina[J]. Trends in Neurosciences,1996,19( 8) : 307-312.
[8]杨开燕,钟栩,卢玉俊. 血浆载脂蛋白的研究进展[J]. 临床荟萃,2012,27( 14) : 1268-1271.
[9]何爱琴,吴小梅,缪珩. 2 型糖尿病患者 ApoAl/ApoB 之值与其血管并发症关系分析[J]. 现代医学,2012,40( 5) :556-559.





