
脊髓微血管周细胞( spinal cord microvascularpericytes,SCMP) 是血-脊髓屏障 ( blood-spinal cordbarrier,BSCB) 的重要组成部分,参与调节脊髓微循环血流、内皮细胞紧密连接和 BSCB 的功能。研究表明 SCMP 的功能变化与多种脊髓疾病相关[1].既往关于中枢神经系统周细胞的体外研究多来源于脑组织,分离策略通常是使用酶消化法获得微血管片段,在血管片段的基础上分离培养周细胞,但是此策略容易造成杂细胞的污染。而用免疫磁珠分选和流式分选等方法处理的细胞活性差、产量低,而且成本过高。本研究基于本单位分离脑微血管周细胞的经验[2],使用商品化的周细胞培养基,通过“培养基筛选法”分离小鼠脊髓微血管周细胞,并对所获得的周细胞的功能进行评价。
1 材料与方法
1. 1 材料
1. 1. 1 实验动物和 细 胞: 清 洁 级 3 周 龄 雄 性C57BL /6 小鼠[中国医学科学院医学实验动物研究所,许可证号 SCXK( 京) 2009-0007].所有的实验方案已获得中国医学科院微循环研究实验动物伦理委员会批准。脊髓微血管内皮细胞( spinal cord mi-crovascular endothelial cells, SCMECs ) 来 自 本 实验室[3].
1. 1. 2 主要试剂: 胎牛血清( FBS) 、改良杜氏伊格尔 培 养 基 ( Dulbecco's modified Eagle medium,DMEM) ( 高糖) 、II 型胶原蛋白酶、双抗、庆大霉素、谷氨酰胺和 1 × PBS、0. 05% 胰蛋白酶和含 10%FBS 的 DMEM 培养基( 北京协和医学院细胞中心) ;含 10% FBS 的内皮细胞培养基( endothelial cell me-dium,ECM) 和含 2% FBS 周细胞培养基 ( pericytescell medium,PCM) ( Scien Cell 公司) ; 牛血清白蛋白( BSA) ( Amresco 公司) ; DNA 酶 I( DNase Ⅰ) 和纤维连接蛋白 Fibronectin( Sigma 公司) ,胶原蛋白酶/分散 酶 ( Roche 公 司) ; 抗 von Willebrand factor( vWF) 抗体( Santa Cruz 公司) ; 抗血小板源生长因子受体( PDGFRβ) 、神经元-胶质抗原 2( neuron-gliaantigen 2,NG2) 抗体、von Willebrand 因子( von Will-ebrand factor,vWF) 抗体、胶质纤维酸性蛋白 ( glialfibrillary acidic protein,GFAP) 抗体和 α-SMA 抗体( Abcam 公司) ; FITC 标记和 TRITC 标记的二抗( 北京中衫金桥生物技术有限公司) .APC 标记抗小鼠CD45 抗体、PE 标记抗小鼠 PDGFRβ / CD140b 抗体、PE / Cy7 标记抗小鼠 CD31 抗体、FITC 标记抗小鼠CD11b 抗体及相应的同型对照 ( Biolegend 公司)eFluor? 660 标记抗小鼠 GFAP 抗体及相应的同型对照抗体、流式染色缓冲液( flow cytometry stainingbuffer,FCS Buffer) 、细胞内固定工作液( intracellularfixation buffer,IC Buffer) 和透化工作液( permeabili-zation buffer ) ( eBioscience 公司 ) ; 基质胶 ( BD 公司) ; 活细胞荧光示踪剂 DiI( 红色) 和 DiO( 绿色)( Life Technologies 公司) .
1. 2 方法
1. 2. 1 细胞分离与培养: 小鼠经 3% 戊巴比妥钠( 30 mg/kg) 腹腔注射麻醉,断头处死。取出脊髓组织,用滤纸去除软脊膜,剪碎成约 1 mm × 1 mm ×1 mm大小,整个过程在冰上操作。加入 DMEM、Ⅱ型胶原蛋白酶( 1 g/L) 、DNase Ⅰ( 15 mg/L) ,37 ℃消化 1. 5 h.1 000 × g 离心 8 min,弃上清液,20%BSA-DMEM 重悬; 4 ℃ 1 000 × g 离心 20 min.弃上清,加入 DMEM、collagenase/dispase( 1 g/L) 、DNaseⅠ( 6. 7 mg/L) ,37 ℃ 消化 1 h.加入 DMEM,700 × g离心 6 min.弃上清,加入含 20% BSA-DMEM 重悬。4 ℃ 1 000 × g 离心 20 min.弃上清后 DMEM重悬,悬液内即含微血管片段。将微血管片段用DMEM 洗 2 次,1000 × g 离心 8 min,700 × g 离心5 min.弃上清重悬后用细胞滤器过滤。用 ECM 将微血管片段接种至两个 fibronectin( 10 mg/L) 包被好的 35 mm 培养皿。72 h 后用 PBS 清洗 3 次,以去除漂浮的死细胞以及其他杂质,之后继续用 ECM 培养。每隔 3 d 换液 1 次,自原代细胞从微血管片段爬出到细胞完全汇合需7 ~9 d.待细胞汇合后用胰蛋白酶消化传代 2 次,均使用 ECM 进行培养。从第3 次传代后,用 PCM 培养。取第 5 代细胞用于细胞鉴定实验( 图 1) .
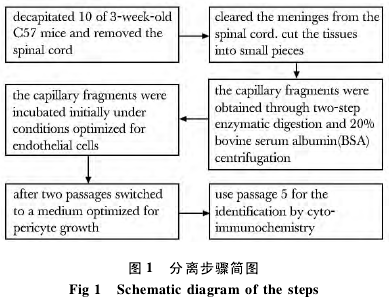
1. 2. 2 细胞鉴定: 1) 倒置显微镜观察 SCMP 的形态: 用倒置显微镜每隔 24 h 观察细胞从微血管片段爬出及增殖状况并拍照。2) 细胞免疫化学方法鉴定: 待细胞增殖汇合至 75% 左右,对细胞进行固定和透化处理。分别加入一抗( PDGFRβ、NG2、vWF 和 GFAP) ( 1 ∶ 200 ) ,4 ℃ 孵育过夜; PBS 洗5 min共 3 次; 分别加入荧光标记二抗,室温下孵育1 h,PBS 洗 5 min 共 3 次; DAPI 染色 5 min,PBS 清洗; 封片。荧光显微镜( DP72,Olympus 公司) 下观察并拍照,用 Image Pro Plus 7. 0( IPP) 进行定量分析,实验重复 3 次。3) 流式细胞术检测细胞表面蛋白 PDGFRβ、CD11b 和 CD31: 消化并收集细胞,用流式染色工作液将细胞密度调整为 1 × 1010个/ L; 取100 μL 加入流式细胞仪测定管,添加 20 μL Fc 受体阻断剂,并孵育 10 min; 添加荧光直接标记的流式抗体和相应的同型对照抗体,4 ℃ 避光孵育30 min; 流式染色工作液清洗 2 次后,用 PBS 重悬至 100 μL,用细胞筛制成单细胞悬液,行流式细胞仪检测。实验重复 5 次。4) 流式细胞术检测细胞胞质蛋白 GFAP: 消化并收集细胞,用 FCSB 将细胞密度调整为 1 ×1010个/L; 取 100 μL 加入流式细胞仪测定管,添加 100 μL 细胞内固定工作液,室温避光孵育30 min; 添加2 mL透化液,400 × g 室温离心 5 min 后弃上清,用2 mL透化液重悬; 400 × g室温离心5 min后弃上清; 用 100 μL 透化液重悬,加入相应的抗体或相应的同型对照抗体,室温避光孵育 30 min; 用 FCSB 清洗 2 次,用 PBS 重悬至100 μL 后用细胞筛制成单细胞悬液,行流式细胞仪检测。实验重复 5 次。
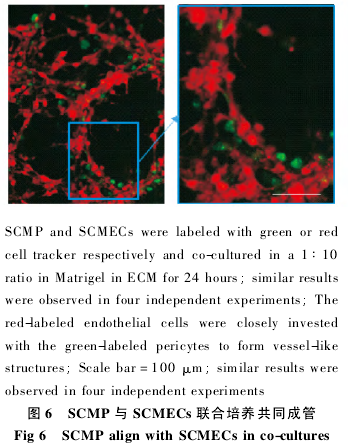
1. 2. 3 细胞功能评价: 1 ) 含 10% FBS 的 DMEM培养基对细胞分化标志蛋白表达的影响: ①两组用 PCM 培养的第 5 代细胞,其中一组改用含 10%FBS 的 DMEM 培养; 另外一组做为对照组继续用PCM 培养。4 d 后用细胞免疫化学方法和 Westernblot 免疫印记法检测 α-SMA 的表达。②细胞免疫化学方法鉴定: 对细胞进行固定和透化处理。分别加入一抗 α-SMA 抗体( 1∶ 200) ,4 ℃ 孵育过夜;PBS 洗 5 min 共 3 次; 加入荧光标记二抗,室温下孵育 1 h,PBS 洗 5 min 共 3 次; DAPI 染色 5 min,PBS清洗; 封片油封片。荧光显微镜下观察并拍照,用Image Pro Plus 7. 0( IPP) 进行定量分析,实验重复 3次。③Western blot 免疫印记法: 将培养至汇合的细胞收集并裂解。以每孔 40 μg 蛋白上样于 10%SDS-PAGE 分离后,将蛋白转移至 PVDF 膜上。用抗小鼠 α-SMA 抗体检测,以 β-actin 为内参。实验1的比值表示。实验重复 3 次。2) 基质胶成管实验:①细胞荧光标记: 脊髓微血管内皮细胞用红色荧光素 DiI 标记,SCMP 用绿色荧光素 DiO 标记。将培养皿中的培养基吸出,加入染色培养基( 荧光染料与培养基以 1∶ 200 比例混匀) ,放置培养箱内孵育20 min; 将染色培养基吸出,加入正常培养基清洗 3次( 每次清洗时用正常培养基孵育 10 min 后再将其吸出) .②以每孔 25 μL 基质胶包被 96 孔板,37 ℃30 min 使胶凝固。将 SCMECs 和 SCMP 以10∶ 1进行混合后进行接种,每孔接种 5 ×103个细胞,ECM 最终体积为 100 μL.24 h 后观察组成管情况。实验重复 3 次。
1. 3 统计学分析
数据用均数 ± 标准差( x ± s) 表示,实验所用数据采用 SPSS19. 0 软件处理,组间比较采用单因素方差分析。
2 结果
2. 1 倒置相差光学显微镜下观察细胞形态
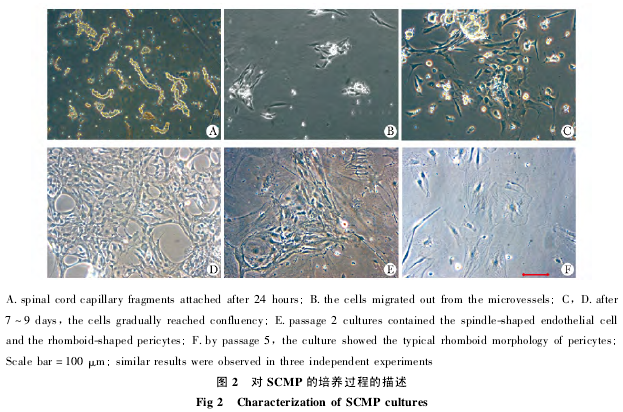
在内皮细胞培养基中,微血管片段呈典型的串珠状或分支状( 图 2A) ; 48 h 后,可见细胞从微血管片段中爬出( 图 2B) ; 4 d 后,细胞逐渐增多,细胞形态多样( 图 2C) ; 7 ~ 9 d 后细胞汇合( 图2D) ; 细胞传代后( 第 2 代) 继续在 ECM 中培养,可见纺锤状的内皮细胞和多边形的周细胞呈现伴随状增殖( 图 2E) ; 传代后改用 PCM 培养,长梭状内皮细胞逐渐减少,多边形、多突起的周细胞呈现优势增殖( 图 2F) .
2. 2 SCMP 的细胞免疫化学和流式细胞术鉴定
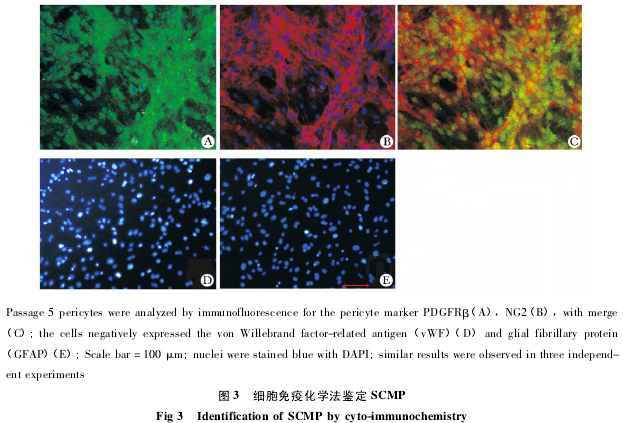
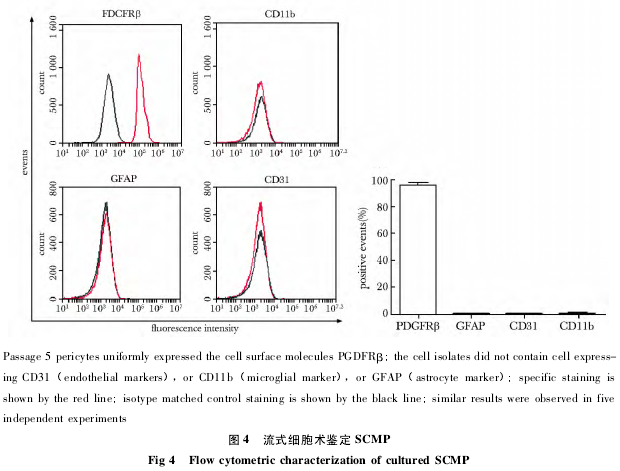
对第 5 代的细胞进行免疫荧光染色鉴定,可见细胞 PDGFRβ 和 NG2 双阳 性 ( 图 3A ~ C) ;vWF ( 内皮细胞) 和 GFAP ( 星形胶质细胞) 阴性 ( 图 3D,E) ,表明得到的细胞中没有内皮细胞和星形胶质细胞的污染。流式细胞仪检测结果显示,PDGFRβ 的阳性率为 95. 52% ± 2. 55% ,而 GFAP 为 0. 63% ± 0. 26% ,CD31 ( 内皮细胞)为 0. 80% ± 0. 26% ,CD11b ( 小胶质细胞) 为1. 02% ± 0. 35% ( 图 4) .
2. 3 10% FBS-DMEM 培养基促进 SCMP 的分化
SCMP 在 PCM 中培养 2 ~ 3 d 即可传代。细胞保持典型的多角形形态但是体积较小,且 α-SMA 低表达( 图 5A) ; 换用 DMEM 培养 4 d 后,α-SMA 的表达明显上调( 图 5B) ,且部分细胞体积增大,Westernblot 结果( 图 5C) 表明 α-SMA 的变化情况与细胞免疫化学法检测结果一致。
2. 4 SCMP 与 SCMECs 联合培养共同成管
红色荧光标记的 SCMECs 和绿色荧光标记的SCMP 以 10∶ 1 的比例共培养在基质胶上,24 h 后可以观察到两种细胞黏合在一起,共同组成管腔样结构 ( 图 6) .
3 讨论
有文献报道使用匀浆研磨结合酶消化分离微血管[4-6],通过振荡消化使细胞从微血管片段上脱离。但得到的微血管活力差,细胞存活率低,时间和力度难掌控。而采用机械剪切、两步酶消化结合 20%BSA 离心获得微血管片段,避免了研磨对微血管的损伤,增加了细胞的生存概率。
通过微血管片段获取周细胞会面临杂细胞的污染。从微血管上脱落的既包含内皮细胞和周细胞,也有小胶质细胞和星形胶质细胞。根据本实验室分离内皮细胞的经验[7],用 ECM 培养内皮细胞时存在周细胞的污染,而且周细胞会抑制内皮细胞的增殖[8],但 在 ECM 中 胶 质 细 胞 的 生 长 会 受 到 抑制[9-10].因此,先用 ECM 培养微血管,待胶质细胞被抑制后改用 PCM 来抑制内皮细胞。细胞免疫化学和流式细胞术鉴定的结果表明,该方法的内皮细胞和胶质细胞的污染显著降低。
用 6 ~8 周龄的小鼠分离细胞,从微血管内爬出的细胞数量少,活性低。改用 3 周龄小鼠,则细胞活力强,存活率高。细胞在 25 cm2( 或更大) 培养瓶中不易生长,而在 35 mm 培养皿中细胞能够很快形成汇合,生长状态良好。从而证明中枢神经系统微血管单元的细胞不适合大的生长空间[11].
周细胞是多能干细胞,在体外培养过程中能够快速分化[12],也有人认为其在传代过程中能够保持一定的稳定[13].周细胞常用的标志蛋白为 PDGFRβ 和NG2[14-15],但也有研究表明,周细胞能够表达一种与血管平滑肌细胞相同的收缩蛋白 α-SMA.体内和新分离的微血管周细胞不表达 α-SMA,而体外培养中周细胞会逐渐表达该蛋白,因此 α-SMA 被认为是一种周细胞分化的标志蛋白[14].本研究发现,PCM中的周细胞体积小,α-SMA 表达低; 换用 DMEM 培养 4 d,部分细胞的体积增大、突触增多,且 α-SMA表达明显上调,表明细胞具有一定的分化能力。成管实验表明,分离的 SCMP 能够与内皮细胞共同形成管腔样结构。
综上所述,本研究建立了一种分离原代 SCMP的方法。具有操作简单、经济等优点,可以得到纯度高和活力较强的周细胞。
参考文献:
[1] Winkler EA,Sengillo JD,Bell RD,et al. Blood-spinalcord barrier pericyte reductions contribute to increased cap-illary permeability [J]. J Cereb Blood Flow Metab,2012,32: 1841-1852.
[2]秦伟伟,鹿文葆,刘淑英,等。 大鼠脑微血管周细胞的分离和鉴定[J]. 国际脑血管病杂志,2011,19: 531-534.
[3]苑晓晨,李炳蔚,秦伟伟,等。 大鼠脊髓微血管内皮细胞的分离培养与鉴定[J]. 基础医学与临床,2013,33:1330-1331.
[4]Capetandes A,Gerritsen ME. Simplified methods for con-sistent and selective culture of bovine retinal endothelialcells and pericytes [J]. Invest Ophthalmol Vis Sci,1990,31: 1738-1744.
[5]Dore-Duffy P. Isolation and characterization of cerebral mi-crovascular pericytes [J]. Methods Mol Med,2003,89:375-382.





