
血管平滑肌细胞(vascularsmoothmusclecells,VSMC)对维持动脉壁结构和功能的完整性起到了重要作用。OPG作为肿瘤坏死因子受体超家族成员及细胞核因子-κB受体活化因子配体的诱导受体,不仅参与了骨的代谢过程,也参与了血管壁的钙化。目前已经有大量研究证实OPG与人类心血管疾病之间存在一定的关系。尽管OPG在骨代谢过程中的作用已经逐步被阐明,但其在VSMC中的调节作用仍不明确。本研究采用RNA干扰技术,构建OPG过表达及OPGRNA干扰的腺病毒产品,感染HVSMC,检测各组VSMC中OPG的表达情况以及VSMC凋亡情况,从而对OPG与VSMC凋亡之间的关系进行初步探讨。
1、 材料与方法
1.1 材料 HEK293细胞(美国菌毒种保管中心)。大肠杆菌DH5α及腺病毒穿梭载体pYr-adshuttle-1,pYr-2.1-hU6OPG基因(pOTB7-OPG)(长沙赢润生物技术有限公司,中国)。羊抗人OPG多克隆抗体及碱性磷酸酶标记的驴抗羊IgG(SantaCluz公司,美国)。MULV逆转录试剂盒、限制性核酸内切酶、T4DNA连接酶、T4DNA聚合酶等(NewEnglandBiolabs公司,美国)。小量质粒提取试剂盒(上海生工公司,中国)。Hoechst33258染色试剂盒及AnnexinV-FITC细胞凋亡检测试剂盒(南京凯基公司,中国)。冻存HVSMC细胞由湘雅二医院内分泌科谢辉博士惠赠。
1.2 方法
1.2.1 PCR扩增OPG基因 以pOTB7-OPG载体为模板,PCR扩增OPG基因。引物对:OPG-f:5'-CG GGA TCC GCCACCAT GAA CAA CTT GCT GTG CTG-3'BamHIOPG-r:5'-GG AAT TCG GCC ATT TCC AGT TAT AAG CA-3'EcoRI。预计扩增片段大小为1.2kb,1%琼脂糖凝胶电泳,回收OPG条带。
1.2.2针对OPG基因siRNA序列的确定和合成通过Ambion寻找OPG的siRNA靶点靶序列并设计对应的寡核苷酸序列,根据OPG的基因序列和二级结构,筛选出3对特异性siRNA,根据siRNA设计原则综合考虑,选择第三条靶序列:正义链5’-GCT CAG TTT GTG GCG AAT AAA-3’,反义链5’-TTT ATT CGC CAC AAA CTG AGC-3’,以上述靶序列为基础,设计OPG-shRNA引物。
1.2.3 重组表达质粒的构建及鉴定。分别将OPG的PCR产物及OPG-shRNA片段转载至腺病毒穿梭载体pYr-adshuttle-1和pYr-2.1-hU6上,挑取克隆,用BamHI、EcoRI做双酶切鉴定。选取酶切鉴定正确的克隆送去测序,以进一步确认此质粒为腺病毒骨架载体,并且已经成功插入OPG及OPG-shRNA目的基因。
1.2.4 VSMC培养及鉴定。冻存VSMC复苏后培养于含100ml/L胎牛血清的培养基中,置于37℃,50ml/LCO2细胞培养箱中培养。经平滑肌细胞特异性鼠抗人α-actin单克隆抗体免疫组化鉴定后,证实为VSMC,实验用4~8代细胞。
1.2.5 腺病毒感染VSMC细胞。将VSMC分为空白对照组、OPG过表达组、OPG过表达+OPGRNA干扰组。将VSMC以1×106接种于50ml的培养瓶中,24h后用腺病毒感染细胞。孵育48h后,消化、离心、收集细胞。
1.2.6 RT-PCR。按常规方法提取总RNA,逆转录成cDNA。OPG引物(366bp):上游引物序列5’-CCGGAAACAGTGAATCAACT-3’;下游引物序列5’-CCA CTT TCT TTC CCG GTA-3’。GAPDH引物(452bp):上游引物序列5’-ACC ACA GTC CAT GCC ATC AC-3’;下游引物序列5’-TCC ACC ACC CTG TTG CTG TA-3’。PCR循环:94℃5min,94℃20s,52℃25s,72℃25s,共30个循环,72℃末次延伸3min。取PCR产物9μl,加1μl溴酚蓝,1.5%Agrose凝胶电泳30min(100V,35mA),紫外灯下观察DNA条带,拍照。
1.2.7 Western-blot。参照《分子克隆实验指南》的方法提取细胞总蛋白。考马斯亮蓝定量总蛋白后,于10%SDS聚丙烯酰胺凝胶电泳分离。待电泳完毕后24V电转印16h至PVDF膜,在室温下封闭2h。加入鼠抗人OPG单克隆抗体,37℃孵育1h。
二抗为羊抗鼠IgG,37℃孵育1h,二氨基联苯胺显色,数码照相。
1.2.8 Hoechst33258染色。 将HVSMC细胞接种于6孔板,接种密度为1×106个/孔,24h后用腺病毒感染细胞。孵育48h后,按Hoechst33258试剂盒说明书进行染色。
1.2.9 流式细胞术检测。 各组细胞培养48h后,经0.2%胰酶处理,离心收集细胞,用4℃预冷PBS洗涤2次,然后用250μl缓冲液重悬细胞,调整其浓度为1×106个/ml。取100μl细胞悬浮于5ml流式管中,加入5μlAnnexinV/FITC和10μl20ug/ml的碘化丙锭溶液,混匀后室温避光孵育15min,然后加缓冲液至500μl,流式细胞仪分析,获得细胞凋亡数据后用ModFitLT软件进行细胞凋亡相对定量分析。
2、结果
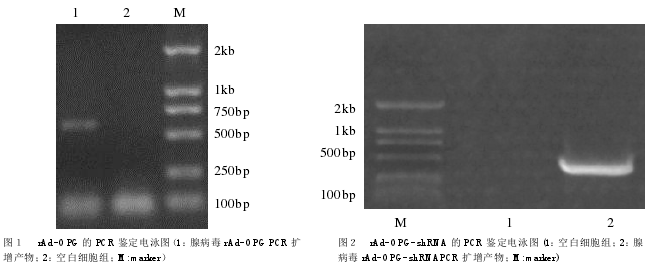
2.1 OPG及OPG-shRNA重组腺病毒的鉴定。经BamHI、EcoRI做双酶切,pAd-OPG重组质粒切出约600bp的目的条带(见图1),shRNA重组质粒切出约470bp的目的条带(见图2),符合预期,说明重组腺病毒rAd-OPG及rAd-OPG-shRNA包装成功。
2.2 RT-PCR结果。空白细胞组中,OPG表达量比较弱。OPG过表达组中,OPG表达量大大增加。
在OPG过表达+OPGRNA干扰组中,由于OPG表达受到抑制,OPG表达量下降较明显(见图3)。用分析软件Phoretix1D对各条带进行灰度分析,结果显示:与空白细胞组相比,OPG过表达组的OPG表达量增加;在OPG过表达+OPGRNA干扰组中,OPG-shRNA的干扰率达到73.9%,有效地抑制了OPG基因的表达(见表1)。
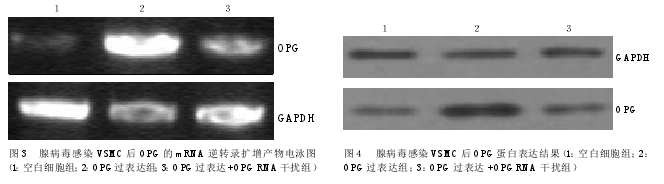

2.3 Western-blot结果。腺病毒感染VSMC后OPG蛋白表达结果显示,空白细胞组中OPG表达量比较弱。OPG过表达组中,OPG表达量大大增加。OPG过表达+OPGRNA干扰组中,由于OPG表达受到抑制,OPG表达量下降较明显(见图4)。用分析软件Phoretix1D对各条带进行灰度分析(见表2),结果显示:与空白细胞组相比,OPG过表达组的OPG表达量增加;在OPG过表达+OPGRNA干扰组中,OPG-shRNA的干扰率达到67.7%,有效地抑制了OPG蛋白的表达。

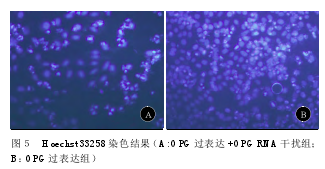
2.4 Hoechst33258染色。 Hoechst染色时,细胞核呈致密浓染,比正常核小;或呈碎块状致密浓染,亮度较正常细胞要高,出现典型的凋亡小体。OPG过表达+OPGRNA干扰组中有一部分细胞发生了凋亡,不过数量较少。而OPG过表达组中有大量细胞发生了凋亡(见图5)。

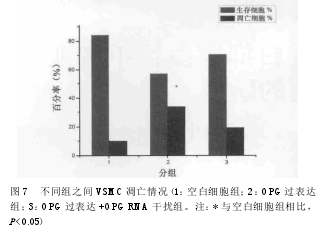
2.5 流式细胞术检测结果。 OPG过表达组的细胞凋亡率较空白细胞组有较大增加,而进行RNA干扰后,细胞凋亡率有一定程度下降(见图6)。结果显示,OPG的表达和VSMC凋亡之间存在正比关系。各组间生存细胞和凋亡细胞比率见表3,直方图见图7。
3、 讨论
VSMC作为腹主动脉中膜的主要细胞成分,对维持动脉壁结构和功能的完整性起到了重要作用。最近越来越多的学者注意到腹主动脉瘤(abdominal aortic aneurysm,AAA)组织中VSMC数量减少是AAA形成过程中不可忽视的因素。目前已经有大量研究证实OPG与人类心血管疾病之间存在一定的关系。尽管OPG在骨代谢过程中的作用已经被逐步阐明,但其在VSMC中的调节作用仍不明确。
有研究发现无论是人体AAA组织还是AAA动物模型,OPG水平升高的同时伴有VSMC数量的减少,提示OPG水平与VSMC的凋亡呈正相关,然而,究竟是因为OPG的升高加速VSMC的凋亡还是VSMC的凋亡发生后促使OPG表达增高仍不清楚。因此弄清楚OPG基因表达与VSMC凋亡之间的关系有重要的临床意义,有可能为AAA的基因治疗提供一种新的思路。
基因研究包括两个方面,基因过表达和基因表达的抑制。本研究通过OPG基因过表达及OPG基因的RNA干扰,即正反两方面来探讨其与VSMC凋亡之间的关系。RNA干扰技术作为一种十分有潜力的基因功能研究和基因治疗方法,目前已成为抗病毒、抗肿瘤、基因表达调控、基因功能研究、基因治疗等领域一个重要的研究方向和热点。空白对照组、OPG过表达组、OPG过表达+OPGRNA干扰组等各组细胞样本的RT-PCR及Western-blot结果显示:空白对照组中,OPG表达量较弱;OPG过表达组中,OPG表达量大大增加;OPG过表达+OPGRNA干扰组中,由于OPG表达受到抑制,OPG表达量下降较明显。以上结果充分说明重组腺病毒rAd-OPG-shRNA具有特异性抑制VSMC目的基因OPG的作用。对各组细胞样本进行Hoechst33258染色和流式细胞术分析,结果显示OPG过表达组可见大量高亮度的凋亡细胞出现,而OPG过表达+OPGRNA干扰组只有一部分细胞发生凋亡。与空白对照组相比,OPG过表达组的细胞凋亡明显,而OPG过表达+OPGRNA干扰组的细胞凋亡率与空白对照组细胞凋亡率相差不大。
流式细胞术分析结果显示:空白细胞组凋亡细胞占10.06%,OPG过表达组凋亡细胞占33.82%,而OPG过表达+OPGRNA干扰组凋亡细胞占19.71%,说明OPG过表达组的细胞凋亡率较空白细胞组有较大上升,而同时进行RNA干扰后,细胞凋亡率有一定程度下降。以上结果分别从细胞和蛋白水平验证了OPG基因表达与VSMC凋亡之间存在一定正比关系。OPG基因表达上调,则VSMC细胞凋亡率上升;而通过RNA干扰手段将OPG基因表达下调后,则VSMC细胞凋亡率具有一定程度的下降。
作为抑制基因表达的一种重要手段,RNA干扰近年来在基因治疗领域的应用越来越多。RNA干扰可能被用来治疗由于基因过度表达或异常基因表达引起的疾病。本研究表明,OPG基因的过表达可引起VSMC细胞凋亡。OPG表达与VSMC凋亡具有相关性,可能对动脉瘤形成有一定的作用。但是OPG的表达上调所导致的VSMC凋亡程度是否足以导致AAA的发生以及OPG的RNA干扰能否直接有效地抑制VSMC的凋亡仍需要进一步的动物实验验证以及后续研究。下一步可以考虑将RNA干扰应用于AAA的动物模型中,通过导入特异性抑制OPG基因表达的siRNA,降低OPG基因的表达量,防止VSMC凋亡,维持中膜结构的稳定性,观察其是否能对AAA起到减缓发展速度的作用。
参考文献:
[1] Simonet WS,Lacey DL,Dunstan CR,et al. Osteoprotegerin: anovel secreted protein involved in the regulation of bone density[J].Cell, 1997, 89:309-319.
[2] Golledge J,McCann M,Mangan S,et al. Osteoprotegerin and osteopontin are expressed at high concentrations within symptomatic carotid atherosclerosis[J]. Strok, 2004, 35:1636-1641.
[3] Moran CS,McCann M,Karan M,et al. Association of osteoprotegerin with human abdominal aortic aneurysm progression[J]. Circulation, 2005, 111:3119-3125.
[4] Grimm D,Kay MA. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy[J]. Curr Gene Ther, 2003, 3:281-304.
[5] Snyder RO.Adeno-associated virus-mediated gene delivery[J]. J Gene Med, 1999, l:166-175.
[6] Aoki Y,Cioca DP,Oidaira H,et al. RNA interference may be more potent than antisense RNA in human cancer cell lines [J].Clin Exp Pharmacol Physiol, 2003, 30:96-102.
[7] Fire A,Xu S,Montgomenry MK,et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391:806-811.





