摘 要: 目的 探讨IL-18对人骨髓间充质干细胞(hBMSC)的成骨分化作用。方法 取生长良好的第3代hBMSC每孔2×104个接种于6孔培养板,并随机分成两组。于细胞汇合率为80%~90%时,对照组采用经典成骨诱导液培养,观察组采用经典成骨诱导液+质量浓度为100 ng/m L的重组人IL-18培养液培养。成骨分化诱导1、3、7 d后检测骨特异性转录因子-2(Runx2)、骨形态发生蛋白-2(BMP2)、骨桥蛋白(OPN)mRNA及蛋白表达。两组hBMSC诱导分化7 d后进行碱性磷酸酶(ALP)染色、茜素红染色。结果 两组成骨诱导1、3、7 d,Runx2、BMP2、OPN mRNA及蛋白表达比较差异有统计学意义(P均<0.05)。观察组随诱导时间延长,Runx2、BMP2、OPN m RNA及蛋白表达增加,不同时点Runx2、BMP2、OPN mRNA及蛋白表达差异有统计学意义(P均<0.05)。观察组成骨诱导7 d后ALP染色较对照组明显深染,茜素红染色矿化结节染色区域明显多于对照组。结论 IL-18体外能促进h BMSC向成骨细胞分化。
关键词 : 骨髓间充质干细胞; IL-18;骨特异性转录因子-2;骨形态发生蛋白-2;骨桥蛋白;成骨作用;
Abstract: Objective To explore the effect of IL-18 on osteogenic differentiation of human bone marrow mesenchymal stem cells(hBMSC).Methods The well-growing third-generation hBMSCs were inoculated into 6-well culture plate with 2×104 per well and then were randomly pided into two groups.When the cell confluence rate was 80%-90%,the cells in the control group were cultured with classical osteogenic induction liquid,and the cells in the observation group with classical osteogenic induction liquid+recombinant human IL-18 culture medium with a mass concentration of 100 ng/mL.The bone-specific transcription factor-2(Runx2),bone morphogenetic protein-2(BMP2),and osteopontin(OPN)mRNA and protein expression levels were detected at 1,3,and 7 days after osteogenic differentiation induction.The hBMSCs of the two groups were stained with alkaline phosphatase and alizarin red for 7 days after induction of differentiation.Results There were statistically significant differences in the mRNA and protein expression levels of Runx2,BMP2,and OPN between the two groups at 1,3,and 7 days after induction of differentiation(all P<0.05).In the observation group,over the time of induction,the expression levels of Runx2,BMP2,and OPN mRNA and protein increased,and the differences in Runx2,BMP2,and OPN mRNA and protein expression levels at different time points were statistically significant(all P<0.05).It was observed that at 7 days after osteoinduction,ALP staining was significantly darker in the observation than in the control group,and the staining area of mineralized nodules in alizarin red staining was significantly larger than that of the control group.Conclusion IL-18 can promote the differentiation of hBMSC into osteoblasts in vitro.
Keyword: bone marrow mesenchymal stem cells; interleukin-18; bone-specific transcription factor-2; bone morphogenetic protein-2; osteopontin; osteogenesis;

随着当今社会经济和交通运输业的快速发展,多发性骨折合并脑、肺、腹腔脏器损伤患者有增加趋势,临床治疗面临很多挑战。脾破裂合并肢体骨折是临床常见的高能量多发伤,全脾切除是其首要急救措施。本课题组前期研究发现,复合外伤骨折合并脾破裂而行脾切除的患者中骨折愈合明显延迟,考虑与脾切除后机体免疫炎性功能改变导致与骨折愈合相关的炎性因子明显减少进而影响骨折愈合有关[1,2]。IL-18属于IL-1家族,是前炎症细胞因子之一。研究显示IL-18在骨缺损修复过程中起重要作用,对骨髓间充质干细胞(BMSC)、成骨细胞,破骨细胞均有影响,但具体机制尚不明郎[3,4]。IL-18主要由巨噬细胞产生,而脾脏是机体细胞免疫和体液免疫的中心,内含丰富巨噬细胞、淋巴细胞及炎性因子同时能高效表达IL-18,这些免疫细胞及炎性因子与机体损伤修复密切相关[5,6]。研究表明,骨折后BM-SC会首先募集到骨折处,第一时间参与骨折修复;骨折后BMSC所处的骨折微环境对细胞分化及功能发挥起着重要调节作用,骨损伤后骨折断端局部为血肿炎性微环境[7],炎性细胞因子对BMSC成骨分化可能存在促进或抑制作用。因此有必要进一步探究细胞因子IL-18对BMSC成骨分化的影响。
1 、材料与方法
1.1、 主要材料
人骨髓间充质干细胞(hBMSC,中国医科大学盛京医院干细胞研究中心提供)、重组人IL-18(美国R&D公司)、DMEM-F12培养基(美国Hyclone)、胎牛血清(无锡依科赛)、青霉素、链霉素(大连美伦)、胰蛋白酶(美国Gibco)、地塞米松、β-甘油磷酸钠、抗坏血酸(美国Sigma公司)、茜素红S(碧云天公司)、碱性磷酸酶(ALP)染色试剂盒(碧云天公司)、特异性转录因子-2(Runx2)一抗(Proteintech公司)、骨形态发生蛋白-2(BMP2)一抗(Proteintech公司)、骨桥蛋白(OPN)一抗(Proteintech公司)、GAPDH一抗(Proteintech公司)、兔二抗(北京中杉金桥)、PCR引物、PCR试剂盒、DEPC水和Trizol试剂均购于Takara公司;高速低温离心机和CO2培养箱(美国赛默飞公司)、倒置相差显微镜+图像采集系统(Nikon,Eclipse NI)、荧光定量PCR仪(美国Life technologies,ABI7500 Fast),一次性25 cm2细胞培养瓶、6孔培养板、离心管等细胞培养相关耗材(无锡Nest公司)、细胞破碎仪(美国Next advance,BBY24M)。
1.2 、hBMSC培养
取原代hBMSC置于DMEM-F12生长培养液(含89%F12-DMEM、15%FBS、1%青-链霉素),放于37℃、5%CO2,培养箱内培养24 h后进行首次换液弃除非贴壁细胞,之后每隔48 h进行1次换液,当细胞贴壁大约90%时进行传代,选用长势良好的第3代细胞进行相关实验。
1.3 、经典成骨诱导液的配制
在上述DMEM-F12生长培养液基础上配制成骨诱导液,终浓度分别为:地塞米松1×10-8mol/L、β-甘油磷酸钠3.3 mmol/L、维生素C 16.67 mg/L。无菌条件下用DMEM-F12生长培养液定容至100 mL,充分混匀,4℃保存。
1.4、 hBMSCs分组
取生长良好的第3代hBMSC每孔2×104个接种于6孔培养板,并随机分成两组。于细胞汇合率为80%~90%时,对照组采用经典成骨诱导液培养,观察组采用经典成骨诱导液+质量浓度为100 ng/mL的重组人IL-18培养液培养;每孔2 mL,每48 h更换1次培养液。
1.5、 Runx2、BMP2、OPN mRNA表达检测
两组分别继续培养1、3、7 d后收集细胞,用Trizol充分裂解细胞提取总RNA。PCR反应条件:94℃预变性10min,95℃变性15 s,60℃退火10 s,72℃延伸30s,共40个周期。选用Runx2、BMP2、OPN相应引物序列,人β-actin作为内参,采用实时荧光定量PCR法检测Runx2、BMP2、OPN mRNA表达。
1.6、 Runx2、BMP2、OPN蛋白表达检测
两组分别继续培养1、3、7 d后收集细胞,提取蛋白。SDS-PAGE凝胶电泳:80 V 30 min,120 V 70 min。200mA 70 min将凝胶中蛋白转膜至PVDF膜上,5%脱脂牛奶封闭1.5 h。TBST洗膜,一抗孵育4℃过夜。第2日,常温下二抗孵育2 h。然后PVDF膜用TBST洗3次,每次10 min,ECL曝光。采用Western blotting法检测Runx2、BMP2、OPN蛋白表达,GAPDH作为内参。
1.7、 ALP染色
两组细胞经成骨诱导培养7 d后弃培养液,4%的多聚甲醛1 mL固定15 min,加入DDH2O 1 mL,轻柔冲洗3次。按照BCIP/NBT ALP显色试剂盒说明书配制ALP染色剂染色,室温避光孵育6 h后,轻轻吸去染色试剂,使用DDH2O终止显色反应,在40倍显微镜下观察并拍照。
1.8、 钙结节茜素红染色
两组细胞经成骨诱导培养7 d后进分别用PBS冲洗3次,4%多聚甲醛固定1 min,各组加入DDH2O 1 mL,轻柔冲洗3次。1%茜素红染液(pH 4.2)染色,37℃孵育0.5~1 h,倒掉茜素红染液,DDH2O加入终止反应。在40倍光镜下观察成骨细胞矿化结节形成情况。
1.9、 统计学方法
采用SPSS17.0统计软件进行处理分析。计量资料符合正态分布采用表示,组间比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2、 结果
2.1、 hBMSC生长情况
原代hBMSC接种后约2 h细胞迅速贴壁、伸展恢复成梭形,细胞均匀生长,原代细胞培养4 d后即可进行传代,以后平均4~5 d传代1次,传至第3代时,细胞生长良好呈均一梭形,形态清楚。相差倒置显微镜下观察第3代hBMSC呈长梭形或多角形生长,类似成纤维细胞,细胞体丰满,细胞质均匀。
2.2、 两组Runx2、BMP2、OPN mRNA表达
两组成骨诱导1、3、7 d,Runx2、BMP2、OPN mRNA表达比较差异有统计学意义(P均<0.05)。观察组随诱导时间延长,Runx2、BMP2、OPN mRNA表达增加,不同时点Runx2、BMP2、OPN mRNA表达差异有统计学意义(P均<0.05)。见表1。
表1 两组不同时点BMP2、Runx2、OPN mRNA表达
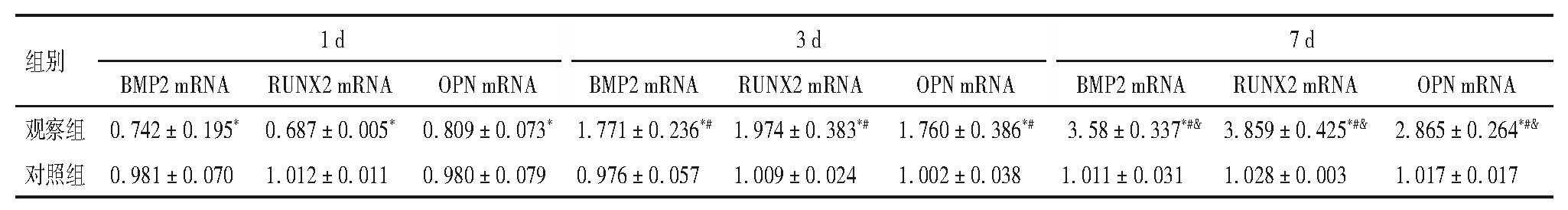
注:与对照组比较,*P<0.05;与本组1 d比较,#P<0.05;与本组3 d比较,&P<0.05。
2.3、 两组Runx2、BMP2、OPN蛋白表达
两组成骨诱导1、3、7 d,Runx2、BMP2、OPN蛋白表达比较差异有统计学意义(P均<0.05)。观察组随诱导时间延长,Runx2、BMP2、OPN蛋白表达增加,不同时点Runx2、BMP2、OPN mRNA蛋白表达差异有统计学意义(P均<0.05)。见表2。
表2 两组不同时点BMP2、Runx2、OPN蛋白表达
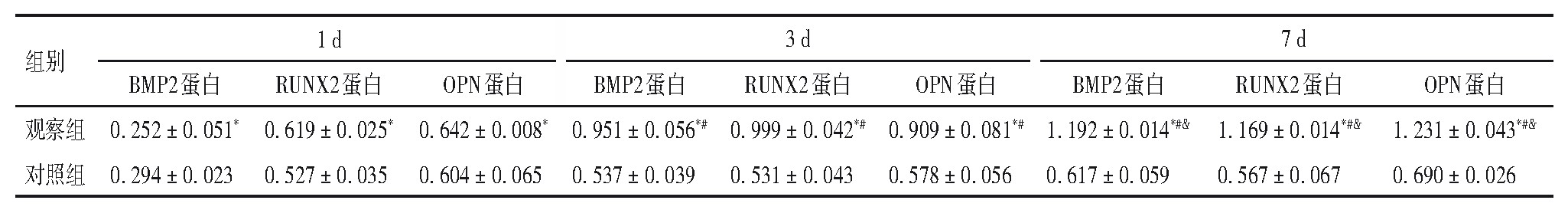
注:与对照组比较,*P<0.05;与本组1 d比较,#P<0.05;与本组3 d比较,&P<0.05。
2.4、 两组ALP染色情况
光学显微镜下观察可见,观察组成骨诱导7 d后酶活性细胞胞质呈蓝色块状沉淀,显色较深;,而对照组则显色较淡。见图1。
图1 两组ALP染色
2.5 、两组茜素红染色情况
观察组成骨诱导7d后其矿化结节明显增多且红色深染,大小不一,呈团块状;对照组矿化结节少且红色浅染。见图2。
图2 两组茜素红染色

3、 讨论
我们前期的临床随访及动物模型证实骨折合并脾切除会造成骨折延迟愈合,这表明脾切除后免疫功能会受到显着影响。骨折后在损伤修复的初始阶段,各种炎性相关的细胞因子被释放在损伤部位同时对骨折组织周围的各类细胞都有着趋化作用及促进增殖、加速修复的作用。骨髓来源的间充质干细胞可分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞等多种细胞以及肌腱、韧带等多种结缔组织[8,9]。IL-18在人体内广泛分布,在抗感染、免疫调节、抗肿瘤、免疫炎症反应中发挥着重要作用[10]。研究显示IL-18可由成骨细胞产生,通过粒细胞/巨噬细胞集落刺激因子(GM-CSF)促进成骨同时抑制破骨细胞活性[11]。并且有研究表明骨质疏松病人经过12个月抗骨质疏松治疗后血中IL-18明显升高且骨密度增加,此研究表明IL-18对骨质疏松患者是一种有益的保护因子[12]。最近研究显示,IL-18抑制破骨细胞形成、促进PTH骨合成代谢作用尤其明显[13]。同时有报道表明IL-18可上调类风湿性关节炎中滑膜细胞破骨形成关键调控因子RANKL的产生,也促进了M-CSF、GM-CSF及OPN的生成[14]。本研究结果显示,hBMSC经成骨诱导7 d后钙化结节的茜素红染色呈橘红色块状和片状,表明IL-18对钙化结节的形成有明显促进作用,可诱导hBMSC向成骨细胞分化。
Runx2属于Runx蛋白家族,能诱导骨髓间充质干细胞向软骨细胞和成骨细胞分化,同时也是骨细胞成熟的关键转录因子。研究发现Runx2也是BMP下游的重要调节因子,在骨修复与重建中发挥重要作用[15]。BMP作为成骨细胞生长的启动因子,可调控细胞核内成骨相关基因的表达从而诱导未分化的BMSC不可逆地分化为成骨细胞,在成骨过程中BM-SC在局部BMP-2的刺激下发生化学趋化、聚集后分化形成软骨和骨[16],BMP2也可通过不同的Smads通路诱导Runx2表达,并可通过调节Runx2等其他成骨相关转录因子来影响BMSC的成骨分化[17]。OPN是一种调节蛋白,可由成骨细胞分泌产生,参与骨的重建、吸收和矿化。研究显示OPN可以明显促进hBMSC的迁移能力,使hBMSC聚集到损伤部位参与骨组织修复[18]。同时OPN被作为成骨细胞分化成熟的标志之一,在发育成熟的成骨细胞中、晚期阶段表达,参与骨基质的矿化和吸收过程。成骨细胞成熟最终会形成钙结节,而钙结节的形成是hBMSC成骨分化的最直接的证据[19]。本研究显示,hBMSC成骨诱导1、3、7 d后,IL-18对hBMSC成骨分化相关的转录因子Runx2、BMP2、OPN在转录水平(mRNA)和蛋白表达水平都有显着影响,且随着干预时间延长呈上升趋势。同时ALP染色结果显示,诱导7 d后,观察组较对照组明显深染,表明IL-18增强hBM-SC的ALP活性,增强诱导成骨分化能力。ALP是反映成骨细胞成熟的重要标志性酶,ALP活性越高表明成骨分化能力越强[20]。
总之,IL-18能明显诱导hBMSC的成骨分化作用,进一步证明脾脏在骨折愈合过程发挥重要作用。因此骨折合并脾损伤需手术治疗时术中应尽量保留脾脏,以保证术后患者免疫功能的稳定。但有关IL-18参与成骨作用的确切机制尚需进一步研究。
参考文献
[1]XIAO W,HU Z,LI T,et al. Bone fracture healing is delayed in splenectomic rats[J].Life Sci,2017,173:55-61.
[2]XIAO W,YANG X,WANG Y,et al. Splenectomy delays fracture healing by affecting the level of tumor necrosis factor alpha ,interleukin 6 and bone morphogenetic protein[J]Adv Clin Exp Med,2018,27(2):165-171.
[3]SCHULZE J,BICKERT T,BEIL F.et al. Interleukin-33 is expressed in diferentiated osteoblasts and blocks osteoclast formation from bone marrow precursor ells[J]J Bone Miner
Res,2011,.26(4):704-717.
[4] HORWOOD N J.Interleukin 18 inhibits osteoclast formation via T cell production of granulocyte macrophage colony-stimulating factor[J].J Clin Invest, 1998,101(3):595-603..
[5]WANG J,SAHOO M.LANTIER L,et al.Caspase 11-dependent pyroptosis of lung epithelial cells protects from melioidosiswhile caspase-1 mediates macrophage pyroptosis and
production of IL-18[]PLoS Pathog,2018, 14():e1007105.
[6]SWIRSKI F K,NAHRENDORF M,.ETZRODT M,et al.ldentification of splenic reservoir monocytes and their deployment to inflammatory sites[J]. Science,2009,325(5940):612-61
[7]LOI F,CORDOVA L A,PAJARINEN J,et al.Inflamation,fracture and bone re pair[J]. Bone 2016, 86(2016):119-130
[8]ZHANG R,MA J,HAN J,et al.Mesenchymal stem cell related therapies for cartilage lesions and osteoarthritis[J] Am J TransI Res ,2019,11(10):6275-6289.
[9]BROWN C,MCKEE C BAKSHI S,et al.Mesenchymal stem ells.cell therapy and regeneration potential[J]J Tissue Eng Regen Med,2019,13(9):1738-155..
[10]Yasuda K,Nakanishi K, Tsutsui H.Interleukin-18 in health and disease[J] Int J Mol Sci,2019,20(3):649.
[1]UDAGAWA N,HORWOOD N J,ELLIOTT J,et al.Interleukin-18(interferon-gamma-inducing factor)is produced by osteoblasts and acts via granulocyte/macrophage colony-stimulating factor and not via interferon-gamma to inhibit osteoclast formation[J]J Exp Med, 1997, 185(6):1005-1112.
[12]MAUGERI D,MAMAZZA C.GIUDICE FLO,et al.Interleukin-8(L -18)and matrix metalloproteinase-9(MMP-9)in postmenopausal osteoporosis[J].Arch Gerontol Geriat,2005.40(3):299-305.
[13]RAGGATT L J,QIN L,TAMASI J,et al.Interleukin-18 is regulated by parathyroid hormone and is required for its bone anabolic actions[J]J Biol Chem,2008,283(11);.6790-6798.
[14]FU Z,LIU P,YANG D,et al.Interleukin-18-induced inflammatory responses in synoviocytes and chondrocytes from osteoarthritic patients[J.Int J Mol Med,2012,30(4):805-810.
[15]VIMALRAJ S ARUMUGAM B,MIRANDA P J,et al Runx2 Structure,function,and phosphorylation in osteoblast difentiation[J]. Int J Biol Macromol,2015,78.202-208.
[16]SALAZAR V S,GAMER L W.ROSEN V.et al. BMP signalling in skeletal development,disease and re pair[J.Nat Rev Endocrinol.2016,12(4):203-221.
[17] ZHOU N,LI Q,LIN X,et al. BMP2 induces chondrogenic dfferntiation,osteogenic diferentiation and endochondral ossification in stem ells[J.Cell Tissue Res,2016,366(1):10
1-111.
[18]李薇,王文平,陈亮等. OPN影响小鼠MSCs迁移及其相关分子机制研究[J]重庆医学,2014.43(4):391-393.426.
[19]WU Y,XIA L,ZHOU Y,et al.lcarin induces osteogenic dfferentiation of bone mesenchymal stem cells in a MAPK dependent manner[J]Cell Prolif.2015.48(3):375-384.
[20]辛红美,许洁,汪长东,等淫羊蓥脊促进MC3T3-E1成骨分化通过Hedgehog信号通路[J]中国药理学通报, 2020,36(5):616-620.





