摘要
目的:维生素 K2 在诊治和预防血管钙化、骨质疏松等方面具有重要作用。但是维生素 K2 在水中溶解度很低,极大地限制了其应用。本文以维生素 K2 为模型药物,制备性能稳定的自乳化药物传递系统,提高药物溶解度。
方法:通过模型药物在各辅料中的溶解度实验,在 37℃条件下,筛选表面活性剂、油相和助表面活性剂,绘制出空白三元相图,并通过星点设计-效应面法,设置电位、粒径以及分散系数为指标来优化处方,确定最优空白液体自乳化处方各成分比例。通过测定最优空白液体自乳化体系对维生素 K2 的最大溶解度以及载药自乳化体系加水乳化后的乳化速率与外观,确定维生素 K2 原料药占液体自乳化体系的比例。以自乳化辅料与微晶纤维素为载体,采用喷雾干燥法,以溶出度、粉体流动性、外观性状为固体自乳化制剂的质量评价指标,得到维生素 K2 固体自乳化制剂。
结果:维生素 K2 自乳化制剂中维生素 K2 含量的测定方法稳定可靠,最优空白液体自乳化处方组为油酸乙酯 40%,聚氧乙烯 40 氢化蓖麻油 40.5%,丙三醇 19.5%,维生素 K2 原料药与液体自乳化体系比例为 1:2,微晶纤维素与载药自乳化体系比例为 4:1.
结论:成功制备出质量可靠、工艺简便的维生素 K2 自乳化制剂,其理化性质各项指标良好。
关键词:维生素 K2,自乳化药物传递系统,三元相图,溶解度,粒径

Abstract
Objective: Vitamin K2 has the function of treating and preventing osteoporosis, preventing liver cirrhosis from developing into liver cancer, and has certain development value. In this paper, we proposed a thermodynamically stable self-emulsifying drug delivery system with vitamin K2 as the model drug to improve drug solubility and dissolution .
Methods: Based on previous literature research, a method for the determination of vitamin K2 was established according to the 2015 edition of Chinese pharmacopoeia. Through the solubility test of the model drug in each auxiliary material, the oil phase, surfactant and cosurfactant were screened out, Blank ternary phase diagram was be drawed under the condition of 37℃。 Furthermore, by means of star-point design-effect surface method, particle size, potential and dispersion coefficient were used as the indexes to optimize the prescription, and the proportion of each component in the optimal blank liquid self-emulsification prescription was determined. By measuring the solubility of vitamin K2 in the blank liquid self-emulsifying system and the emulsifying rate and appearance of the drug loading self-emulsifying system after water emulsification, the optimal proportion of vitamin K2 API in the liquid self-emulsifying system was determined. Vitamin K2 solid self-emulsifying preparation was obtained by taking self-emulsifying auxiliary material and microcrystalline cellulose as carrier, adopting spray drying method, and taking dissolution, powder fluidity and appearance as quality evaluation indexes of solid self-emulsifying preparation.
Results: The method of measuring the content of vitamin K2 in vitamin K2 self-emulsifying preparation is stable and reliable. The best blank liquid self-emulsifying prescription group is ethyl oleate 40%, polyoxyethylene 40%, hydrogenated castor oil 40.5%, glycerin 19.5%, vitamin The ratio of K2 API and liquid self-emulsifying system is 1: 2, and the ratio of drug-loading self-emulsifying system and microcrystalline cellulose is 1: 4. Conclusion: Vitamin K2 self-emulsifying preparation with simple process and stable properties was successfully prepared, and its physical and chemical properties were good.
Keywords: Vitamin K2, Self-emulsifying drug delivery system, Ternary phase diagram, Solubility, The particle size
目录
前言 ……………………………………………… 4
1 研究背景及意义 ……………………………………………… 4
2 SEDDS 的基本概况 ……………………………………………… 4
2.1 处方筛选与优化 ……………………………………………… 5
3 维生素 K2 的基本简介 ……………………………………………… 7
3.1 维生素 K2 促进骨形成及骨矿化 ……………………………………………… 8
3.2 维生素 K2 抑制骨吸收 ……………………………………………… 8
3.3 维生素 K2 与骨质疏松常用制剂的协同增效作用 ……………………………………………… 8
4 研究内容 ……………………………………………… 9
第一部分 自乳化制剂处方前研究 ……………………………………………… 10
1 仪器与材料 ……………………………………………… 10
1.1 实验仪器 ……………………………………………… 10
1.2 实验材料 ……………………………………………… 10
2 含量方法建立及验证 ……………………………………………… 11
2.1 检测波长的确立 ……………………………………………… 12
2.2 色谱条件的确立 ……………………………………………… 12
2.3 溶液配制 ……………………………………………… 12
2.4 专属性 ……………………………………………… 13
2.5 标准曲线的建立 ……………………………………………… 13
2.6 重复性实验 ……………………………………………… 14
2.7 精密度实验 ……………………………………………… 14
2.8 回收率实验 ……………………………………………… 15
2.9 定量限和检测限 ……………………………………………… 15
2.10 溶液稳定性 ……………………………………………… 16
3 原料药稳定性考察 ……………………………………………… 16
4 溶解度试验 ……………………………………………… 16
第二部分 液体自乳化释药系统的制备 ……………………………………………… 18
1 SEDDS 处方的筛选 ……………………………………………… 18
1.1 处方配伍筛选 ……………………………………………… 18
2 体外乳化试验 ……………………………………………… 19
2.1 三元相图的绘制 ……………………………………………… 19
2.2 处方优化 ……………………………………………… 20
2.3 优化处方验证 ……………………………………………… 22
3 稳定性 ……………………………………………… 23
3.1 离心稳定数考察 ……………………………………………… 23
3.2 放置稳定性 ……………………………………………… 23
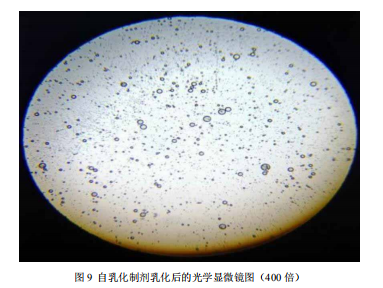
4 自乳化制剂乳化后显微镜照片 ……………………………………………… 23
5 自乳化制剂中维生素 K2 溶解度 ……………………………………………… 24
6 单因素考察自乳化速率的影响因素 ……………………………………………… 24
6.1 pH ……………………………………………… 24
6.2 分散方法 ……………………………………………… 25
6.3 温度 ……………………………………………… 25
6.4 转速 ……………………………………………… 26
6.5 溶液体积 ……………………………………………… 26
6.6 加药量 ……………………………………………… 26
第三部分 固体载体的研究 ……………………………………………… 28
1 固体吸附材料吸附度考查 ……………………………………………… 28
2 水不溶性固体吸附材料释药能力的考察 ……………………………………………… 28
3 维生素 K2 自乳化释药系统的制备 ……………………………………………… 29
4 固体载体与维生素 K2 SEDDS 的比例选择 ……………………………………………… 29
5 维生素 K2 自乳化液固粉末的体外评价 ……………………………………………… 30
5.1 休止角 ……………………………………………… 30
5.2 溶出度考察 ……………………………………………… 30
5.3 重分散性考察 ……………………………………………… 31
5.4 光学显微镜观察 ……………………………………………… 32
5.5 扫描电子显微镜观察 ……………………………………………… 33
第四部分 维生素 K2 的制剂评价 ……………………………………………… 35
1 检查 ……………………………………………… 35
1.1 粒度 ……………………………………………… 35
1.2 水分测定 ……………………………………………… 35
1.3 装量差异 ……………………………………………… 35
1.4 含量测定 ……………………………………………… 36
2 初步稳定性 ……………………………………………… 36
2.1 高温试验 ……………………………………………… 36
2.2 高湿试验 ……………………………………………… 36
2.3 强光照射试验 ……………………………………………… 37
2.4 低温试验 ……………………………………………… 37
2.5 留样实验 ……………………………………………… 38
第五部分 总结与展望 ……………………………………………… 39
参考文献 ……………………………………………… 40
文献综述 ……………………………………………… 45
攻读学位期间取得的学术成果 ……………………………………………… 51
致谢 ……………………………………………… 52
前言
1 研究背景及意义
口服给药是临床中常见给药途径之一,因其制备简便、经济安全、易携带和患者顺应性好等优点受到制剂开发者们广泛关注。然而,许多药效很好的药物却因为水溶性不好,导致其在体内吸收差、生物利用度低而限制其应用和开发。特别是一些具备良好药效的油性药物,因其在水中几乎不溶解,成为开发成药物的重要阻碍,例如多数中药里含有挥发油成分,如大蒜精油、丁香油、罗勒油等,口服制剂只能做成中药口服液,大大地限制其应用[1-7].因此,开发和设计新的给药体系来研究并解决口服生物利用度、难溶性药物的溶出度以及液态药物固体化等引起了药物工作者们极大的兴趣。
多数疏水性药物由于溶解度较低导致在人体内很难被溶解和吸收,这给药物制剂研究者们带来了很大困难。为了解决这些困难,相关研究人员采取了多种制剂方法,包括微粉化、脂质体、渗透吸收剂、固体分散体和纳米粒子等等[8-11].在这些方法中,自乳化给药系统起了关关作用,引起了药学科研工作者的广泛关注。自乳化给药系统(self-emulsifying drug delivery system, SEDDS)[12-13]是由表面活性剂、油相以及助表面活性剂三种成分组成,大多为液体系统。该系统是热力学稳定体系[14],在人体内部具有自发性,在胃肠道上容易形成乳滴。与其它制剂相比,该系统主要解决了水难溶性药物在胃肠道内快速分散、溶解与吸收的问题,显著提高口服生物利用度[15],它有很多优势:①可自发乳化。在 37℃左右,可自发乳化形成粒径小于 500 nm 水包油(O/W)型乳剂[16-17].②提高药物溶出。针对难溶性药物具有增溶能力,能显著促进对药物的吸收[18].③易于吸收。由于自乳化制剂容易在在胃肠道的作用下形成乳滴,从而导致表面积增大便于在短时间被吸收。例如,环孢素 A(CyA)纳米乳可使 CyA 的吸收速度增快,有利于增强药物的治疗效果[19].④对胃肠道的刺激小。由于自乳化制剂在胃肠道容易形成乳滴,可以大大增强与胃肠道的接触面积,使吸收的速度增快,从而降低对胃肠道的刺激[20].SEDDS 选择的模型药物多为水难溶性和脂溶性药物,能显著提高药物在人体内的吸收,增强药物的治疗效果。
2 SEDDS 的基本概况
1980 年,Armstrong 和 James 等人 首次提出关于 SEDDS 的药物脂质释药系统[21],该系统是由药物溶解在两种或多种赋形剂(三酰甘油类、表面活性剂或助乳化剂)中组成的混合物,在位胃肠道体液的作用下维持溶解状态,从而促进疏水性药物的吸收。2000 年,Pouton 等人 将 SEDDS 列为脂质释药系统的第Ⅲ类[22-23].由于该技术自身的优势,1994 年 Neoral?即在德国上市,现已上市的 SEDDS 药物主要为免疫抑制剂环孢素 A、维生素类制剂异维 A 酸和人类免疫缺陷病毒蛋白酶抑制剂等[24],通过查找相关资料,统计出已经上市的部分 SEDDS 药物见表 1.

近年来,由于 SEDDS 的巨大发展潜力,相关药学研究者进行了大量的研究和开发,涌现出很多有价值的成果。本文通过对处方优化、质量评价、剂型新技术研究等方面进行整理,以期为进一步推动 SEDDS 的应用提供参考。
2.1 处方筛选与优化
SEDDS 处方设计基本原则是在保证制剂对药物具有溶解乳化能力的前提下,选用有效、简单、低毒、少量的辅料制备处方[25].自乳化过程与表面活性剂(surfactant,SA)、助表面活性剂(cosurfactant,CoSA)的性质及浓度、油/SA 比值、SA/CoSA比值等有关[23].
2.1.1 处方组成
油相、SA 以及 CoSA 是 SEDDS 基本处方组成。其中影响药物自乳化的重要因素是 SA ,常见的 SA 有聚氧乙烯油酸酯类、聚氧乙烯蓖麻油类(RH)、聚山梨酯-80(Tween-80)以及液态卵磷脂等[26-31].SA 是 SEDDS 产生细胞毒性的主要原因[32],而安全无毒的天然乳化剂是研究方向之一[33].黄嗣航等[34-35]采用阿拉伯胶代替 50%的Tween-80 分别制备盐酸小檗碱和葛根素自微乳,降低了胃肠道毒性。在自乳化系统中,需要 CoSA 协助 SA 具有负表面张力而形成微乳,实现将亲水性表面活性剂和疏水性药物溶解在 SEDDS 基质中[36].目前常用的 CoSA 有乙醇、甘油、丙二醇、聚乙二醇(PEG)及聚甘油酯等[36].
刘丹等[37]根据溶解度筛选银杏黄酮组分自微乳处方时,无水乙醇溶解度均显著高于其他助乳化剂,其 SEDDS 作为黏合剂制备微丸,使辅料的用量减少。对于有些中药含有挥发油的复方或本身即为挥发油,可以直接作为处方中的油相,成为中药挥发油 SEDDS[38].王超等人[39]制备 β-榄香烯自微乳时,鉴于 β-榄香烯成分为挥发油类,经探究出溶解度满足油相使用的条件,可直接作为油相使用,从而显著提高了载药量。
2.1.2 处方优化方法
2.1.2.1 伪三相图法
伪三相图是将 3 个顶点所代表的混合物替代三元相图中的纯物质,来确定有效的成乳区域,是研究微乳形成区域的基础工具。苏菊等人[40]采用伪三元相图探究助乳化剂与乳化剂的比例,筛选丹皮酚自微乳的处方,以 Tween-80 为乳化剂:薄荷油为油相:无水乙醇为助乳化剂(6:2:2),具有较好的药剂学性质,小鼠体外透皮试验 SEDDS体外释药量是其软膏剂的 1.37 倍。
2.1.2.2 正交实验
多因素多水平的正交试验设计法在自乳化处方选择和优化中应用较多。卢秀霞等人[41]在丹参酮ⅡA自微乳的处方制备工艺研究中,以 SA、油和 CoSA 为考察因素,通过设计正交试验筛选出辅料为 Tween-80、油酸乙酯以及 PEG4400,绘制伪三元相图确定辅料比例为 4:5:1,以增溶剂为参比制剂比较体外溶出度,SEDDS 制剂释药速度快。
2.1.2.3 响应面分析方法
响应面分析方法(response surface analysis method,RSM)中最常用的方法有星点设计(central composite design,CCD)和 Box-Behnken 设计(Box-Behnken design,BBD),该方法需要的试验次数较少,可以分析各因素之间的相互作用,试验设计和结果表达方面效果较好,预测能力好等。陈笑等[42]采用操作简单的 CCDRSM 优化莲心总碱自微乳处方,通过验证试验和载药量考察表明方法预测性良好。Box-Behnken试验设计具有实验次数少,试验点都在安全区域内等特点,较适用于对安全指标要求高的处方。张南生等人[43]以粒径和载药量为指标,利用 Box-Behnken 试验设计法优化人参皂苷 Rg3 自乳化制剂的最优处方,测量值与预测值吻合得很好。
2.1.2.4 单纯性网格法
以空间图形淘汰法通过因素间量的相互约束来影响指标进行处方优选。杨露等[44]
采用单纯形网格法优选柿叶总黄酮自微乳处方,以粒径、多分散指数及载药量为评价指标,考察油相、乳化剂、助乳化剂的比例,最佳处方 20 min 时累计溶出率为 89.09%.
2.1.2.5 小结
适用条件是辅料已确定,考察处方组成的比例,单纯形网格法要求处方量恒定。
星点设计、Box-Behnken 设计及单纯形网面法的评价方法均为响应曲面法,预测能力好。表 2 列出 5 种常用优化方法的评价手段、优点与不足的比较分析[40-44].
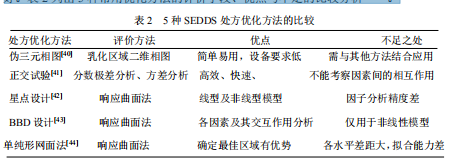
本文研究考虑实际需求,主要选用星点设计和三元相图法。
3 维生素K2 的基本简介
维生素 K 英做凝血维生素,天然的维生素 K 分为两种:维生素 K2 与维生素 K1.
维生素 K2 外形为黄色晶体,是脂溶性维生素,溶于醚等有机溶剂,难溶于水。
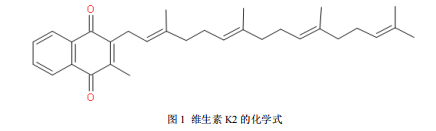
维生素 K2 由维生素 K1 在肠道的细菌或其他组织作用下产生的。维生素 K2 有多个种类,根据碳原子多少,可分为 MK-4、MK-7 等。维生素 K2 的名英为 2-甲基-1,4 奈醌的衍生物[45],其中 MK-4 化学式见图 1.
维生素 K1 的半衰期较短,在人体 8 小时内会被肝脏自动代谢清除。与之相比,维生素 K2 可达 72 小时,半衰期较长,这表明维生素 K2 具有更长的生物活性。除此之外,维生素 K2 容易被吸收,也具有更多的益处。这些极大地加强了人们对维生素K2 的使用,为消除维生素 K 缺乏症奠定了基础。
维生素 K2 有益于心血管和骨骼健康,近年来有大量研究表明,骨折的发生与维生素 K 摄入的关系紧密[46-47],是骨骼代谢的重要影响因素3.1 维生素K2 促进骨形成及骨矿化日本多位相关研究者报道,从小吃纳豆的日本儿童比一般儿童出现生长痛的概率小很多。此外,日本老年人群的长寿水平高,骨骼健康与常年服用纳豆的关系密切,而纳豆中富含维生素 K2.因此,日本相关研究者们进行了大量的关于骨骼健康与维生素 K2 的科学研究[48-50].有研究证明,老年人群骨质疏松症与缺乏维生素 K2 有密切关系 [51].从药剂学角度看,维生素 K2 能有效加强骨矿化速度,血液中 Ca2+只有足量维生素 K2 的作用下才能保证其有效矿化与沉积在骨骼上[52-53].在骨钙素成长过程中,老年人更容易缺乏维生素 K2,导致 Ca2+不能有效结合骨钙素,从而抑制了骨骼矿化。所以相关研究人员建议把维生素 K2 的含量作为判断骨质疏松等相关症状的重要依据[54].
3.2 维生素K2 抑制骨吸收
维生素 K2 能较强地抑制人体骨钙的流失,可通过抑制溶体酶有效预防骨基质遭到溶体酶的降解[55-56].在维生素 K2 干预下,用双能 X 射线观察去卵巢老鼠的骨量流失实验证明,维生素 K2 能抑制骨吸收[57],特别是对骨小梁微观结构具有显著的抑制骨吸收作用[58].而针对骨矿化和骨转化研究应用于健康妇女人群中表明,维生素 K2具有分化破骨细胞前体细胞、促进骨形成等作用[59].
3.3 维生素 K2 与骨质疏松
常用制剂的协同增效作用钙是骨矿化的关关元素,人体一旦缺乏钙元素,就会抑制维生素 K2 的骨矿化作用。在过去的认识和实践研究表明,钙盐在人体中基本充足,尽管如此,骨质疏松症状并没有因为高钙盐注入消失匿迹。目前有研究表明,长期摄入补充钙剂和心血管硬化、脑中风以及大面积心肌梗死等疾病关系密切[60],所以长时间以来,人们普遍认为的缺钙是骨质疏松症根源的观念是错误的。维持正常心血管健康以及骨骼的钙代谢关关成分是维生素 K2,一旦缺乏就会中断人体的钙调节平衡。同时,维生素 K2 能有效激活 MGP(γ-羧化谷氨酸残基蛋白),MGP 具有调节软骨代谢、阻止软组织矿化以及抑制软骨矿化等作用[60-61],这种巧妙的调钙作用机制,能够将钙运输到正确的人体器官组织,从而能完美的解决动脉钙化与骨质疏松症的难题。
第五部分总结与展望
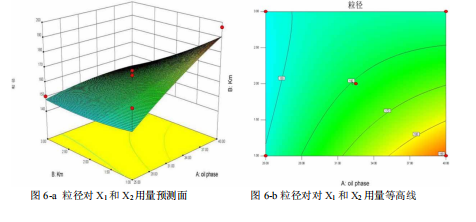
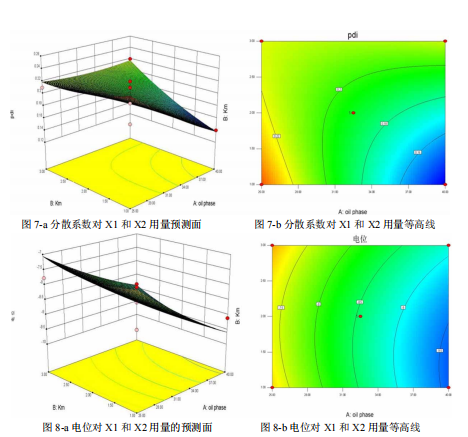
1、采用 HPLC 法建立本品中建立了维生素 K2 制剂含量和体外释放度的检测方法,进行了方法学验证,含量、释放度的精密度和准确度等都符合要求,证明建立的维生素K2 制剂检查的方法准确可靠,可用于制剂开发中的质量控制。通过 VK2 在不同辅料中的溶解度实验得出,在乳化剂聚氧乙烯 40-氢化蓖麻油中溶解度最大,而在各油相中溶解度差异不大。RH-40 与各油相进行配伍实验,根据乳化效果,最后选择 RH-40作为表面活性剂,选择 Gly 作为助表面活性剂,把油酸乙酯作为油相制备来液体自乳化释药系统(L-SEDDS)。通过绘制三元相图,确定油相比例 25%-40%,表面活性剂和助表面活性剂在各油率下的质量比 Km 范围为 1-3.然后使用星点设计-效应面优化法,借助 Design expert 软件设计实验处方,以自乳化体系分散后的乳滴粒径、电位、分散系数作为考察指标优化处方,确定最优处方油酸乙酯:聚氧乙烯 40 氢化蓖麻油:
甘油的质量比为 40%:40.5%:19.5%. 2、探究分散介质体积、pH 值、温度、转速、分散方法、加药量对液体自乳化体系形成速率的影响,考察最有处方液体自乳化体系稳定性。以吸附度和释放度为指标对固体吸附材料进行考察,选用吸附性较好,释放度较好的微晶纤维素为固体吸附材料。
将微晶纤维素与载药 S-SEDDS 以 4:1 比例混合,用喷雾干燥法制得流动性较好的 VK2固体自乳化粉末,并对其休止角、溶出度、重分散性、形态特征进行考察。
3、维生素 K2 固体自乳化肠溶胶囊的外观、装量差异、性状、含量等方面进行考察,检查均符合要求标准。稳定性研究表明本制剂在高湿、高温和强光照射、低温的影响因素条件下,其含量和外观没有发生变化,均在限量范围内。在留样试验中,把自乳化胶囊密封放置 3 个月后,检查各项指标均无变化,且符合质量标准规定,说明本品制备工艺稳定,质量可控。
4、维生素 K2 固体自乳化制剂体内生物利用度的提升需要近一步验证,维生素 K2 固体自乳化制剂相关杂质以及体内毒性检验需要进一步实验,基于自乳化制剂的相关研究仍需大量的工作。
参考文献
[1]靖博宇,郑霞,杨瑞,赵佳,金薇,于绍军。中药固体自乳化药物传递系统的发展及应用[J].辽宁中医药大学学报,2014,16(03):214-216.
[2]吴文婷,邹斌,李文栋,朱卫丰。葛根素口服给药的药剂学研究进展[J].中国中药杂志,2019,44(19):4134-4141.
[3]Su J Z, Gong Y L, Mei L Y, et al. The characteristics of glucose homoeostasis in grasscarp and Chinese longsnout catfish after oral starch administration: a comparative studybetween herbivorous and carnivorous species of fish.[J]. The British journal of nutrition,2020,123(6):627-641.
[4]Torchilin V P , Lukyanov A N . Peptide and protein drug delivery to and into tumors:
challenges and solutions[J]. Drug Discovery Today, 2003, 8(6):259-266.
[5]Merisko-Liversidge E. Nanocrystals: Resolving pharmaceutical formulation issuesassociated with poorly water-soluble compounds[J]. Particles. Orlando: Marcel Dekker,2002,13(2):578-584.
[6]Terwogt J M M , M.M. Malingré, Beijnen J H , et al. Coadministration of oralcyclosporin A enables oral therapy with paclitaxel[J]. Clinical Cancer Research, 1999,5(11):3379-3384.
[7]Britten C D, Baker S D, Denis L J, et al. Oral paclitaxel and concurrent cyclosporin A:targeting clinically relevant systemic exposure to paclitaxel[J]. Clinical cancer research,2000, 6(9): 3459-3468.
[8]李思敏,吴文瀚,高丽娜,张蕾,吴诗涵,刘雨萌,周忠民,乔宏志。柠檬苦素脂质体的制备和制剂学评价[J].中草药,2019,50(24):5957-5962.
[9]梁慧,倪兆成,颜美秋,俞静静,吕圭源,陈素红。乳香超微粉的制备工艺及理化性质研究[J].中草药,2017,48(07):1321-1326.
[10]Ioannis T, Georgia K. Pouroutzidou, Evgenia L, et al. Effect of ion doping insilica-based nanoparticles on the hemolytic and oxidative activity in contact with humanerythrocytes[J]. Chemico-Biological Interactions,2020,318(4):1678-1683.
[11]Basha M,Salama A, Noshi S H. Soluplus? based solid dispersion as fast disintegrating tablets: a combined experimental approach for enhancing the dissolution and antiulcerefficacy of famotidine.[J]. Drug development and industrial pharmacy,2020,46(2):289-293.
[12]Nokhodchi A, Hentzschel C M, Leopold C S. Drug release from liquisolid systems:speed it up, slow it down[J]. Expert opinion on drug delivery, 2011, 8(2): 191-205.
[13]李伟男,孙佳琳,王锐。自乳化药物传递系统的研究进展及存在问题[J].中国新药杂志,2014,23(19):2261-2265.
[14]Gao P, Rush B D, Pfund W P, et al. Development of a supersaturable SEDDS (S‐SEDDS) formulation of paclitaxel with improved oral bioavailability[J]. Journal ofpharmaceutical sciences, 2003, 92(12): 2386-2398.
[15]Shah N H, Carvajal M T, Patel C I, et al. Self-emulsifying drug delivery systems(SEDDS) with polyglycolyzed glycerides for improving in vitro dissolution and oralabsorption of lipophilic drugs [J]. Int J Pharm, 1994, 106(1): 15-23.
[16]Rege B D, Kao J P Y, Polli J E. Effects of nonionic surfactants on membranetransporters in Caco-2 cell monolayers[J]. European journal of pharmaceutical sciences,2002, 16(4-5): 237-246.
[17]Constantinides P P. Lipid microemulsions for improving drug dissolution and oralabsorption: physical and biopharmaceutical aspects [J]. Pharm Res, 1995,12(11):1561-1572
[18]Kommuru T R, Gurley B, Khan M A, et al. Self-emulsifying drug delivery systems(SEDDS) of coenzyme Q10: formulation development and bioavailability assessment[J].International journal of pharmaceutics, 2001, 212(2): 233-246.
[19]张阳德。 纳米药物学[M]. 化学工业出版社, 2006.
[20]Charman S A, Charman W N, Rogge M C, et al. Self-emulsifying drug deliverysystems: formulation and biopharmaceutic evaluation of an investigational lipophiliccompound[J]. Pharmaceutical research, 1992, 9(1): 87-93.
[21]Armstrong, N.A, James, K.C. Drug release from lipid-based dosage forms. II[J].International Journal of Pharmaceutics, 1980, 6(3):195-204.
[22]Pouton C W. Lipid formulations for oral administration of drugs: non-emulsifying,self-emulsifying and 'selfmicroemulsifying' drug delivery systems [J]. Eur J Pharm Sci,2000, 11(Suppl 2): S93-S98.
[23]Pouton C W. Formulation of self-emulsifying drug delivery systems [J]. Adv DrugDeliv Rev, 1997, 25(1):47-58.
[24]Gibaud S, Attivi D. Microemulsions for oral administration and their therapeuticapplications [J]. ExpOpin Drug Deliv, 2012, 9(8): 937-951.
[25]Pouton C W, Porter C J. Formulation of lipid-based delivery systems for oraladministration: materials, methods and strategies [J]. Adv Drug Deliv Rev, 2008, 60(6):625-637.
[26]邹娅,徐应淑,张德华等。地榆皂苷自乳化药物传递系统的制备及质量评价[J].中草药,2018,49(6): 1317-1323.
[27]周立,刘裕红,贾俊。难溶性中药姜黄素自乳化微球的制备及性质考察 [J]. 临床合理用药杂志, 2015, 8(15): 31-33.
[28]杨志欣,张文君,刘明玉等。三叶豆紫檀苷磷脂复合物自微乳研制及跨膜转运研究[J].中草药,2016,47(4):573-579.
[29]Bhattacharyya A, Bajpai M. Oral bioavailability and stability study of aself-emulsifying drug delivery system(SEDDS) of amphotericin B [J]. Curr Drug Deliv,2013,10(5): 542-547.
[30]Gu Z, Shi X, Omari-Siaw E, et al. Self-microemulsifying sustained-release pellet ofGinkgo biloba extract: Preparation, invitro, drug release and pharmacokinetics study inbeagle dogs [J]. J Drug Deliv Sci Technol, 2017,37: 184-193.
[31]Djekic L, Jankovic J, ?alija B, et al. Development of semisolid self-microemulsifyingdrug delivery systems(SMEDDSs) filled in hard capsules for oral delivery of aciclovir [J].
Int J Pharm, 2017, 528(1): 372-380.
[32]Rebello S, Asok A K, Mundayoor S, et al. Surfactants:toxicity, remediation and greensurfactants [J]. Environ Chem Lett, 2014, 12(2): 275-287.
[33]Cornaire G, Woodley J, Hermann P, et al. Impact of excipients on the absorption ofP-glycoprotein substrates in vitro and in vivo [J]. Int J Pharm, 2004, 278(1):119-131[34]黄嗣航,龙晓英,袁飞,等。含天然乳化剂的盐酸小檗碱自微乳的制备与体内外性能评价[J].中国新药杂志,2012, 21(23): 2794-2799.
[35]黄嗣航,龙晓英,袁飞等。含天然乳化剂的新型葛根素自微乳与传统自微乳体内外性能的对比研究[J].中国药学杂志, 2014, 49(17):1530-1534.
[36]Vishal P. Self micro-emulsifying drug delivery system: A lipid based drug deliverysystem [J]. Int J Pharm Sci Res,2016, 7(2): 443-452.
[37]刘丹,张露,张振海等。银杏黄酮组分自微乳-微丸释药系统的构建[J].中草药,2017,48(16):3377-3383.
[38]杨波,周阳,王福玲等。纳米载药系统在中药挥发油中的研究进展[J].药学研究,2018,37(1):46-49.
[39]王超,李兆明,苗建武等。含皂苷的 β 皂榄香烯自微乳制备工艺的研究[J].中成药,2011,33(3): 435-438.
[40]苏菊,吴朝花,姜丰等。丹皮酚自微乳经皮给药系统的处方优选及药剂学性质评价[J].
中国实验方剂学杂志, 2017, 23(17):11-16.
[41]卢秀霞,何琳,陈锦娜等。丹参酮Ⅱ_A 口服自微乳的制备及其体外溶出度评价[J].中草药, 2014, 45(22):3256-3265.
[42]陈笑,富志军。星点设计-效应面法优化莲心总碱自微乳处方[J].中成药,2016,38(7):1490-1495.
[43]张南生,郭虹,孙卫军等。 Box-Behnken 试验设计法优化人参皂苷 Rg3 自乳化释药系统和质量评价 [J]. 中草药, 2015, 46(23): 3500-3506[44]杨露,李小芳,罗佳等。单纯形网格法优选柿叶总黄酮自微乳处方 [J].中国实验方剂学杂志, 2016, 22(24): 13-17.
[45]孙家慧。高效液相色谱法快速测定维生素 K_2[J].天津化工,2011,25(06):55-56.
[46]方瑞斌,雷泽,刘忠厚。维生素 K_2 与骨健康[J].中国骨质疏松志,2013,19(02):191-198.
[47] Noriko K, Mariko S, Yuko T, et al. Low-dose vitamin K2 (MK-4) supplementation for12 months improves bone metabolism and prevents forearm bone loss in postmenopausalJapanese women[J]. Journal of Bone and Mineral Metabolism, 2014, 32(2):142-150.
[48]Cees V, Elke T . Vitamin K, osteoporosis and degenerative diseases ofageing.Menopause International, 2011, 17 :19 -23.
[49]邹志强。维生素 K2 的研究进展。中国骨质疏松杂志,2005,11 ( 3 ):389 -392.
[50王理明。维生素K2与骨质疏松。四川省卫生管理干部学院学报,2007,26(4) :392-592.
[51]Hirota T,Hirota K.Osteoporosis and intake of vitamins.Clin Calcium,2005,15:854-857.
[52]罗晓茹。维生素 K2 在治疗绝经后骨质疏松症中的作用。外国医学 药学分册,2006,33( 5):379-380.
[53]裴福兴,刘洋译。骨质疏松营养学。北京:人民卫生出版社,2009.
[54] Cees V.Vitamin K: the effect on health beyond coagulation - an overview.Food&Nutrition Research,2012,56:5329 -5335.
[55] 刘忠厚主编。骨矿与临床,中国科学技术出版社,北京: 2006.
[56] 雷泽,付正启,木晓云等。维生素 K2-新型骨质疏松防治药物。中国骨质疏松杂志,2010,16( 1) : 60-63.
[57] Kobayashi M, Hara K, Akiyama Y. Effects of Vitamin K2 (Menatetrenone) on CalciumBalance in Ovariectomized Rats[J]. Japanese Journal of Pharmacology, 2002, 88(1):55-61.
[58] Iwasaki Y, Yamato H, Murayama H, et al. Menatetrenone Prevents OsteoblastDysfunction in Unilateral Sciatic Neurectomized Rats[J].Japanese Journal of Pharmacology,2002, 90(1):88-93.
[59] Yamauchi M,Yamaguchi T,Nawata K, et al. Relationships between undercarboxylatedosteocalcin and vitamin K intakes, bone turnover, and bone mineral density in healthywomen[J]. clinical nutrition, 2010, 29(6):761-765.
[60] Anne BV, Vitamin K2 and arterial calcification. Agro Food Industry Hi-tech,2008,19:9-13.
[61] Beulens J W,Bots M L,Atsma F,et al.High dietary menaquinone intake is associatedwith reduced coronary calcification. Atherosclerosis, 2009, 203: 489-493.
[62] 周建烈,陈杰鹏,段丽丽,张美侠,曲国春,徐峰,邓意辉。 维生素 K2(MK-7)防骨质疏松的作用机制研究进展[J].中国骨质疏松杂志,2019,25(04):539-545.
[63] 郭彬,胡雪松,彭方毅。维生素 K 对骨质疏松症的研究进展[J].中国医药导报,2018,15(07):47-50.
[64] 虞陆超,程晏,周强,等。VK 对骨质疏松症患者特征性的骨转换指标、骨密度的影响[J].中国实验诊断学, 2016, 20(10): 1690-1693.
[65] 李芙蓉, 吴瑶, 黄学荪,等。 三元相图法研究更昔洛韦自微乳化释药系统处方[J],中国现代应用药学, 2013, 30(8):873-876.





