
甘油三酯(triglyceride,TG)是人体内含量最多的脂类,是体内能量的主要来源.TG 检测是一项重要的临床血脂常规测定指标.血清甘油酯测定方法可分为化学法、酶标板法和色谱法 3 大类.化学法因操作步骤繁多、技术要求高而不适于常规工作应用.
核素稀释 / 气相色谱 / 质谱技术(ID / GC / MS)主要用作参考系统中决定性方法的建立及参考物质的制备与定值,该方法费用昂贵,样品处理复杂,难以推广应用.酶标板法具有简便快速、微量、精密度高的优点,且特异性强,易于达到终点,线性范围宽,故临床实验室应用最为广泛[1].
武汉生物制品研究所有限责任公司(以下简称武汉公司)血液制剂研究室研发的人血浆蛋白层析法纯化工艺,主要过程为原料血浆经过各种亲和层析及离子交换层析等步骤,依次获得多种血浆蛋白制品.杂质是影响血液制品特性及质量的重要因素.研发过程中曾发现层析法纯化的人血白蛋白(humanserum albumin,HSA)巴氏灭活后有不同程度的浑浊,但巴氏灭活前后样品中白蛋白(albumin,ALB)的含量未见明显变化,可能为血浆中的脂类析出.为了提高产品质量,我们对工艺样品的 TG 净含量进行监控,并以此指标来指导工艺的优化.经检测发现,工艺样品中确实含有 TG,采用去脂剂(lipid removal agent,LRA)优化工艺去除后,人血白蛋白原液外观为澄明液体,符合《中国药典》三部(2010 版)相关规定[2].
本实验优化了酶标板法检测 TG 净含量的方法,进行验证后,将其应用于监测人血白蛋白层析纯化工艺中样品的脂类含量,对工艺优化提供了指导.
1 材料与方法
1. 1 样品 4 批原料血浆样品包括 13001、13002批血浆和 13003、13004 批冷沉淀上清;201307003 及201307004 批人血白蛋白纯化工艺样品包括原料血浆、血浆过滤后、纤维蛋白溶解酶原的亲和层析流穿液(Pg-FT)、纤维蛋白原亲和层析的流穿液(Fg-FT)、IgG 亲和层析的流穿液(IgG-FT)(加 LRA 前)、白蛋白亲和层析上柱液(ALB-Load,加 LRA 后样品)、Alb洗脱液(ALB-Elu);LRA 小试样品 13004 LRA2-61、13004LRA2-62,均由本公司血液制剂研究室提供.
1. 2 标准品 标准品[TG 及游离甘油(free glycerin,FG)的起始浓度分别为 2. 5 和 0. 26 mg / ml],批号:SLBF4338,为美国 Sigma 公司产品.
1. 3 主要试剂及仪器 TG 试剂盒(批号:SLBD0025)[内含FG检测试剂,批号:SLBB4986V;TG检测试剂,批号:SLBB9109V]及LRA(批号:39339V)均为美国Sigma公司产品;多功能酶标仪SpectramaxPlus384及分析软件SoftMaxPro.5.2为美国MolecularDevices公司产品.
1. 4 酶标板法检测 TG 净含量方法的建立1. 4. 1 FG 检测试剂和 TG 检测试剂的处理 按试剂的标示量用注射用水分别将试剂盒中的 FG 和 TG检测试剂复溶,迅速颠倒混匀,置 2 ~ 8 ℃避光保存.
1. 4. 2 标准品及质控品溶液的制备 将标准品平衡至室温,用注射用水进行 2 倍系列稀释,共 8 个稀释度,TG 浓度从 2 500 ~ 19. 5 μg / ml.用注射用水按 1 ∶ 5 和 1 ∶ 10 稀释标准品,制备 2 个质控品,浓度在标准品系列的中段,TG 浓度分别为 500 和250 μg / ml.
1. 4. 3 样品处理 样品可直接用于检测,如检测结果高出检测范围,则稀释样品直至检测值在线性范围内.
1. 4. 4 检测方法 开启酶标仪 Softmax 软件的脂类-TG 测定模板,设定波长为 540 nm,开启加热功能,使装微量滴定板的托盘预温到 37 ℃,并持续在37 ℃保温.分别取 50 μl 注射用水(空白)、标准品系列、质控品系列或样品加至相应的反应管中,每管加入 FG 检测试剂 0. 8 ml,混匀 2 ~ 3 s 后,转移至 96 孔板,200 μl / 孔,每个样品作 3 个复孔,将96 孔板置于酶标仪托盘中,(37 ± 1)℃孵育 5 min,用酶标仪检测 A540值,此为 FG 的吸收值;第 1 次读数结束,取出 96 孔板,加入 TG 试剂,50 μl / 孔,混匀,同上进行第 2 次孵育和读数,此为 TG 的吸收值.
1. 4. 5 结果计算 以标准品系列的 FG 浓度为横坐标,以相应浓度的 FG 吸收值为纵坐标,绘制 FG 含量标准曲线,按一次方程拟合标准曲线,计算线性的相关系数,并计算质控品中的 FG 含量;以标准品系列的 TG 浓度为横坐标,相应浓度的 TG 吸收值为纵坐标,绘制 TG 含量标准曲线,按一次方程拟合标准曲线,计算线性的相关系数,并计算质控品中的TG含量.TG 含量减去 FG 含量即为 TG 净含量.
1. 5 方法的验证
1. 5. 1 标准曲线线性范围的确立 将标准品作 2倍稀释系列(共 7 个稀释度),使 TG 浓度从 2 500 ~19. 5 μg / m(lS1 ~ S7),作为标准品系列;将标准品一步稀释至不同浓度(1 500、500、234. 5、58. 5 μg / mlTG)覆盖在标准曲线的高值和低值区作为质控品系列(C1 ~ C4).每个浓度的样品重复测定 3 次,计算各浓度样品的吸光度均值,分别以 FG 和 TG 的浓度对其相应的吸光度值做线性回归,R2应均不低于0. 99,各个稀释度的变异系数(CV)不大于 15%.计算 2 条标准曲线下各稀释度质控品的 FG 和 TG 的回收率(可接受标准为 90% ~ 110%),确定标准曲线的线性范围.
1. 5. 2 准确度 取 TG 浓度为 2 500 μg / ml 的标准品和样品 13004LRA2-62,以 0 ∶ 1、1 ∶ 7、1 ∶ 3 和 1 ∶ 1(即低、中、高浓度)的比例混合,按建立的方法进行检测.取平均值计算样品中 FG、TG 含量及 TG 净含量,并计算回收率(可接受标准为 90% ~ 110%).
1. 5. 3 精密度1. 5. 3. 1 重复性 取样品 13004LRA2-61,按建立的方法,由同一个实验员在同一试验中连续测定 6 次,计算 CV(可接受标准为 CV ≤ 10%).
1. 5. 3. 2 中间精密度 取样品 13004LRA2-61,按建立的方法,由不同的实验员在不同日期内分别测定 3 次,计算 CV(可接受标准为 CV ≤ 10%).
1. 6 方法的初步应用
1. 6. 1 TG 含量的检测在蛋白纯化工艺中的应用用建立的方法检测 4 批混合原料血浆中的 TG 净含量,初步建立工艺数据;检测 201307003 和 201307004批中间品(原料血浆、Pg-FT、Fg-FT、IgG-FT)的 TG 净含量,监测工艺流程中 TG 的流向.
1. 6. 2 LRA 在白蛋白纯化工艺中的应用 取201307004 批 IgG-FT,采用低温乙醇法制备白蛋白常用的硅藻土浓度,处理样品,经 1 μm 滤膜过滤后,收集上清;取同批 IgG-FT,加入不同量的 LRA(A、B、C 方案),LRA 用量:A 方案 = C 方案 < B 方案,搅拌时间:A 方案 < B 方案 = C 方案,经 1 μm 滤膜过滤后,收集上清.用建立的方法检测 TG 净含量,分析各组检测结果,获得 LRA 最佳应用条件.
2 结 果
2. 1 酶标板上的 TG 净含量检测方法的建立 检测结果显示,FG 的标准曲线线性回归方程为 Y = 0. 002 +0. 003 93 X,R2= 0. 999;TG 的标准曲线线性回归方程为 Y = 0. 061 2 + 0. 000 407 X,R2= 1;2 个质控品系列的回收率在90% ~ 110%,CV < 10%.表明由传统的试管法改为酶标板法是可行的.因为S-8的A540值极低,且 CV > 10%,故标准曲线范围暂定在S-1 ~ S-7.
2. 2 方法的验证
2. 2. 1 线性范围 FG 的标准曲线线性回归方程为:Y = 0. 005 25 + 0. 004 11 X,R2= 0. 997;TG 的标准曲线线性回归方程为:Y = 0. 009 74 + 0. 000 427 X,R2= 0. 997.质控品 4(TG:58. 5 μg / ml,FG:6 μg / ml)回收率不合格,因此,确定该方法检测的线性范围在S-1 ~ S-6 (即 TG:78 ~ 2 500 μg / ml;FG:8. 13 ~260 μg / ml)之间.见表 1 和表 2.
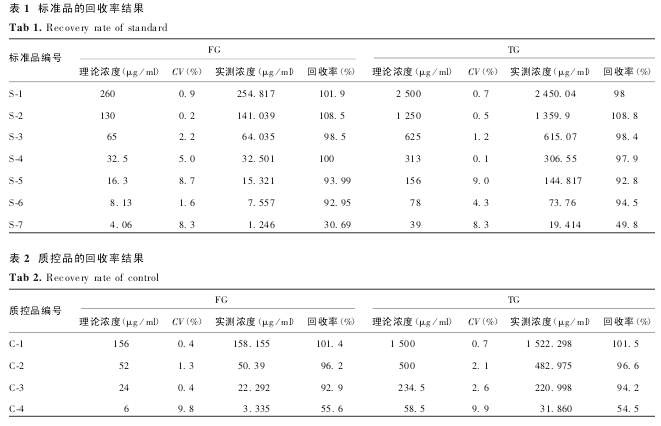
2. 2. 2 准确度 检测结果显示,在标准曲线的有效范围内,各样品的 CV 均< 4%,回收率在 102% ~107%之间,准确度较好.见表 3.
2. 2. 3 精密度 检测结果显示,同一样品由同一个实验员在同一试验中连续测定 6 次和由不同的实验员在不同日期内分别测定 3 次的结果的 CV 均<3%,精密度较好.见表 4 和表 5.
2. 3 方法的初步应用
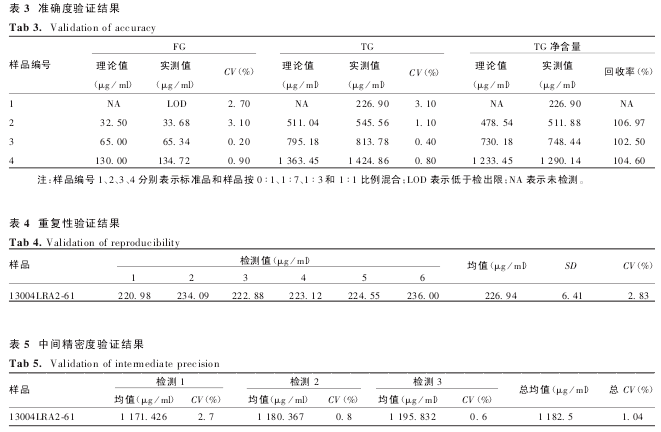
2. 3. 1 TG 含量的检测在蛋白纯化工艺中的应用检测结果显示,4批混合原料血浆(13001、13002批血浆及 13003、13004 批冷沉淀上清)的 TG 净含量分别为1 388. 256、1 161. 504、1 388. 651、1 280. 362 μg / ml.冷沉淀前后血浆中脂类含量未见明显变化.2013-07003 和 201307004 批原料血浆及 3 步亲和层析的流穿液检测结果显示,血浆中的脂类物质随着工艺走向主要存在于亲和层析的流穿液中,见表 6.
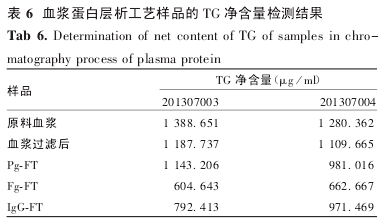
2. 3. 2 LRA 在白蛋白纯化工艺中的应用 结果显示,在白蛋白分离纯化工艺中采用去脂剂可将脂类去除,效果优于硅藻土.综合 LRA 用量,工艺时间等因素,将 B 方案作为最终方案,见表 7.
3 讨 论
TG 的检测目前在临床上主要用于监测不同阶段的人群的TG.TG的正常参考值为:儿童< l 000 μg / ml(1. 13 mmol / L),成人< 1 500 μg / ml(1. 7 mmol / L)[3].本实验检测的原料血浆及去冷沉淀血浆数据与成人标准相符.脂肪组织中的 TG 在一系列脂肪酶的作用下,分解生成甘油和脂肪酸,并释放入血液,供其他组织利用的过程,称为脂动员.脂动员生成的脂肪酸可释放入血液,与白蛋白结合形成脂酸白蛋白运输至其他组织被利用.从上述脂肪的分解代谢过程可以看到,白蛋白是主要的脂肪酸载体.由本公司血浆蛋白层析纯化工艺 TG 监测结果可知,工艺中 TG 主要存在于白蛋白分离部分,与理论相符.
在白蛋白分离纯化工艺中采用去脂剂可将脂类去除,效果优于硅藻土.LRA 用量 A 方案 = C 方案 <B方案,搅拌时间 A 方案 < B 方案 = C 方案,由 B 和C 方案结果可知,在相同搅拌时间下,LRA 用量与脂类去除效果成正比;由 A 和 C 方案结果可知,在相同 LRA 用量下,LRA 作用时间与脂类去除效果成正比;综合考虑工艺时间和 LRA 成本,我们确定 B 方案为最终方案,应用于白蛋白的分离纯化工艺中.
TG 的早期测定方法是以总脂质与胆固醇和磷脂之差估算.化学法用有机溶剂抽提标本中的 TG,去除抽提液中磷脂等干扰物后,用碱水解(皂化)TG,以过碘酸氧化甘油生成甲醛,然后用显色反应检测甲醛.比较准确的是二氯甲烷-硅酸-变色酸法(vanhandel-caslson 法),该方法抽提完全,能去除磷脂及甘油干扰,变色酸显色灵敏度高,显色稳定,至今仍是美国疾病控制与预防中心(CDC)内部参考方法.但因操作步骤繁多、技术要求高而不适于常规工作应用.
目前几乎所有的临床实验室均采用酶标板法检测血清 TG 水平.如脂蛋白脂肪酶-甘油磷酸氧化酶-过氧化物酶-4-氨基安替比林和酚法(GPO-PAP法).其反应原理如下:①血清中 TG 在脂肪酶(lipo-prteinlipase,LPL)作用下,水解为甘油和游离脂肪酸(freefattyacids,FFA);②甘油在ATP和甘油激酶(glyc-erokinase,GK)作用下,生成 3-磷酸甘油;③3-磷酸甘油经磷酸甘油氧化酶(glycerophosphate oxidase,GPO)作用氧化生成磷酸二羟丙酮和 H2O2;④H2O2与 4-氨基安替比林(4-aminoantipyrine,4-AAP)及 4-氯酚在过氧化物酶(peroxidase,POD)作用下,生成红色醌类化合物,其在 540 nm 的吸收值与 TG 浓度成正比.
酶标板法分一步法和两步法,用一步法测定的是血清总甘油酯(定义为 TG 和 FG 及少量甘油二酯、甘油一酯之和),为了消除 FG 的干扰,中华医学会检验分会曾在《关于临床血脂测定的建议》文件中推荐GPO-PAP 法的两步酶标板法作为血清 TG 常规测定方法[4].该方法是内游离甘油空白法,即将试剂中的脂肪酶与其他试剂成分分开,样品先与不含脂肪酶的试剂混合,孵育后测定吸光度,加入脂肪酶孵育后再测定吸光度,用两吸光度之差计算 TG 浓度.为消除 FG 对检测结果的影响,本实验采用美国 Sigma 公司的TG 试剂盒方法 A 即采用 GPO-PAP 的内游离甘油空白法.
由于酶标仪的出现,微量滴定板上的比色所具有的高通量、高效率的特点获得极大的发挥,我们根据前期 BCA 法检测总蛋白[5]的经验,也尝试着将常规的试管比色法改进为微量滴定板和酶标仪快速测定法,即第一步反应增加样品与游离甘油试剂的反应比例(从标示的 1 ∶ 80 提高到 1 ∶ 16),取部分混合样品至微量滴定板上进行孵育,第二步反应的样品与脂肪酶的比例仍为 4 ∶ 1,两步的反应模式均为37 ℃孵育 5 min.该方法验证结果显示,准确度、精密度均符合验证要求.我们将该方法引入血浆层析纯化工艺的监测,既能帮助优化工艺,又能作为质量控制的一部分来监控工艺的稳定性,扩大了该方法的适用范围.
参考文献
[1] Cole TG,Klotzsch SG,McNamara JR. Meastlrement of triglyc-eride concentraton // Rifai N,Warnick GR,Dominiczak MH.Handbook of lipoprotein testing[M]. Washington: AACC Press,2000:207.
[2] Chinese Pharmacopoeia Commission. Pharmacopoeia of People′sRepublic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,2010:212-213.(in Chinese)国家药典委员会. 中华人民共和国药典(三部)[S]. 北京:中国医药科技出版社,2010:212-213.
[3] Ministry of Health of the People′s Republic of China. Guide-lines for enzymatic measurements of serum triglycerides[S].Health industry standard of China. WS / T355,2011.(in Chi-nese)中华人民共和国卫生部. 血清甘油三酯的酶标板法测定[S].中华人民共和国卫生行业标准. WS / T355,2011.
[4] Serum triglyceride determination kit product description[OL].(2013-09-23)[2014-08-23].
[5] Zhou ZJ,Li CS,Li TJ,et al. Optimization and verification ofBCA method for determination of protein content in human coagulation factor Ⅷ [J]. Chin J Biologicals,2013,26(10):1488-1492.(in Chinese)周志军,李策生,李陶敬,等. 检测人凝血因子Ⅷ蛋白质含量的 BCA 法的优化及验证[J]. 中国生物制品学杂志,2013,26(10):1488-1492.





