
中性粒细胞在抵抗感染性炎症方面具有重要地位 , 其 中 中 性 粒 细 胞 分 泌 的 丝 氨 酸 蛋 白 酶(neutrophil serine proteases,NSPs)在清除病原体方面发挥重要作用。蛋白酶 3(proteinase 3,PR3)是中性粒细胞分泌的主要丝氨酸蛋白酶之一[1],是继人中性粒细胞弹性蛋白酶(human neutrophil elastase,HNE)及组织蛋白酶 G(cathepsin G,CG)后,于中性粒细胞嗜天青颗粒中发现的第三种丝氨酸蛋白酶。PR3 能降解多种细胞外基质,不但参与消灭感染性炎症中的病原体,而且在抑制剂与蛋白酶失衡的情况下直接参与组织损伤,与多种慢性炎症性疾病 , 如 血 管 炎 性 肉 芽 肿 病 (granulomatosis withpolyangiitis, GPA)、 慢性阻塞性肺疾病 (chronicobstructive pulmonary diseases,COPD)、肺囊肿性纤维症(pulmonoary fibrosis,PF)等的发生发展密切相关,可能作为这些疾病的防治靶点,近年得到了较大关注。本文就 PR3 及其在相关疾病的作用机制进行综述与探讨,以期为以 PR3 为靶点的药物开发与应用提供新的视野。
1 PR3的基本特性
1.1 PR3的结构
PR3 由 222 个氨基酸残基组成,其三维结构含2个β桶结构和1个羧基端α螺旋,而每个β桶结构又包括 6 个反向平行的 β 折叠。其催化活性位点由组氨酸(histidine,His)、天冬氨酸(asparagicacid,Asp)、丝氨酸(serine,Ser)组成,位于 2 个 β桶结构的连接处。PR3 还含有天冬酰胺(asparagine,Asn)159和 Asn113 两个糖基化位点。S2、S2′、S1′位点决定 PR3 的特异性[2].PR3 以无活性的酶原形式合成,需经过 3 次解朊作用的修饰才能转化为它的成熟形式,含 8 个半胱氨酸残基,形成 4 对分子内二硫键[3].成熟 PR3 因天冬酰胺连接的糖基化和4 对二硫键而稳定。
1.2 PR3的分布与表达
PR3主要储存在中性粒细胞的嗜天青颗粒与单核细胞的过氧化物酶阳性的溶酶体中,还可存在于特殊颗粒和分泌小泡。此外,嗜碱性粒细胞、肥大细胞、内皮细胞、人肺泡壁细胞也可表达 PR3.编码PR3的基因是一个粒细胞集落刺激因子应答基因。PR3 高转录水平阶段仅限于早幼粒细胞阶段和幼单核细胞阶段,而在粒细胞和单核细胞成熟阶段PR3的转录水平下调。粒细胞发育阶段的转录水平和翻译后水平调控是 PR3 合成的两个调控点。
当 中 性 粒 细 胞 被 肿 瘤 坏 死 因 子α(tumornecrosis factor-α, TNF-α)、 转 化 生 长 因 子 β(transforming growth factor-β, TGF-β)、 白 介 素(interleukin,IL)1、IL-8、血小板活化因子、细菌脂多糖、细胞松弛素 B 等激活时,PR3 分泌到细胞外,也有些 PR3 表达在细胞膜上[4].未激活的中性粒细胞膜上也有PR3 表达,活化的中性粒细胞膜表达的 PR3(membrane-bound proteinase-3, mPR3)是未活化的 5~6 倍。但是在静止的中性粒细胞mPR3 没有活性[5].mPR3+中性粒细胞比例稳定,并不因中性粒细胞激活而受影响。PR3 能结合在细胞膜上,这与苯丙氨酸(phenylalanine, Phe)166、异亮氨酸(isoleucine,Ile)217、色氨酸(tryptophan,Trp)218、亮氨酸(leucine,Leu)223、Phe224 构成的区域有关。PR3与膜的结合还可能与白细胞分化抗 原 (cluster of differentiation, CD)16 和 CD177(NB1)有关。当从细胞膜上移除糖化磷脂酰肌醇(glycosylphosphatidyl inositol,GPI)锚点时,mPR3降低。CD177(NB1)阳性细胞中,PR3 表达和活性大大提高[6].中性粒细胞凋亡诱导的 PR3 膜表达并不依赖于脱颗粒作用,而是与磷脂酰丝氨酸的暴露有关。在凋亡早期没有脱粒作用情况下,质膜上的PR3 可以外化。PR3 的外化可以削弱巨噬细胞对凋亡细胞的清除且不依赖其酶活性,从而加剧炎症反应[7].
2 PR3的生物学功能
2.1 PR3的抗菌活性
中性粒细胞可通过由包括 PR3 在内的蛋白酶和组蛋白组成的中性粒细胞胞外诱捕网(neutrophilextracellular traps,NET)诱捕并清除病原菌。PR3能有效杀死革兰阳性菌如粪链球菌、革兰阴性菌如大肠杆菌、真菌如白色念珠菌。PR3 表面所带的正电荷能够使其牢固地结合在细菌的细胞膜上,这种结合可能抑制细菌的蛋白质合成,介导膜的去极化和瓦解。在中性粒细胞活化时,PR3 能把人源抗菌肽(human antimicrobial peptide,hCAP)18 加工成其活化形式 LL-37.该多肽对革兰阳性菌和革兰阴性菌具有很广泛的抗菌活性,与防御素具有协同抗菌作 用。PR3 能 加 工 人 中 性 粒 细 胞 多 肽 (humanneutrophil peptide,HNP1)前体形成 HNP1,参与中性粒细胞胞内吞噬[8].mPR3还可作为细菌的一个非调理性吞噬受体,参与吞噬细菌的过程[9].
2.2 PR3对组织蛋白质的水解活性
PR3能降解多种细胞外基质,如纤连蛋白、层黏连蛋白、玻连蛋白、纤维蛋白原、胶原Ⅳ、弹性蛋白原与弹性蛋白[10]等,还能降解缝隙连接蛋白如钙黏蛋白、闭合蛋白,对血红蛋白、酪蛋白、蛋白多糖、血管假性血友病因子(von Willebrand factor,vWF)等也有水解活性,但不能作用于胶原Ⅰ和胶原Ⅲ。嗜天青颗粒中的 PR3 是无活性的,在中性pH 时有最大的酶活性。在 pH 6.5 时 PR3 降解弹性蛋白的活性比 HNE 稍强,但在 pH 7.4 和 pH 8.9 时活性比 HNE 弱。在 pH 7.4 时,PR3 降解血红蛋白的能力介于HNE 与 CG 之间。正因为 PR3 有强大的水解活性,在某种条件下可能水解肺、动脉、皮肤、韧带而引起一系列疾病。
2.3 PR3对炎症过程的调控作用
2.3.1对细胞因子的加工
PR3 可裂解活化 TNF-α、IL-1β、IL-18、IL-8等细胞因子,在炎症过程中发挥重要作用。TNF-α是重要的促炎因子,合成时以膜结合的前体形式存在。PR3 能裂解该前体而活化生成 TNF-α[11],可能参与风湿性关节炎的形成和克罗恩病的发展。
IL-1β是单核巨噬细胞和自然杀伤细胞(naturalkiller,NK)等表达的促炎因子,与感染性休克、创伤修复有关。PR3 通过活化 IL-1β,可能参与哮喘、类风湿关节炎、神经性炎症等炎症性疾病[12].
IL-18是γ干扰素(interferon-γ,IFN-γ)强效诱导因子,也是先天性免疫和获得性免疫中重要的调节因子。IL-18 的前体构成性表达在人口腔上皮细胞和其他几个上皮细胞系,PR3 可将其裂解活化成IL-18,可能参与牙周炎、哮喘、败血症、风湿性关节炎和炎症性肠病等[13].IL-8 是中性粒细胞的趋化因子,促进中性粒细胞的脱颗粒与迁移,以前体形式由单核细胞、中性粒细胞、上皮细胞分泌。
PR3能裂解 pro-IL-8 成 IL-8,趋化更多的中性粒细胞聚集在炎症部位,加重组织的损伤,参与慢性阻塞性肺疾病等[14].此外,PR3 还能活化 TGF-β1[15]、IL-32[16],灭活 IL-6[17]和巨噬细胞炎症蛋白 1α(macrophage inflammatory protein-1alpha, MIP-1α)[18],对IL-33 则表现出活化和抑制的双重作用[19].总之,PR3 可通过加工多种细胞因子而参与调控炎症反应。
2.3.2对细胞受体的加工
PR3可通过加工细胞受体调控细胞信号传导,在调节炎症反应中发挥一定的作用。PR3 通过裂解蛋白酶激活受体(protease activated receptor,PAR)1,解除凝血酶激活的钙信号,而这种 G 蛋白偏置信号能够调节内皮细胞屏障的完整性[20].PR3 通过PAR-2 依赖途径增强内皮细胞的屏障功能,诱导内皮细胞维持钙信号,抑制 PAR-1 激动剂对内皮细胞缝隙连接蛋白的破坏和血管通透性的改变[21].
PR3 可裂解内皮细胞蛋白 C 受体 (endothelial cellprotein C receptor,EPCR),而 EPCR 是蛋白 C 通路中重要的成员之一,是宿主对炎症刺激反应的关键组成成分。PR3 还能下调内皮细胞和血小板的凝血酶受体活性,调节止血平衡和炎症反应。
2.3.3对其他物质的加工
PR3 还可通过对其他炎症相关物质的加工,直接或间接地调控炎症反应。PR3 能加工核转录因子κB(nuclear factor κB,NF-κB)[22]、周期蛋白依赖性激酶抑制剂 p21[23].PR3对 NF-κB 和 p21 的蛋白水解能加速内皮细胞的凋亡,参与克罗恩病、溃疡性结肠炎等疾病。PR3 能裂解活化 caspase-3[24],该蛋白酶能调节中性粒细胞死亡和炎症,还可改变Bcl-2、Bax、Bcl-xl 等凋亡调节蛋白的表达水平,调节神经元细胞死亡途径[25].此外,PR3 还能裂解β2整合素 CD11b/CD18[26]、TGF-β结合蛋白,灭活C1 抑制剂、颗粒蛋白前体(progranulin,PGRN)[27]、转录因子 Sp1 和热休克蛋白 Hsp28,裂解高分子质量激肽原(high-molecular weight kininogen,HK)释放出缓激肽[28]、转换血管紧张素原(angiotensinogen,aGT)为血管紧张素(angiotensin,Ang)Ⅰ和 AngⅡ、活化血小板等,不同程度地参与了炎症的发生发展。
从前述可知,PR3 的生物学功能广泛,可通过降解组织蛋白、调控免疫反应等而参与相关疾病的发生发展。有关 PR3 的生物学功能及可能参与的疾病见表 1.

3 PR3的抑制剂
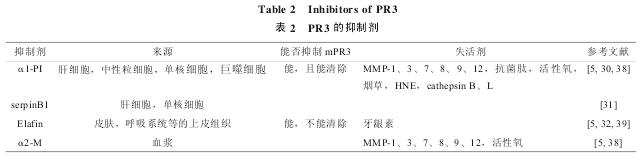
PR3是中性粒细胞分泌的主要丝氨酸蛋白酶之一,人体内亦存在多种可保护自身免受其攻击的内源性抑制剂,如α1蛋白酶抑制剂(α1-proteinaseinhibitor,α1-PI)、serpinB1、Elafin 及 α2- 巨球蛋白(alpha 2-macroglobulin,α2-M)等。α1-PI主要由肝细胞合成,在血浆、下呼吸道、肺部的 PR3 抑制占主导地位。α1-PI 与 PR3 的结合不可逆,PR3 通过与 α1-PI 的活性中心环作用,产生一个共价结合中间体而导致 PR3 的变性失活[30].serpinB1 是位于中性粒细胞和单核细胞胞浆中的一种 HNE 强效抑制剂,同时也能抑制 PR3 的活性[31].Elafin 最初是从牛皮癣病人的皮肤中分离出来,后来被发现可存在于肺的分泌物里和精浆里,是 PR3强效的、可逆的抑制剂[32].mPR3对 Elafin 有一定抵抗性,mPR3 被 Elafin 抑制时,仍旧停留在中性粒细胞膜上,且与之结合得更加紧密。虽然能完全抑制其水解活性,但不能从中性粒细胞膜上清除[5].α2-M是大小为 725 ku 的血浆糖蛋白,由于其分子质量大,能到达炎症部位的机会大大减少。它对酶抑制作用的发挥可能就局限于循环血液中,只有当血管通透性大大增加的时候才能游离到其他部位发生作用。
上述内源性抑制剂对 PR3 有较强抑制作用,但都不是 PR3 的特异性抑制剂。它们同时还对其他蛋白酶具有抑制作用,且这些内源性抑制剂易被体内物质灭活,如活化的中性粒细胞产生的大量氧自由基、基质金属蛋白酶(matrix metalloproteinases,MMPs)可使 α1-PI、α2-M 失活。因为内源性抑制剂抑制作用的局限性,开发外源性的、不易被内源性物质灭活的特异性 PR3 抑制剂显得尤为重要。然而,目前对于 PR3 外源性抑制剂的研究很少。Epinette 等[33]通过高亲和力荧光共振能量转移基板发现一种能特异抑制 PR3 而对 NE、CG 没有抑制作用的抑制剂。Guarino 等[34]发现一种新的选择性肽二氯苯基膦酸脂能快速灭活炎性肺分泌物和膀胱癌患者尿液等生物体液中的PR3,阻止其蛋白水解作用。基于南五味子酮的一种抑制剂对 PR3 有较强的亲和力,能通过竞争性的可逆性抑制机制抑制PR3[35].金黄色葡萄球菌分泌的胞外黏附蛋白(extracellular adherence protein,Eap)及其同系物EapH1、EapH2 对 PR3、CG、HNE 都有抑制活性,因而使其能够逃避宿主的免疫[36].巴西红木中提取的抑制剂 CeEI 对 PR3 也有较强的抑制作用[37].作者所在的实验室也正尝试开发 PR3 抑制剂。有关PR3 的抑制剂见表 2.
4 PR3与疾病
PR3不但可直接降解组织蛋白,还参与调节炎症反应,与GPA、COPD 和 PF 等炎症性疾病的发生发展密切相关。
4.1血管炎性肉芽肿病(GPA)
GPA 是一种机制尚不清楚的自身免疫性疾病,主要表现是坏死性肉芽肿和坏死性血管炎,可累及任何器官,最常见于全呼吸道和肾脏。引起 GPA的原因还未完全阐明,GPA 病人抗中性粒细胞胞浆 抗 体 (antineutrophil cytoplasmic antibodies,ANCA)的靶抗原主要为 PR3.α1-PI PiZ 等位基因缺失[40]、人 toll 样受体 2(toll like receptor 2,TLR2)和TLR9 的激活[41]、CD18 基因突变、PR3 的抗原表位突变、PR3 基因转录活性的改变[42]、HLA 等位基因变异[43]等影响 PR3 活性或表达都可促使该病的发生。因此,可以明确 PR3 与 GPA 的发生发展密切相关。
研究表明 PR3 可能通过多种复杂的机制参与GPA的发生发展。mPR3 与 ANCA 相互作用能致中性粒细胞的活化、脱颗粒以及活性氧、水解酶等的释放,活化的中性粒细胞对血管内皮细胞具有细胞毒性作用[44].EPCR 有抗炎与抗凝特性,ANCA阻断 EPCR-PR3 相互作用可能引起血管炎的发生。
ANCA 可能影响磷脂酰丝氨酸外化和中性粒细胞吞噬清除功能。PR3-ANCA 还可通过调节 TLR 和NOD 信号通路致敏单核细胞产生细胞因子 IL-6、IL-8、 TNF-α、单 核 细 胞 趋 化 蛋 白 1 (monocytechemoattractant protein-1,MCP-1),参与 GPA 的炎症过程[45].PR3 与 CD177、CD16、CD18、磷脂爬行酶 1(phospholipid scramblase 1,PLSCR1)的相互作用参与GPA 的发病[46-47].PR3 通过 PAR-2 诱导树突状细胞成熟,而树突状细胞能刺激 PR3 特异性 CD4+T 细胞产生 IFN-γ,利于 GPA 中肉芽肿的形成。PR3 特异性辅助 T 细胞(T helper cell,Th)17水平增高,产生因子 IL-17 可能是 GPA 发病原因之一[48].PR3 与钙网蛋白(calreticulin,CRT)球形域的相互作用能够削弱巨噬细胞的吞噬功能,促进GPA 等炎症的发展[49].PR3 诱导 CD4+T 细胞向Th1 型转化,参与 GPA 中细胞免疫[50].PR3 还可促进内皮细胞(endothelial cell,EC)表达组织因子(tissue factor,TF)并增强其活性,导致微血栓的发生和持续的细胞坏死。ANCA与活化的中性粒细胞mPR3的结合被认为是 GPA 的主要发病机制,因此移除中性粒细胞 mPR3 可能成为一个治疗方向。已 发 现 一 种 源 于 抑 制 剂 SerpinB1 的 突 变 体SerpinB1(STDA/R)与可溶性的 PR3 和 mPR3 都能快速形成复合物,且能清除活化的中性粒细胞mPR3[51].
该突变体与靶酶反应的高速率使其在GPA中可能与 ANCA 竞争性结合 mPR3,减少中性粒细胞引起的炎症。目前 GPA 的发现主要是通过 ANCA 的检测,诊断标准是活检发现微小血管炎。GPA 的治疗近年来也取得较大进展,已开发出一些特异性针对 T 细胞、因子、免疫途径的靶向治疗药物[52].GPA的发病机制复杂,目前还没有高效且副作用低的治疗方法。总之,PR3 在 GPA发病中发挥了重要作用,PR3 极有可能成为该疾病防治靶点。
4.2慢性肺疾病
4.2.1慢性阻塞性肺疾病(COPD)
COPD 包括慢性支气管炎、肺气肿、慢性阻塞性气道疾病,主要表现为肺泡的破坏、小气道的慢性炎症与纤维化,目前为世界上第五大死亡原因,预计到 2020 年将上升到第三位。遗传因素 α1-PI缺乏增加了 COPD 发病的危险性。α1-PI 缺乏病人中,由于肺部的蛋白酶与其抑制剂失衡,蛋白酶可降解肺组织。NE、CG、PR3 三者对肺组织损伤的共同作用相比NE 更大。这三种酶还能够增加巨噬细胞源性的 MMP-9 和 MMP-12 的活性,进而导致抑制剂α1-PI、α2-M失活,加重肺组织的损伤[53].
PR3 水解颗粒蛋白前体后的产物能刺激上皮细胞产生中性粒细胞趋化因子 IL-8[14],趋化更多的中性粒细胞聚集,促进肺组织的炎症反应。α1-PI 缺乏患者和 COPD 病人痰液中 PR3 相比 NE 更为常见,活性大于 NE,且急性加重期 PR3 的活性比疾病稳定期更大[54].这些结果表明 PR3 在 COPD 所起的作用可能比预想的要大,PR3 可能作为 COPD 防治新靶点。
4.2.2肺囊肿性纤维症(PF)
PF是中性粒细胞占主导的慢性气道感染性炎症。中性粒细胞功能障碍导致低效的细菌清除是该病的特征,它与中性粒细胞丝氨酸蛋白酶的活性不受控制和补体的过度激活有关。PR3 是引起气道分泌物的原因之一。在 PF 病人中,单核细胞 PR3mRNA 表达上调,与肺恶化相关。PR3 与 NE、CG共同影响中性粒细胞活化受体 C5aR 的功能与表达,抑制C5a诱导信号的能力,进而影响中性粒细胞的功能[55].PR3活化 IL-8,促进中性粒细胞胞内钙的动员[14]与脱颗粒和使可溶性的 IL-6 失活,影响 IL-6 的信号传递功能[17]
都能促进该病的发生发展。PF 病人痰中的 PR3 具有酶促活性,且浓度与牛磺酸的浓度高度相关,而牛磺酸被认为是气道炎症的标志物[56].PR3参与表面活性蛋白 D(surfactantprotein D,SP-D)的水解导致宿主对细菌的防御功能减弱,增加肺部感染的几率[57].PR3 能降解分泌型白细胞蛋白酶抑制剂(secretory leukocyte proteaseinhibitor,SLPI),增加了能被 SLPI 抑制的蛋白酶HNE的组织损伤作用。中性粒细胞中所含 HNE 通常约为PR3 的 5 倍,但在合并铜绿假单胞菌感染的PF 病人中,PR3 的水解活性占主导地位。在没有铜绿假单胞菌感染时,虽然 HNE 的作用占主导,但PR3 仍然起着非常重要的作用。在 PF 中,包括PR3 在内的蛋白酶活性异常引起的促炎因子的上调、肺区大量炎症细胞的聚集、吞噬功能的受损、黏液素的增加、抗菌蛋白的灭活等都可导致持续的炎症与感染的易感性[56].内源性丝氨酸蛋白酶抑制剂也易被中性粒细胞源性氧化物灭活,使得抗蛋白酶不足以保护机体。所以对于 PF 病人,恢复包括PR3在内的蛋白酶 / 抗蛋白酶的平衡至关重要。
在慢性肺疾病治疗中,通过吸入 Elafin 可以阻止肺上皮细胞因 PR3 和 CG 而脱落,且能保持Elafin 对靶酶的活性。吸入 α1-PI 能减少 PF 中肺组织的损伤,且能恢复气道中性粒细胞的杀菌能力。但雾化吸入法治疗不仅要求合适的药物颗粒大小,还要求有足够的药物到达全部肺区,特别是通气不足的肺区;在含有大量的氧化物质和酶类的炎症环境,Elafin 等抑制剂也有可能被降解灭活;病人气道黏液分泌过多时,黏液能影响药物的沉积和阻止药物的扩散。此外,黏液中的 NSPs 因为有黏液的保护而对抑制剂也有一定的抵抗力,这些都增加了治疗该类疾病的困难[58].
总之,PR3 在气道炎症的发生发展中起着重要作用,PR3 可作为一个新的防治靶点。PR3 参与疾病的可能机制见图1.

4.3其他疾病
研究表明 PR3 -ANCA 可作为炎症性肠病的血清标记物,提示 PR3 参与溃疡性结肠炎和克罗恩病[59].PR3不依赖于其他已知危险因子,可独立作为判断急性心肌梗死(acute myocardial infarction,AMI)后心力衰竭的发生率和死亡率的一个重要指标[60].PR3 能够水解和下调胰岛素样生长因子(insulin-like growth factor,IGF)和胰岛素样生长因子 结 合 蛋 白3 (insulin-like growth factor-bindingprotein-3,IGFBP3),诱导糖尿病患者胰岛素抵抗[29].当抑制 PR3 的活性时,患者对葡萄糖的清除能力增加,说明PR3 可能参与糖尿病的发生发展。
5治疗PR3相关疾病的思路
正如前所述,PR3 与很多疾病的发生发展相关,可能成为这些疾病的药物防治靶点。根据 PR3的生物学功能与致病机理,笔者认为可以从以下几个方面着手:抑制 PR3 的生成;加快 PR3 的降解;抑制 PR3 的活性;减少内源性氧化剂和远离外源性氧化剂;增加外源性抑制剂以及阻断 PR3 与致病相关分子的相互作用。
a.DPPI 抑制剂。DPPI 是 NSPs 的激活剂,抑制 DPPI 的活性能削弱 NSPs 的产生。通过对内源性活化剂 DPPI 的抑制,减少中性粒细胞的活化,从而减少PR3 的产生。Pham 等[61]的研究结果表明,抑制DPPI 可以导致细胞内总 PR3 的减少。以 PR3和 DPPI 为靶点的抑制剂可用于 GPA 的治疗[62],并且已经发现一种能抑制NSPs 活化的无毒性腈类DPPI抑制剂[63]和一种能穿过细胞的无毒性 DPPI 抑制剂[64],但这种抑制剂风险大,因为抑制 DPPI 不仅可抑制PR3 的活化,还可抑制 NE、CG、肥大细胞糜酶和颗粒酶 A、B、H、M、K 等,所以在抑制 DPPI 的同时,可能会有其他意外后果产生,而且病原体的清除也需要中性粒细胞聚集在炎症部位。
b.研发针对于 PR3 的单克隆抗体。单克隆抗体是对治疗自身免疫疾病和肿瘤非常有前景的药物。单克隆抗体 MCPR3-7 能极大地降低 PR3 的活性,通过改变自溶作用把有活性的 PR3 转变为无活性的酶原样形式,并干扰 PR3 和 α1-PI 的络合作用[65].用 PR3 单克隆抗体治疗 GPA 可能会减少ANCA 导致的中性粒细胞活化和 PR3 的组织损伤作用。
c.设计针对于 PR3 的不易被内源性物质氧化或降解的小分子特异性抑制剂。目前已知的内源性抑制剂均是非特异性的,且容易被内源性氧化剂氧化,因此设计专门针对PR3的小分子的、能够降解和清除 PR3 的特异性抑制剂可能具有重要应用价值。
d.清除或减少 PR3 抑制剂的内源性氧化剂和远离外源性氧化剂。上述我们已知 α1-PI 和 α2-M等可被多种内源性氧化剂和外源性氧化剂如烟草、化学试剂灭活,所以可通过清除或减少 PR3 抑制剂的内源性氧化剂和远离外源性氧化剂来维持抑制剂的抑制作用,从而阻止疾病的发展。
e.替代疗法。α1-PI 缺乏引起的肺气肿病人静脉给予α1-PI疗效明显。
f.阻断 PR3 与致病相关分子的相互作用。如在 GPA 中,可以设计出能封闭 ANCA 的 PR3 特异性表位的抗体,使 ANCA 不能识别 PR3,从而阻断 PR3 与 ANCA 的相互作用。
6问题与展望
中性粒细胞在炎症反应中起着十分重要的作用。当炎症发生时,在趋化物质的作用下迅速聚集到炎症部位。PR3 是中性粒细胞分泌的多功能丝氨酸蛋白酶,直接影响炎症的发生发展。近年研究发现PR3 可通过多种途径参与 GPA、COPD 等炎症性疾病,可能成为这些疾病防治的新靶点。本文综述了PR3 的生物学功能、参与炎症性疾病的机制及其作为疾病治疗靶点的前景。但由于 PR3 是三种中性粒细胞丝氨酸蛋白酶中最难分离得到的,所以迄今为止对PR3 的研究相对较少。而对于 PR3相关疾病的治疗,近年虽已研发出各种治疗生物药物,但药物的疗效还有待进一步的临床观察和评估。有些治疗方案如使用 DPPI 抑制剂,虽然能抑制 PR3 的活化,但并不是特异性作用于 PR3,所以很容易产生其他副作用。因此,研发出高效、特异性的 PR3 抑制剂对于 PR3 相关疾病的防治可能具有重要价值。该文综述了 PR3 及其与疾病的关系,期望为 PR3 相关疾病防治提供新的思路。
参 考 文 献
[1]邓 振, 何庆丰, 彭礼飞。 中性粒细胞丝氨酸蛋白酶及其抑制剂与炎症。 中国药理学通报, 2014, 30(3): 314-317Deng Z, He Q F, Peng L F. Chin Pharmacol Bull, 2014, 30 (3):314-317
[2] Korkmaz B, Hajjar E, Kalupov T, et al. Influence of chargedistribution at the active site surface on the substrate specificity ofhuman neutrophil protease 3 and elastase. A kinetic and molecularmodeling analysis. J Biol Chem, 2007, 282(3): 1989-1997
[3] Hajjar E, Broemstrup T, Kantari C, et al. Structures of humanproteinase 3 and neutrophil elastase---so similar yet so different.FEBS J, 2010, 277(10): 2238-2254
[4] Owen C A. Leukocyte cell surface proteinases: regulation ofexpression, functions, and mechanisms of surface localization. Int JBiochem Cell Biol, 2008, 40(6-7): 1246-1272





