摘 要: GAF结构域广泛存在于各种蛋白中, 其主要通过结合环核苷酸cGMP、cAMP、生色团和血基质等小分子作为信号分子、光或者气味受体, 配合其他调节结构域稳定蛋白质构象和传递信号。本文简要综述了GAF结构域的基本特征、分类、结构及功能, 为阐明一些重要信号转导途径及抗逆性研究提供了一定的理论依据。
关键词: GAF结构域; 信号转导; 光敏色素; 磷酸二酯酶; 腺苷酸环化酶;
Abstract: The GAF domain presenting in various proteins are involved in maintaining protein conformation stability and signal transduction. The GAF domain often receives and transduces signals through binding to small signal molecules such as cGMP, cAMP, chromophore and heme, and functions as light or odor receptors in company with other regulation domains. In this paper, the basic characteristics, classification, structure and functions of GAF domains are summairzed, which provides theory basis for the researches of the signal transduction pathway and stress resistance.
Keyword: GAF domain; signal transduction; phytochrome; phosphodiesterase; adenylate cyclase;
GAF结构域是以最早被发现含有这个结构域的蛋白质来命名的,由特异性的cGMP磷酸二酯酶 (cGMP-binding phosphodiesterases) 、腺苷酸环化酶 (adenylyl cyclases, AC) 和细菌转录因子FhlA (formate hydrogenlyase transcription activator) 的首字母构成。GAF结构域极少单独出现,通常作为蛋白质的一部分参与信号转导过程[1]。GAF结构域与信号分子的结合通常是接收和传导化学信号,与发色基团的结合通常是接收物理信号 (如光线) [2]。GAF结合的配体主要为环核苷酸cGMP和cAMP,此外反式甲硫氨酸亚砜、亚铁血红素、胆素、四吡咯[1]、氨基酸 (如全局调控蛋白CodY的2个GAF结构域) 也可以作为配体与GAF结合[2]。目前,已有利用X射线晶体衍射和核磁共振技术解析一些GAF结构域的研究报道,其中酿酒酵母YKG9蛋白的GAF结构域最先被解析[3];随后,Martinez等[4,5]解析了小鼠磷酸二酯酶串联GAF的晶体结构,并报道了蓝细菌腺苷酸环化酶 (adenylate cyclase, AC) CyaB2的串联GAF结构。近年来,有研究发现,磷酸二酯酶 (phosphodiesterase, PDEs) 的GAF结构域可作为药物靶标开发[6];耐辐射奇球菌的光敏色素的GAF结构域在光转化模型研究中可作为胆素结合位点[7,8,9],在光遗传学的研究中发挥着重要作用。
1、 GAF结构域的分类
GAF结构域广泛分布于多种蛋白质中,在细胞中主要起着信号受体的作用,很多种类的小分子包含一些信号分子和发光基团均可与之结合[10]。GAF结构域通常以串联的形式存在,极少数情况下也可作为单独功能的蛋白质出现。近年来随着研究的深入,发现在一些光受体、气味受体以及全局调控蛋白中也存在串联GAF结构域。根据结合的配体不同,GAF结构域还可分为以下5个种类[11]。
1.1、 光受体中的GAF
植物光敏色素是一种光受体,由N末端光感受区域和C末端信号传导区域构成,N末端光感受区域主要由GAF结构域和Per-Arnt-Sim (PAS) 结构域组成[10]。其中GAF结构域包含生色团的结合位点,PAS则主要负责调节光敏色素对不同波长光的响应[11]。在光合细菌、真菌中也相继发现光受体-光敏色素,尽管细菌、真菌中的光敏色素在性质上与植物光敏色素差异较大,但二者GAF结构域的同源性较高[12],说明GAF结构域作为光敏色素的重要组成成分,在进化中较保守。
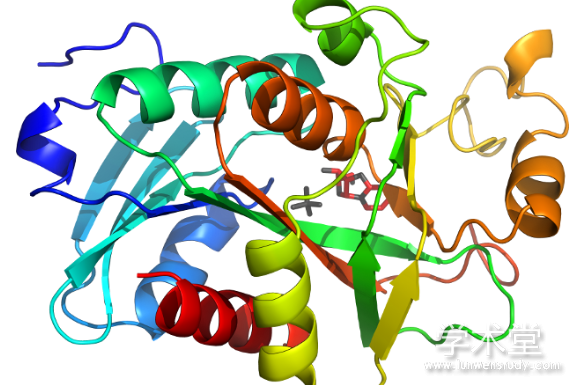
1.2、 气体受体中的GAF
GAF结构域在植物乙烯信号途径中具有特殊作用,拟南芥中的5个乙烯受体家族ETR1、ERS1、ETR2、EIN4和ERS2的基本结构均包含1个GAF结构域,在乙烯信号响应和传导中发挥着重要作用[13,14]。GAF还可以通过氨基酸残基与血基质结合,从而感受一些气体信号,如结核分枝杆菌通过GAF结构域感受到宿主组织缺氧后会进入休眠期,进入持留状态[15]。
1.3、 环核苷酸受体中的GAF
环核苷酸 (cylic nucleotides, cNMP) 是机体内重要的小分子信号物质,GAF可作为cNMP的受体参与细胞内化学信号的传导[16]。哺乳动物中较早发现的GAF结构为PDEs的串联GAF-A/B,研究发现PDEs可以调节所有使用cGMP或cAMP作为第二信使的通路。目前已知的PDEs家族有11个,即PDE1~PDE11,且至少存在21个亚型[16],其中,PDE2、PDE5、PDE6、PDE10和PDE11的氨基端都含有1对GAF-A/B结构[17,18,19]。AC存在于各种生物细胞中,其能在外界信号刺激和细胞内代谢变化条件下催化ATP (adenosine triphosphate) 生成cAMP (cyclic AMP) 和焦磷酸 (pyrophosphate, PPi) ,从而调节机体各种生理反应[20,21]。蓝细菌AC CyaB2的串联GAF结构域含有1对GAF-A/B结构,其序列与PDEs串联GAF结构的相似性较高,二者可实现部分功能的互换[21,22,23]。
1.4、 具有单独酶活性的GAF
GAF串联结构域多数情况下主要以复杂蛋白的配体参与胞内外信号转导,但在极少数情况下,单个的GAF结构域也可作为蛋白质发挥作用,如Lin等[15]研究发现一种新型的蛋氨酸亚砜 (methionine sulfoxide, MetO) 还原酶———游离蛋氨酸R型亚砜还原酶 (free methionine sulfoxide reductase, f RMsr) ,其长度为183个氨基酸残基,作为一类重要的氧化还原调节蛋白参与细胞的防御和抗衰老过程。Pfam分析结果显示,f RMsr只有1个长度为129个氨基酸残基的GAF结构域,这是GAF家族中第1个被发现具有单独酶活性的GAF结构域。
1.5、 类GAF结构域
耐辐射奇球菌关键蛋白PprI (inducer of pleiotropic proteins promoting DNA repair) 的C末端与肺炎克雷伯菌传感器组氨酸激酶CitA (histidine kinases, HK) 和磷酸二酯酶2A (phosphodiesterase 2A, PDE2A) 的GAF结构域高度相似[24],比较三者与柠檬酸盐和cGMP配体组成的复合体结构,发现三者的配体结合位点和信号通路都有较高程度的重叠[25],因此PprI的C末端也被称为PprI的GAF结构域。进一步研究发现,当去除PprI的C端,会导致耐辐射抗性大幅度下降,表明PprI的C末端可能在耐辐射响应机制中起着传感器的作用[26]。
2、 GAF结构域的结构
GAF结构域通常作为蛋白质的一部分,配合其他的调节结构域如PAS (Per-Arnt-Sim) 结构域、HAMP (histidine kinases, adenylyl cyclases, methy binding proteins, phosphatases) 结构域以及各种感应调节结构域共同发挥作用[22]。蛋白一般含有1个GAF结构域或者1个串联GAF结构域,极少情况下,细菌蛋白质存在3个及3个以上连续排列的GAF区域,如在聚球藻属或厌氧粘细菌中参与多传感器信号转导的组氨酸激酶有6个GAF结构域[4]。GAF超家族是一类主要通过与配体分子结合来调节蛋白信号转导的结构域集合,其家族成员的一级结构复杂多变,但大多数由150个左右氨基酸残基组成,有类似的一些结构特征,其中哺乳动物PDEs和蓝细菌AC CyaB2的串联GAF结构域是典型代表[27,28]。
2.1、 GAF结构域基本特征
GAF结构域均存在相似的三维折叠结构,N端和C端的α1、α2、α3、α5螺旋形成了结构的外层,无规则卷曲和短的α4螺旋结构形成了相对外层,有6个中心反向平行的β折叠,β折叠形成的弯曲平面将α螺旋分为两部分[3]。反向平行的β折叠形成的弯曲平面是配体结合口袋的基本结构,配体结合口袋的部分区域被α3、α4螺旋和一些环状卷曲所覆盖,α2、α5在配体结合口袋的另一面[15] (图1) 。
图1 GAF三级结构[3]
![图1 GAF三级结构[3]](http://www.xueshut.com/uploads/allimg/191012/36-191012163232954.jpg)
Fig.1 Tertiary structure of GAF[3]
2.2、 2种经典的串联GAF结构域结构特征
GAF的结构域通常是以二聚体的形式出现,主要形成双重对称平行和反向平行2种结构。GAF二聚体结构域中最经典的代表是哺乳动物磷酸二酯酶家族中的PDE2和蓝细菌AC CyaB2,二者的GAF结构域都是串联GAF结构域的形式[4]。所有结合环状核苷酸的串联GAFs均至少含有1个由5个氨基酸残基NKX (5-24) FX3DE构成的基序 (NKFDE基序) ,此基序对GAF结构域的正确折叠起着重要作用,且大多数串联GAF结构域中NKFDE的基序都是保守的。此外,在串联GAF结构域的前端还存在一段较长的N端肽段,与串联GAF结构域构成一个整体,并影响串联GAF结构域与环核苷酸的亲和力[3]。
PDE2的GAF的结构域是1个双重对称平行的二聚体 (图2-A) ,主要包含两大部分,即GAF-A和GAF-B,其中GAF-A和GAF-B被一个长的α螺旋隔开,每个GAF-A结构域都彼此离得很近且似乎直接参与二聚反应,而GAF-B结构域是分开的[8]。在PDE2的串联GAF中,GAF-A和GAF-B均包含NKFDE基序,通过该基序突变研究发现,每个GAF-B结构域结合1个cGMP,并将其完全淹没在结合口袋中,而与GAF-B有着类似结构的GAF-A结构域不结合配体[22],表明要结合或者释放cGMP,这个结构域必须开放到一定程度并允许外部物质进入。
Martinez等[5]研究表明蓝细菌AC CyaB2的串联GAF结构的晶体分辨率为1.9?,是1个反向平行的二聚体结构,与PDEs的串联GAF结构域具有极高的序列相似性。二者的GAF-A和GAF-B结构域都是由32个氨基酸长度的α螺旋连接,通过序列比对发现所有PDEs和AC串联GAF结构域的这个α螺旋长度基本相同[1],表明这个α螺旋对二聚体的形成至关重要[26]。相比PDE2的串联GAF二聚体结构,AC CyaB2串联GAF二聚体表面有不同的排列,在其反向平行构象中,1个蛋白中的GAF-A会与另一个蛋白的GAF-B形成并列式排布,且CyaB2串联GAF的N端α螺旋被折叠到二聚体中心,导致N端α螺旋点和α螺旋连接处的表面相互作用有所增强 (图2-B) 。
图2 磷酸二酯酶PDE2 (A) 和腺苷酸环化酶Cya B2 (B) 串联GAF的结构域[5]
![图2 磷酸二酯酶PDE2 (A) 和腺苷酸环化酶Cya B2 (B) 串联GAF的结构域[5]](http://www.xueshut.com/uploads/allimg/191012/36-19101216320T20.jpg)
Fig.2 The domain of phosphodiesterase PDE2 (A) and adenylate cyclase Cya B2 (B) in series GAF[5]
3、 GAF结构域的功能
3.1、 串联GAF结构域的功能
3.1.1、 光信号传导
植物光敏色素作为植物中的光受体,通过接受光信号并将信号传到光反应中心,然后将处理好的光信号通过光反应中心输出途径传递给下游分子,进而调控特异基因的表达。光敏色素主要通过GAF结构域的保守性半胱氨酸残基与线性四吡咯色素分子的共价连接,形成具有光活性的色素蛋白,进行信号传导,在植物生长发育、形态建成中发挥着重要作用[29]。蓝细菌中感光蛋白主要通过GAF结构域或PAS结构域发挥与发色团结合、适当的光转换以及对从近紫外到可见光的广泛光谱作出反应等功能[1]。在蓝细菌感光蛋白中,结合色素的GAF结构域已经具有完整的光活性,而植物光敏色素需要PAS结构域、GAF结构域和PHY结构域串联结合在一起才具有完整的光活性[30,31]。
3.1.2、 气体信号转导
拟南芥的5个乙烯受体基因 (ETR1、ERS1、ETR2、EIN4和ERS2) 可分为2个亚家族,通过下调乙烯反应基因来调节乙烯信号的输出[32]。谢芳[33]研究表明,ETR1和ETR2两个亚家族之间可以通过GAF结构域进行相互作用,转导乙烯信号。Catalá等[32]研究表明,ERS1受体中GAF结构域的点突变会导致拟南芥对微弱乙烯不敏感。病原体结核分枝杆菌在感受到宿主组织缺氧后会进入休眠期,其主要是通过DevRST操纵子系统进行响应。DevRST操纵子系统由双组分信号转导系统DevRS和DevT两部分组成,其中DevRS由包含1对串联GAF-A/B结构的组氨酸激酶DevS和反应调控子DevR组成,DevT2是1个信号感受蛋白。DevS的GAF-A通过H149A氨基酸残基与血红素的铁原子协作,从而与血红素结合,传导气体信号响应宿主组织缺氧[15]。
3.1.3、 化学信号传递
哺乳动物PDEs的GAF结构域主要通过结合cNMP信号分子发挥作用,已知包含GAF-A和GAF-B结构的PDEs家族中,PDE5和PDE6的串联GAF结构域特异性结合cGMP, PDE10特异性结合cAMP, PDE2和PDE11与cGMP、cAMP均能结合,cNMP通过结合GAF结构域激活PDEs的催化活性[17,34,35]。如耻垢分枝杆菌编码了1种含有GAF结构域的酶DcpA,具有催化c-di-GMP合成和水解的双功能,该酶的GAF结构域通过结合GDP,介导了其下游结构的二聚化反应,而二聚体对于DcpA酶的合成活性具有重要作用[36]。
3.1.4、 药物靶标开发
在磷酸二酯酶抑制剂药物的开发中,一些PDE抑制剂在临床得到了广泛的应用,如PDE3抑制剂能用于治疗心衰,PDE4抑制剂能用于治疗呼吸道炎症,PDE5抑制剂能用于治疗男性勃起功能障碍等[37]。PDEs抑制剂通常直接作用于PDEs催化区域,从而抑制其酶活性,但在治疗过程中会产生视觉障碍、头痛、偏头痛等副作用;但通过药物靶向作用于PDE5的GAF结构域可有效抑制PDEs的激活,既间接抑制了PDEs的酶活,又消除了直接作用于PDEs催化区域带来的副作用[12]。因此,哺乳动物PDEs中串联GAF结构域可以作为药物靶标进行开发。
3.2、 串联GAF结构域各组件的功能
GAF结构域通常以串联的形式发挥功能,串联GAF一般包括2个及以上GAF结构、N端、链接段。所有具有环核苷酸结合特征的串联GAF结构域中都至少存在1~2个NKFDE基序,GAF结构域通常在一段较长的N端肽段之后,且N端肽段的长度存在差异[37]。研究表明,哺乳动物PDEs由cGMP激活其活性,而PDEs又可以水解cGMP,因此直接研究PDEs各组件的调节功能对试验条件的要求极为严苛[38];而通过cAMP激活的蓝细菌AC的底物是ATP,且AC和PDEs的GAF结构域有极高的相似性,二者可在功能上相互替换[39]。因此常利用PDEs和AC的嵌合体来研究PDEs各组件功能,通常下游酶活性区域来自AC,上游信号转导结构域来自PDEs。
3.2.1、 NKFDE基序的功能
串联GAF结构域中,NKFDE基序位于串联GAF结构域的GAF-A (PDE6和11) 或GAF-B (PDE10) 中,或者在2个GAF结构域中都有PDE2和PDE5以及腺苷酸环化酶CyaB1和CyaB2[40]。Ho等[3]对PDE5串联GAF-A的NKFDE基序进行突变,结果表明,该基序突变导致GAF完全丧失结合以及调控环核苷酸的功能,而突变GAF-B中NKFDE基序无影响。这种突变方法常用于鉴别GAF-A和GAF-B结构域中哪一个负责配体结合和信号传导。在大量注释的GAF结构域中,对于结合cNMP的串联GAF结构域,NKFDE基序可能是1个特征基序,但是绝大多数的GAF结构域配体尚未确定[41]。进一步研究表明,在串联GAF结构域中,cNMP结合区域的正确折叠需要NKFDE基序,该基序并未直接参与cNMP结合,而是在形成结合腔时,起支持性的结构作用[22],猜想这个基序可能在某种程度上与构象运动有关,或者可能控制结合口袋的打开和关闭[5,36,42]。
3.2.2、 N端的功能
在串联GAF结构域中,N端位于GAF结构域上游,Bruder等[41]和Gross-Langenhoff等[42]采用PDE5和PDE11替代蓝细菌AC的GAF结构域和N端,研究嵌合体中PDE5和PDE11的N端功能,结果表明,PDE5和PDE11的N端参与了信号传导,通过与GAF结构域的相互作用调节酶的活性。PDE5的N端肽段长度为148个氨基酸,在102位有1个丝氨酸,该位点磷酸化能增加PDE5与cGMP的亲和力[41]。Bruder等[41]将N端逐渐截短至102位的丝氨酸,N端基本结构依然存在,且能与串联GAF相互作用,此时蓝细菌AC仍维持低水平的酶活,GAF结构域与cGMP的亲和力也无明显变化;但当从N端中去除102位氨基酸和更多氨基酸时,AC的活性增强,移除N端加入cGMP, AC活性可以达到最大。表明N端肽段与GAF之间通过复杂的相互作用抑制了AC的活性,cGMP介导的AC激活是通过将AC从抑制中释放,而不是直接激活。
PDE11A4是PDE11家族中唯一包含完整串联GAF结构域的剪接变异体,包含1对GAF-A/B结构域,N端的氨基酸长度为196,在其117和168位置有2个cNMP依赖性蛋白激酶的磷酸化位点 (Ser-117, Ser-168) ,任何一个位点磷酸化均可增加GAF-A与配体cGMP的亲和力,大大降低激活AC所需的cGMP浓度[17]。枯草芽孢杆菌CodY结合域有1个串联GAF结构域,其N端与异亮氨酸结合时,CodY结合域的螺旋连接螺旋的结构域展开,增加了CodY与DNA结合的亲和力[36,43]。因此,N端区域可能具有2种功能:一是影响串联GAF结构域与cGMP的亲和力,如PDE1A4的GAF-A结构域与cGMP的亲和力;二是直接作用于催化活性区域,通过与串联GAF结构域形成1个紧密的结构整体,影响配体结合区域的构象。
3.2.3、 各GAF串联结构域之间的关联
串联GAF结构域中研究较多的是包含2个GAF结构域GAF-A/B的情况,其中GAF-A和GAF-B可能具有不同的功能,但二者在结构和功能上存在相互作用。解析的小鼠PDE2全酶α亚基端串联GAF-A/B的晶体结构显示,每个GAF-B域结合1个cGMP从而进行酶活性与构象调节,而与GAF-B有着类似结构的GAF-A结构域不结合配体,主要发挥促进单体二聚化的功能[2]。Xu等[23]研究表明,哺乳动物PDE2和蓝细菌AC CyaB1的串联GAF能实现部分功能互换,若用PDE2的串联GAF结构域整体替换AC CyaB1的串联GAF结构域,可将cAMP激活酶改造成cGMP调节酶。这种功能替换在PDE5、PDE10和PDE11串联GAF也得到验证[23]。然而,只包含PDE5的1个GAF结构域 (GAF-A或B) 的AC CyaB1嵌合体并不具备调节功能,表明用于功能信号的本质是需要串联GAF的2个结构域[41]。
Hofbauer等[44]利用PDE5和PDE10的N端、GAF-A、GAF-B以及二者之间的链接段这4个独立部分组合成最可能的10种嵌合体,嵌合体下游来自蓝细菌AC,主要作为信号输出结构域,发现部分嵌合体可以被激活。在PDE5的N端、GAF-A、和PDE10的链接段、GAF-B组成的嵌合体中,能观察到cAMP和cGMP的信号传导,从而激活下游AC活性;但若将GAF-B的NKFDE基序进行D/A突变,会消除cAMP或cGMP的激活效应;将PDE10的链接段替换为PDE5的链接段也会完全消除嵌合体的信号传导。这表明GAF-A和GAF-B之间存在结构和功能的相互作用,且链接段可以将GAF结构域内部元件通过特异性的相互作用连接成有功能的整体[4,5]。因此,在串联GAF结构域中,GAF-A、α螺旋链接及GAF-B是一个高度有序的整体,且彼此之间存在特定的相互作用。
4、 结论与展望
GAF结构域作为生物体中重要的受体模块之一,通过与cGMP、cAMP、环状鸟苷酸等分子的结合进行信号转导。而GAF结构域通常是以串联的形式参与各种信号途径,在PDEs、蓝细菌ACs、植物光敏色素等信号转导中,串联排列的GAF结构域均具有重要作用。单独的GAF结构域则必须以二聚体形式发挥功能,且主要起调节相关酶活性的功能。在磷酸二酯酶抑制剂药物的开发中,哺乳动物PDEs中串联GAF结构域可作为药物靶标进行检测,为哮喘、自身免疫、炎性等疾病的治疗提供帮助[18,41,45,46]。近年来在光遗传学研究中发现,GAF结构域作为植物光敏色素的重要组成部分,在光转化模型的构建中发挥着重要作用[45]。最近浙江大学分子生物物理实验室研究发现GAF类似结构域在细菌耐辐射和DNA损伤修复中也可能具重要功能 (未发表) 。同时,有些共性问题尚亟待解决,如当腺嘌呤和鸟嘌呤进入GAF结构域结合区域时,GAF结构域如何识别和区分它们;其构象如何改变以便将配体完全包围以及最终如何激活磷酸二酯酶、腺苷酸环化酶等重要蛋白。因此,仍需对GAF结构域进行更深入的研究。
参考文献
[1] Wu X J, Yang H, Sheng Y, Zhu Y L, Li P P. Fluorescence properties of a novel cyanobacteriochrome GAF domain from spirulina that exhibits moderate dark reversion[J]. International Journal of Molecular Sciences, 2018, 19 (8) :2253-2259
[2] Banjac A, Zimmermann M O, Boeckler F M, Kurz U, Schultz A, Schultz J E. Intramolecular signaling in tandem-GAF domains from PDE5 and PDE10 studied with a cyanobacterial adenylyl cyclase reporter[J]. Cellular Signalling, 2012, 24 (3) :629-634
[3] Ho Y S, Burden L M, Hurley J H. Structure of the GAF domain, a ubiquitous signaling motif and a new class of cyclic GMP receptor[J]. The EMBO Journal, 2000, 19 (6) :5288-5299
[4] Martinez S E, Beavo J A, Hol W G. GAF domains:Two-billionyear-old molecular switches that bind cyclic nucleotides[J].Molecular Interventions, 2002, 2 (5) :317-323
[5] Martinez S E, Bruder S, Schultz A, Zheng N, Schultz J E, Beavo J A, Linder J U. Crystal structure of the tandem GAF domains from a cyanobacterial adenylyl cyclase:Modes of ligand binding and dimerization[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102 (8) :3082-3087
[6] Matera M G, Page C, Cazzola M. PDE inhibitors currently in early clinical trials for the treatment of asthma[J]. Expert Opinion on Investigational Drugs, 2014, 23 (9) :1267-1275
[7] Takala H, Lehtivuori H, Berntsson O, Hughes A, Nanekar R, Niebling S, Panman M, Henry L, Menzel A, Westenhoff S, Ihalainen J A. On the (un) coupling of the chromophore, tongue interactions, and overall conformation in a bacterial phytochrome[J]. Journal of Biological Chemistry, 2018, 293 (21) :8161-8172
[8] Rockwell N C, Martin S S, Lagarias J C. Identification of cyanobacteriochromes detecting far-red light[J]. Biochemistry, 2016, 55 (28) :3907-3919
[9] Wiltbank L B, Kehoe D M. Two cyanobacterial photoreceptors regulate photosynthetic light harvesting by sensing teal, green, yellow, and red light[J]. MBio, 2016, 7 (1) :e02130-15
[10] Fushimi K, Nakajima T, Aono Y, Yamamoto T, Win N N W, Ikeuchi M, Sato M, Narikawa R. Photoconversion and fluorescence properties of a red/green-type cyanobacteriochrome AM1_C0023g2that Dinds not only phycocyanobilin but also biliverdin[J].Frontiers in Microbiology, 2016, 7 (15) :588
[11] Yang T, Lv R, Li J, Lin H, Xi D. Phytochrome A and B negatively regulate salt stress tolerance of nicotiana tobacum via abscisic acidjasmonic acid synergistic cross talk[J]. Plant and Cell Physiology, 2018, 17 (21) :151-160
[12] Schultz J E, Dunkern T, Gawlitta-Gorka E, Sorg G. The GAFtandem domain of phosphodiesterase 5 as a potential drug target[J].Handbook of Experimental Pharmacology, 2011, 204:151-166
[13]罗江会, 马婧, 刘道凤, 杨建峰, 门维婷, 万超, 眭顺照, 李名扬.乙烯对蜡梅切花开放衰老及乙烯受体基因表达的影响[J].植物生理学报, 2015, 51 (2) :253-258
[14]张弢, 董春海.乙烯信号转导及其在植物逆境响应中的作用[J].生物技术通报, 2016, 32 (10) :11-17
[15] Lin Z, Johnson L C, Weissbach H, Brot N, Lively M O, Lowther W T. Free methionine- (R) -sulfoxide reductase from Escherichia coli reveals a new GAF domain function[J]. Proceeding of the National Academy of Sciences of the United States of America, 2007, 104 (23) :9597-9602
[16] Page C P, Spina D. Phosphodiesterase inhibitors in the treatment of inflammatory diseases[J]. Handbook of Experimental Pharmacology, 2011, 204 (9) :391-414
[17] Oliveira M A, Aquino B, Bonatto A C, Huergo L F, Chubatsu L S, Pedrosa F O, Souza E M, Dixon R, Monteiro R A. Interaction of Gln K with the GAF domain of Herbaspirillum seropedicae Nif A mediates NH+4-regulation[J]. Biochimie, 2012, 94 (4) :1041-1047
[18] Garcia A, Brea J, Gonzalez-Garcia A, Perez C, Cadavid M, Loza M, Martinez A, Gil C. Targeting PDE10A GAF domain with small molecules:A way for allosteric modulation with anti-inflammatory effects[J]. Molecules, 2017, 22 (9) :1472-1480
[19]闫军浩, 沈倩诚, 王争.磷酸二酯酶10A及其研究进展[J].上海交通大学学报 (医学版) , 2015, 32 (10) :11-17
[20] Steegborn C. Structure, mechanism, and regulation of soluble adenylyl cyclases-similarities and differences to transmembrane adenylyl cyclases[J]. Biochimica et Biophysica Acta, 2014, 1842 (12) :2535-2347
[21]郭艳辉, 梁秀银, 于双营, 郝豆豆, 杨慧云, 郜志颖, 徐如强.哺乳动物腺苷酸环化酶的表达调控与功能[J].中国细胞生物学学报, 2018, 40 (3) :426-438
[22] Cann M J. Sodium regulation of GAF domain function[J].Biochemical Society Transactions, 2007, 35 (5) :1032-1034
[23] Xu X L, Gutt A, Mechelke J, Raffelberg S, Tang K, Miao D, Borsarelli C D, Zhao K H, G?rtner W. Combined mutagenesis and kinetics characterization of the bilin-binding GAF domain of the protein Slr1393 from the Cyanobacterium Synechocystis PCC6803[J]. Chembiochem:A European Journal of Chemical Biology, 2014, 15 (8) :1190-1199
[24] Vujicic-Zagar A, Dulermo R, Le Gorrec M, Vannier F, Servant P, Sommer S, de Groot A, Serre L. Crystal structure of the Irr E protein, a central regulator of DNA damage repair in deinococcaceae[J].Journal of Molecular Biology, 2009, 386 (3) :704-716
[25]黎婷婷, 王梁燕, 王云光, 华跃进.耐辐射奇球菌DNA损伤响应开关蛋白PprI的研究进展[J].核农学报, 2016, 30 (6) :1106-1110
[26] Shi Y, Wu W, Qiao H P, Yue L, Ren L L, Zhang S Y, Yang W, Yang Z S. The protein PprI provides protection against radiation injury in human and mouse cells[J]. Scientific Reports, 2016, 21 (6) :264-266
[27] Russwurm M, Schlicker C, Weyand M, Koesling D, Steegborn C.Crystal structure of the GAF-B domain from human phosphodiesterase 5[J]. Proteins, 2011, 79 (5) :1682-1687
[28] Schultz J E. Structural and biochemical aspects of tandem GAF domains[J]. Handbook of Experimental Pharmacology, 2009, 15 (191) :93-109
[29]张颖, 陈娟.植物光受体的起源与进化研究进展[J].黄冈师范学院学报, 2018, 38 (3) :35-41
[30]刘冰冰.蓝细菌光敏色素结构域体内重组及光化学性质研究[D].武汉:华中农业大学, 2013:12-19
[31] Velazquez Escobar F, Utesch T, Narikawa R, Ikeuchi M, Mroginski M A, Gartner W, Hildebrandt P. Photoconversion mechanism of the second GAF domain of cyanobacteriochrome An PixJ and the cofactor structure of its green-absorbing state[J]. Biochemistry, 2013, 52 (29) :4871-4880
[32] CataláR, López-Cobollo R, Mar Castellano M, Angosto T, Alonso J M, Ecker J R, Salinas J. The Arabidopsis 14-3-3 protein race cold inducible 1A links low-temperature response and ethylene biosynthesis to regulate freezing tolerance and cold acclimation[J].The Plant Cell, 2014, 26 (8) :3326-3342
[33]谢芳.拟南芥乙烯受体信号作用机理的研究[D].上海:中国科学院研究生院 (上海生命科学研究院) , 2007:25-30
[34] Bender A T, Beavo J A. Cyclic nucleotide phosphodiesterases:Molecular regulation to clinical use[J]. Pharmacological Reviews, 2006, 58 (3) :488-520
[35] Orban C, Vasarhelyi Z, Bajnok A, Sava F, Toldi G. Effects of caffeine and phosphodiesterase inhibitors on activation of neonatal T lymphocytes[J]. Immunobiology, 2018, 223 (11) :627-633
[36] Chen H J, Li N, Luo Y, Jiang Y L, Zhou C Z, Chen Y, Li Q. The GDP-switched GAF domain of Dcp A modulates the concerted synthesis/hydrolysis of c-di-GMP in mycobacterium smegmatis[J].The Biochemical Journal, 2018, 475 (7) :1295-1308
[37] Abdel-Magid A F. Selective inhibitors of phosphodiesterase 4B (PDE-4B) may provide a better treatment for CNS, metabolic, autoimmune, and inflammatory diseases[J]. ACS Medicinal Chemistry Letters, 2017, 8 (11) :1132-1133
[38]张梦迪.小鼠腺苷酸环化酶Ⅲ缺失对部分嗅觉受体和相关分子表达的影响[D].石家庄:河北大学, 2016:50-75
[39] Kanacher T, Schultz A, Linder J U, Schultz J E. A GAF-domainregulated adenylyl cyclase from Anabaena is a self-activating c AMPswitch[J]. The EMBO Journal, 2002, 21 (14) :3672-3680
[40] Zoraghi R, Bessay E P, Corbin J D, Francis S H. Structural and functional features in human PDE5A1 regulatory domain that provide for allosteric cG MP binding, dimerization, and regulation[J].Journal of Biological Chemistry, 2005, 280 (12) :12051-12063
[41] Bruder S, Schultz A, Schultz J E. Characterization of the tandem GAF domain of human phosphodiesterase 5 using a cyanobacterial adenylyl cyclase as a reporter enzyme[J]. The Journal of Biological Chemistry, 2006, 281 (29) :19969-19976
[42] Gross-Langenhoff M, Hofbauer K, Weber J, Schultz A, Schultz J E.cA MP is a ligand for the tandem GAF domain of human phosphodiesterase 10 and cG MP for the tandem GAF domain of phosphodiesterase 11[J]. Journal of Biological Chemistry, 2006, 281 (5) :2841-2846
[43] Ling B P, Sun M, Bi S W, Jing Z H, Wang Z G. Molecular dynamics simulations of isoleucine-release pathway in GAF domain of N-CodY from Bacillus Subtilis[J]. Journal of Molecular Graphics&Modelling, 2013, 44 (16) :232-240
[44] Hofbauer K, Schultz A, Schultz J E. Functional chimeras of the phosphodiesterase 5 and 10 tandem GAF domains[J]. Journal of Biological Chemistry, 2008, 283 (37) :25164-25170
[45] Schultz J E, Dunkern T, Gawlitta-Gorka E, Sorg G. The GAFtandem domain of phosphodiesterase 5 as a potential drug target[J].Handbook of Experimental Pharmacology, 2011, 204 (9) :151-166
[46]赖增伟, 吴德燕, 张天华, 黄仪有, 李哲, 吴一诺, 罗海彬.新型磷酸二酯酶特异性抑制剂的发现及识别机制[J].中国药理学与毒理学杂志, 2017, 31 (5) :480-481





