摘 要: 目的:定向诱导人胚胎干细胞分化为心肌细胞,对分化过程中胚胎干细胞、心肌祖细胞和心肌细胞糖酵解能力和线粒体氧化磷酸化能力进行实时定量检测,探索分化过程中细胞能量代谢表型的转换机制.方法:用GSK3抑制剂CHIR99021和Wnt信号通路小分子抑制剂IWP2的方法定向分化人胚胎干细胞为心肌祖细胞和心肌细胞;细胞免疫荧光检测人胚胎干细胞标志物,流式细胞术检测人心肌祖细胞和心肌细胞标志物;应用细胞外流量分析(Extracellular Flux Analysis)方法检测人胚胎干细胞、心肌祖细胞和心肌细胞能量代谢情况.结果:人胚胎干细胞干性保持稳定,均表达Nanog、OCT4、SOX2细胞标志物;在向心肌分化过程中,第7d心肌祖细胞标志物Isl1表达99%以上,分化第15d心肌细胞标志物cTnT表达83%以上;人胚胎干细胞糖酵解代谢能力最强,心肌细胞线粒体功能最强,心肌祖细胞处于两种代谢方式的过度阶段.结论:在人胚胎干细胞向心肌细胞分化的过程中,细胞糖酵解能力逐渐减弱,线粒体氧化磷酸化能力逐渐增强,细胞的能量代谢类型发生转变.
关键词: 人胚胎干细胞; 心肌祖细胞; 心肌细胞; 能量代谢; 糖酵解; 线粒体;
Abstract: Objective We performed directional differentiation of human embryonic stem cells into cardiomyocytes. In order to explore the mechanisms of cell metabolic phenotype conversion during cardiac lineage differentiation ,we conducted real-time quantitative detection of glycolytic and mitochondrial oxidative phosphorylation capabilities of embryonic stem cells, cardiac progenitor cells, and cardiomyocytes during differentiation. Methods: GSK3 inhibitor CHIR99021 and Wnt signaling pathway inhibitor IWP2 were used to differentiate human embryonic stem cells into cardiac progenitor cells and cardiomyocytes. Immunocytochemistry was used to detect the expression of human embryonic stem cell markers. Flow cytometry was used to detect the markers of human cardiomyocytes and cardiac progenitor cells. Extracellular Flux Analysis was used to test the energy metabolic phenotype of human embryonic stem cells, cardiac progenitor cells, and cardiomyocytes. Results: The stemness of human embryonic stem cells remains stable and all express Nanog, OCT4 and SOX2 cell markers. During the differentiation, more than 99% cells expressed cardiac progenitor cell marker Isl1 on the 7th day, and more than 83% of cells expressed the cardiomyocytes marker cTnT on the 15th day. Human embryonic stem cells have the strongest glycolytic metabolism capacity, while cardiomyocytes have the strongest mitochondrial oxidative phosphorylation capability. Cardiac progenitor cells are in the transition stage of the two ways of metabolism. Conclusion: During the differentiation of human embryonic stem cells into cardiomyocytes, cells gradually loss the glycolytic capacity, while the mitochondrial oxidative phosphorylation capacity gradually increases, followed by the cell metabolic phenotype conversion.
Keyword: human embryonic stem cells; cardiac progenitor cells; cardiomyocytes; energy metabolism; glycolysis; mitochondria;
近年来,心血管疾病已经成为威胁人类健康与生命的重大疾病,造成的死亡人数远远高于肿瘤[1]。其中风心病、心肌病和冠脉疾病等心脏疾病的核心病变是心肌细胞的数量减少和活力衰竭,未来临床治疗此类疾病的重要手段是心肌细胞补偿替代性疗法.研究表明,成年人心肌细胞每年的更新率小于1%,心脏中后天新生成的心肌细胞也只占40%[2],因此,急需一种稳定高效的心肌细胞获得方法,要求得到的细胞尽可能接近人体心肌细胞的生理状态,而且不受伦理问题的限制.作为研究和治疗心血管疾病的重要工具和关键因素,如何稳定有效的获得心肌细胞显得尤为重要.干细胞具有无限或较长期自我更新能力,并能产生至少一种高度分化的子代细胞,具有极强的可塑性.人胚胎干细胞作为一种全能干细胞,具有多系分化发育的特点,将其定向诱导成心肌祖细胞或心肌细胞,可以提供丰富的细胞资源,已经成为心肌细胞构建的主要方法之一,为心肌细胞替代治疗奠定了基础.目前,通过加入各类生长因子和小分子化合物,模拟体内心肌细胞的分化产生过程,可以得到纯度较高的心肌细胞[3],其在形态结构[4]、基因表达[5]、电生理特性[6]、离子通道[7]等特征上均和人体内心肌细胞相同.细胞的生命过程与物质能量代谢密切相关,在人胚胎干细胞在向心肌细胞分化的过程中,细胞类型的转变与能量代谢的关系值得关注.本实验在体外诱导人胚胎干细胞定向分化为心肌祖细胞和心肌细胞,并对各自细胞标志物进行鉴定,建立了一种人胚胎干细胞分化为心肌细胞的优化方法.通过对此细胞分化过程中人胚胎干细胞、心肌祖细胞和心肌细胞细胞外氧气消耗速率OCR和细胞外酸化率ECAR进行实时和定量检测,得到了各自细胞的糖酵解能力和线粒体氧化磷酸化能力关键指标,揭示此过程中细胞分化依赖的能量代谢表型的转换机制,为心血管相关疾病治疗提供新思路.

1、材料
1.1、细胞株
人胚胎干细胞系H9购自上海细胞库.
1.2、主要试剂
mTeSR1购自STEMCELL公司、Y27632、IWP2和CHIR99021购自Selleckchem公司、B27/ B-27 supplement without insulin、RPMI购自Life公司;Nanog抗体、SOX2抗体购自Abcam公司,OCT4抗体购自Santa Cruz公司,ISL1抗体购自DSHB公司、cTnT抗体和DAPI购自Thermo 公司、FITC标记的羊抗鼠抗体购自Gibco公司;Seahorse XF Base Medium、Seahorse XF Calibrant Solution、Seahorse XFe96 FluxPaks、Seahorse XF Cell Mito Stress Test、Seahorse XF Glycolysis Stress Test购自安捷伦公司,葡萄糖、丙酮酸钠、L-谷氨酰胺购自Sigma公司;Pierce? BCA Protein Assay Kit购自Thermo公司.
1.3、主要仪器
BD FACSAriaII流式细胞分选仪(BD公司)、Seahorse XFe96细胞代谢呼吸动态分析仪(安捷伦公司)、酶标仪、荧光细胞成像仪(BIO-RAD公司).
2、方法
2.1、人H9胚胎干细胞的培养与传代
H9 hESCs购自上海细胞库.用mTeSR1基础培养基对H9 hESCs进行培养,当细胞的汇合度达到80%—90%时进行传代.在传代之前,用DMEM/F12按1:50的比例稀释Matrigel(BD,354230),每孔1.5ml加到6孔板中,在37℃培养箱中放置30min可用.用DPBS洗孔将要消化的细胞,加1mL每孔 Versene(Gibco,15040)在5% CO2 、37℃培养箱中放置6min,吸去Versene,加1mL每孔含有5?mol/L Y27632(Selleck,S1049)的mTeSR1培养基,用1mL移液器吹下细胞后转移至15mL BD离心管中,额外加入新鲜的含有5?mol/L Y27632的mTeSR1后,按1:10的比例分到用Matrigel包被过的细胞培养板中.将细胞置于5% CO2 、37 ℃培养箱中培养24h后,用DPBS洗孔,加入2mL mTeSR1培养基,放回原培养箱继续培养.培养至第3d至5d时,根据细胞密度更换2mL-3mL不等的培养基,直至细胞的汇合度达到80%—90%时,进行细胞传代.
2.2、人胚胎干细胞向心肌细胞的定向诱导分化
当6孔板中人胚胎干细胞汇合度达到80%时消化细胞,用含有5?mol/L Y27632的mTeSR1培养基按照2×106个细胞/mL的密度重悬,按5×105个细胞每孔分于用Matrigel包被过的12孔板中,24h后用DPBS洗孔,加入1mL mTeSR1培养基培养额外的24h.分化第0d,弃掉原培养基,加入1.5mL每孔含有12?mol/L CHIR99021(Selleck,S1263)的RPMI/B-27-insulin培养基.分化第2d,更换1.5mL每孔RPMI/B-27-insulin培养基.分化第3d,更换1.5mL每孔含有5 ?mol/L IWP2(Selleck,S7085)的RPMI/B-27-insulin的培养基.分化第5d到7d,更换1.5mL每孔RPMI/B-27-insulin的培养基.分化第8d开始,每3天更换1.5mL每孔RPMI/B-27培养基.分化的第12-14d可在显微镜下观察到心肌细胞收缩.
2.3、免疫荧光检测胚胎干细胞干性标志物
消化人胚胎干细胞后按1:50的比例分于用Matrigel包被过的24孔细胞培养板中,待细胞贴壁后用DPBS洗孔.加入4%PFA室温固定15min.用PBS洗孔3次,加入200?L每孔含有2%FBS和0.2%TritonX-100的PBS溶液,室温孵育30分钟.用PBS洗孔3次,用200?L含有5%脱脂牛奶和0.1%TritonX-100的PBS溶液按不同比例稀释一抗,OCT4(1:500,Santa Cruz,sc-5279),SOX2(1:500,Abcam,ab92494),NANOG(1:500,Abcam,ab80892),4℃过夜孵育.用PBS洗孔3次,按1:1000的比例用PBS溶液稀释二抗,Goat anti mouse IgG2b 488(Gibco,A-21141),Goat anti rat 488 (Gibco,A-11008),室温孵育30min.PBS洗孔3次,按1:5000稀释DAPI(Thermo,D1306),室温孵育5min.用PBS洗孔3次后在荧光显微镜下观察或成像.
2.4、流式细胞术检测心肌祖细胞和心肌细胞标志物
根据试剂盒eBioscience? Foxp3 / Transcription Factor Fixation/Permeabilization Concentrate and Diluent(Thermo,00-5521-00)提供的实验流程检测细胞标志物.简而言之,消化心肌祖细胞或心肌细胞后,用1×通透液重悬细胞,400 ×g离心5分钟后去上清,留100 ?L在管底,加入1mL Foxp3 Fixation/Permeabilization工作液后室温放置30min.加入1mL 1×通透液,400×g离心5分钟后去上清,用100?L 1×通透液重悬细胞后加入终浓度为2%FBS,室温放置15分钟.以不同稀释比例加入一抗,ISL1(1:400,DSHB,39.4D5-s),TNNT2(1:1000,Thermo,MA5-12960),4℃过夜孵育.加入1mL 1×通透液,400 ×g离心5min后去上清,用200μL 1×通透液重悬细胞后按1:1000稀释二抗,Goat anti mouse IgG2b 488(Gibco,A-21141),Goat anti mouse IgG1 488(Gibco,A-21121),室温放置30分钟.加入1mL 1x通透液,400×g离心5min后去上清,用300?L含有2%FBS和0.5mM EDTA的PBS重悬细胞后转移至流式管中上样分析.
2.5、分化过程中细胞能量代谢的检测
应用Seahorse XFe96细胞代谢分析仪(Agilent)实时同步检测细胞外2.28μL体系氧气消耗速率(OCR)和细胞外酸化速率(ECAR).提前用Matrigel(BD,354230)和Fibronectin(Gibco,33016015)包被XFe96细胞培养板,分别接种人h9胚胎干细胞(未分化)、心肌祖细胞(分化第6d)、心肌细胞(分化第12d,Fibronectin包被),每组8个复孔,其余空白孔作为背景,放入培养箱继续培养.XFe96探针板提前用校准液37℃水化24h.分别配制糖酵解应激检测实验培养液,含有2mmol/L谷氨酰胺(Sigma,G8540);配制线粒体应激检测培养液,含有10mmol/L葡萄糖(Sigma,G7528)、2mmol/L谷氨酰胺(Sigma,G8540)、1mmol/L丙酮酸钠(Sigma,S8636),37℃调pH值为7.40±0.05后进行细胞换液,即尽可能将原来的细胞生长培养基替换为对应的测试培养基.实验过程中糖酵解能力测试分别注射终浓度为10mmol/L的葡萄糖(Sigma,G7528)、2?mol/L的寡霉素(abcam,ab141829)、50mmol/L的2-脱氧葡萄糖(Sigma,D8375);线粒体压力测试分别注射2?mol/L的寡霉素(Abcam,ab141829)、1.75 ?mol/L的羰基-氰-对-三氟甲氧基苯肼(Sigma,C2920)、1?mol/L的抗霉素A(Abcam,ab141904)和鱼藤酮(Sigma,R8875).实验结果按照每孔蛋白质含量(?g)标准化,并扣除包被蛋白质含量,按照Seahorse提供的generator报告生成器计算糖酵解能力和线粒体压力测试相关指标.
2.6、统计学分析
实验所有数据使用GraphPad Prism 6.01软件进行分析,数据以X ? X-± sem 表示,采用student’s t方法进行检验,p<0.05为差异具有统计学意义.
3、结果
3.1、H9人胚胎干细胞干性标志物的表达
免疫荧光检测胚胎干细胞相关标志物Nanog、OCT4、SOX2表达,结果显示未分化的胚胎干细胞均表达相关干性标志物(图1)
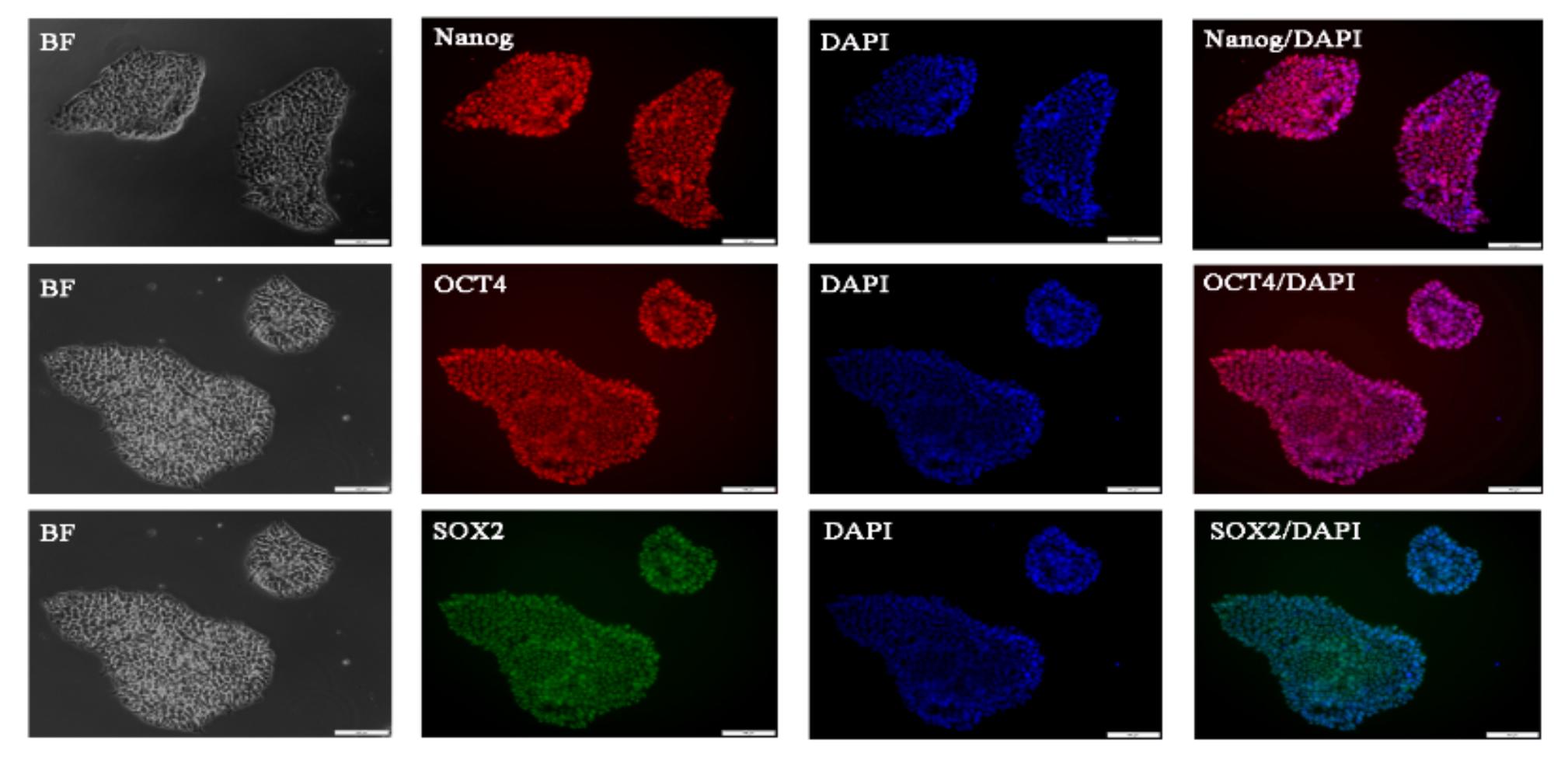
Figure 1. Immunofluorescence staining of human embryonic stem cell markers: Nanog, OCT4, SOX2.
The results of immunofluorescence staining of human embryonic stem cells are shown in the figure. The cells in the visual field all expresse the stem genes Nanog, OCT4 and SOX2, indicating that the stem cells were in good condition on day 0 of differentiation.
3.2、流式细胞术检测分化阶段心肌祖细胞和心肌细胞标志物的表达
流式细胞术结果显示分化进程进入第7d,细胞标志物Isl1比例为99.6%±0.35%,n=3,确认为心肌祖细胞;分化进程进入第14d,细胞标志物cTnT比例为83.6%±0.67%,n=3,确认为心肌细胞。
Figure 2. Expression of specific markers of cardiac progenitor cells and cardiomyocytes
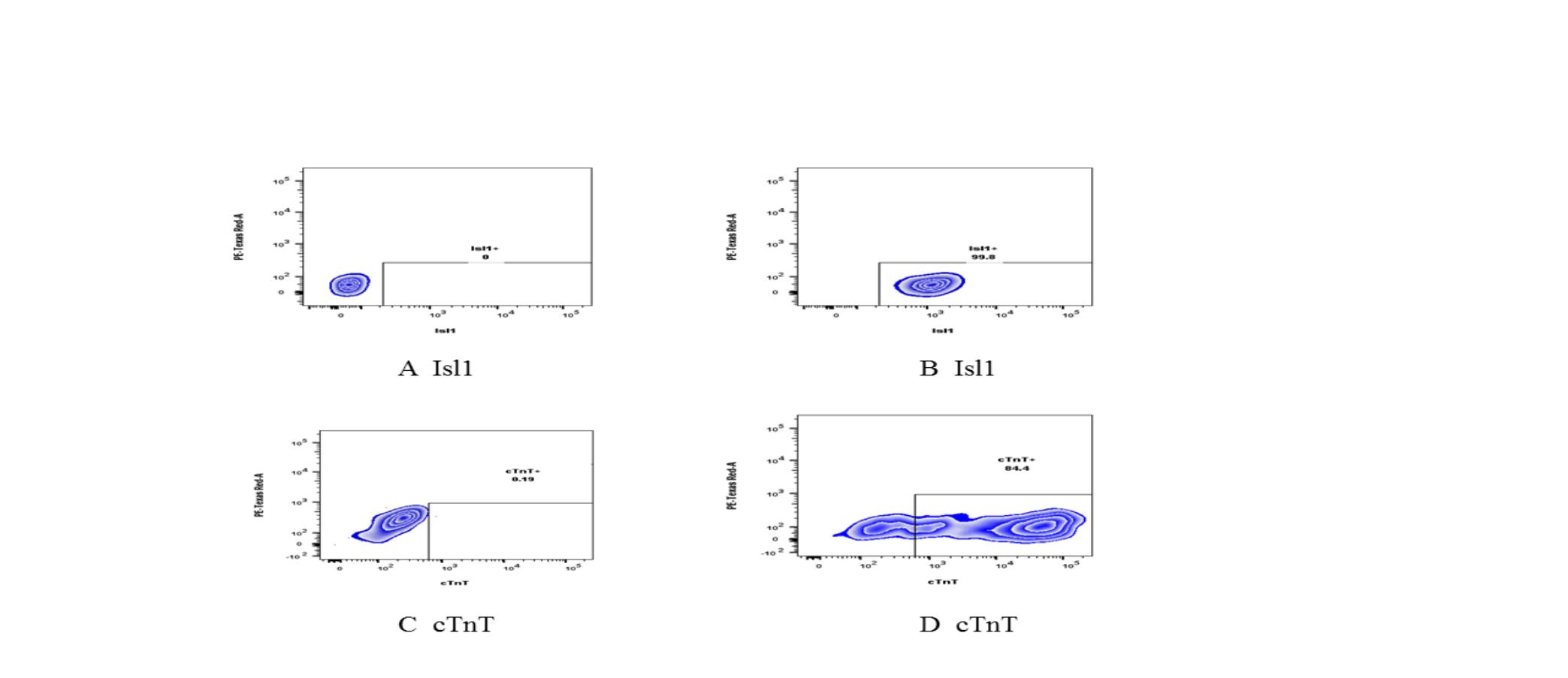
A: Cardiac progenitor cells Isl1 isotype control group did not express Isl1 on the 7th day of differentiation. B: Cardiac progenitor cells Isl1 expression positive rate was 99.8% on the 7th day of differentiation. C: Cardiomyocytes cTnT isotype control group on the 14th day of differentiation ,The background of positive expression was 0.19%. D: The positive rate of cTnT expression on the 14th day of differentiation was 84.4%.
3.3 胚胎干细胞、心肌祖细胞和心肌细胞糖酵解能力测试
应用Extracellular Flux Analysis方法检测人胚胎干细胞(未分化)、心肌祖细胞(分化第7d)和心肌细胞(分化第14d)的细胞糖酵解能力指标.通过在测试过程中分别加入葡萄糖(glucose,10mmol/L)、寡霉素(oligomycin,2?mol/L)、2脱氧葡萄糖(2-DG,50mmol/L),引起细胞ECAR值的改变,计算相关糖酵解代谢指标,最终数据按照每孔所含细胞的蛋白质总量进行标准化(图3A).处于未分化状态的胚胎干细胞在基础糖酵解能力、最大糖酵解能力方面ECAR值最高,与心肌祖细胞(P<0.01,P<0.001)和心肌细胞(P<0.01,P<0.001)差异显着.心肌细胞在糖酵解能力储备方面ECAR值最小与胚胎干细胞和心肌祖细胞存在差异(P<0.001,P<0.05)(图3B)。
Figure 3. Detection of glycolytic capacity of cells during differentiation.
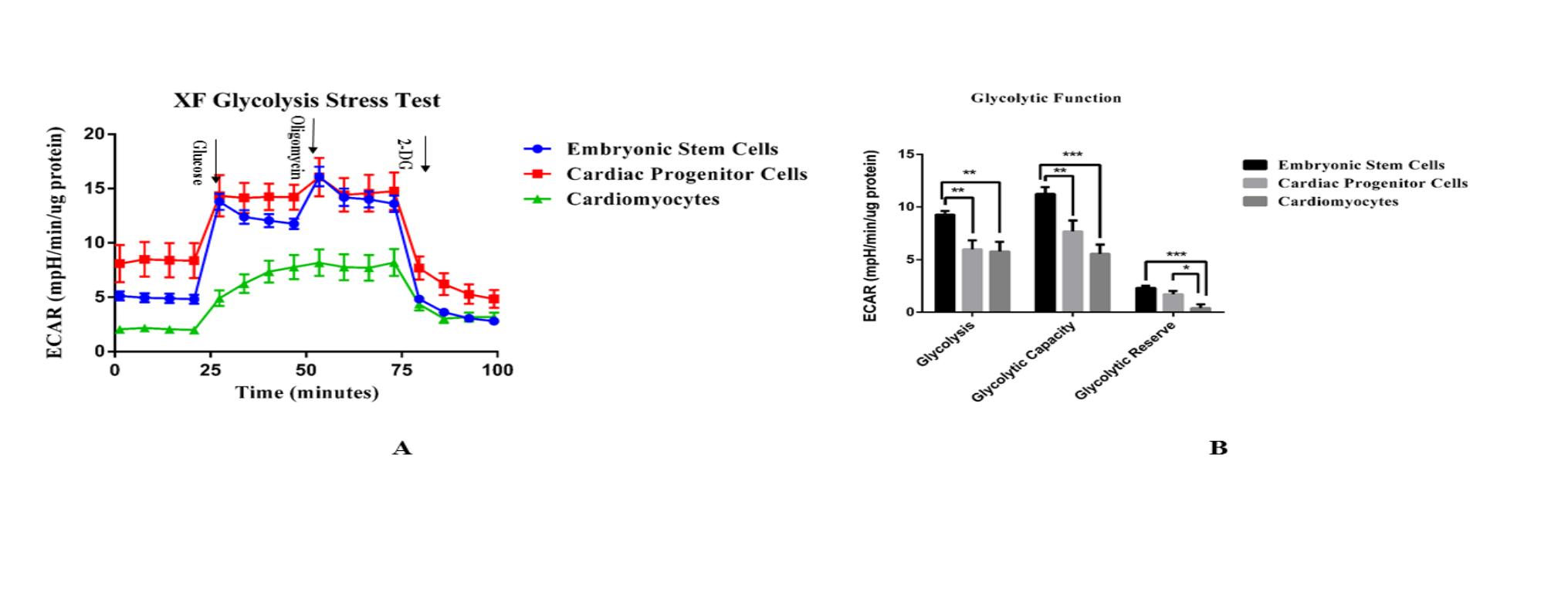
A. Embryonic stem cells, cardiac progenitor cells, and cardiomyocytes glycolytic stress test typical hippocampal curves, showing the changes in three types of extracellular acidification rate (ECAR) over time. The measured value of each point in the figure is shown by mean value X ? X-±standard error (SEM), n≥5. B. According to the cell glycolysis stress curve, the basic glycolysis, maximum glycolysis, and glycolytic capacity reserve of different cells are calculated. The data in each column of the histogram are shown as the mean value X ? X-± standard error (SEM), n≥ 5. The significant difference P value was calculated by the student's t method, * represents P <0.05, ** represents P <0.01, and *** represents P <0.001.
3.4、胚胎干细胞、心肌祖细胞和心肌细胞线粒体压力测试
应用Extracellular Flux Analysis方法检测人胚胎干细胞(未分化)、心肌祖细胞(分化第7d)和心肌细胞(分化第14d)的细胞线粒体压力相关能力指标.通过在测试过程中分别加入寡霉素(Oligomycin,2?mol/L)、羰基-氰-对-三氟甲氧基苯肼(Fccp,1.75?mol/L)、抗霉素A和鱼藤酮(Antimycin/Rotenone,1?mol/L)引起细胞OCR值的改变,计算相关线粒体代谢能力指标,最终数据按照每孔所含细胞的蛋白质总量进行标准化(图4A).在线粒体基础代谢方面,未分化的胚胎干细胞基础呼吸和氧化磷酸化ATP产能最低,与分化第7d的心肌祖细胞(P<0.001)和分化第14d的心肌细胞(P<0.001,P<0.01)具有显着性差异(图4C).在细胞线粒体功能指标方面,胚胎干细胞最大呼吸和呼吸储备能力最低,与分化第7d的心肌祖细胞(P<0.001,P<0.05)和分化第14d的心肌细胞(P<0.001)具有显着性差异;心肌祖细胞与心肌细胞在这两方面也具有显着性差异(P<0.01,P<0.001)(图4B).通过计算细胞的偶联效率,即细胞ATP生成/基础呼吸,胚胎干细胞与心肌祖细胞和心肌细胞存在显着性差异(P<0.01)(图4D)
Figure 4. Cell mitochondrial stress test during differentiation.
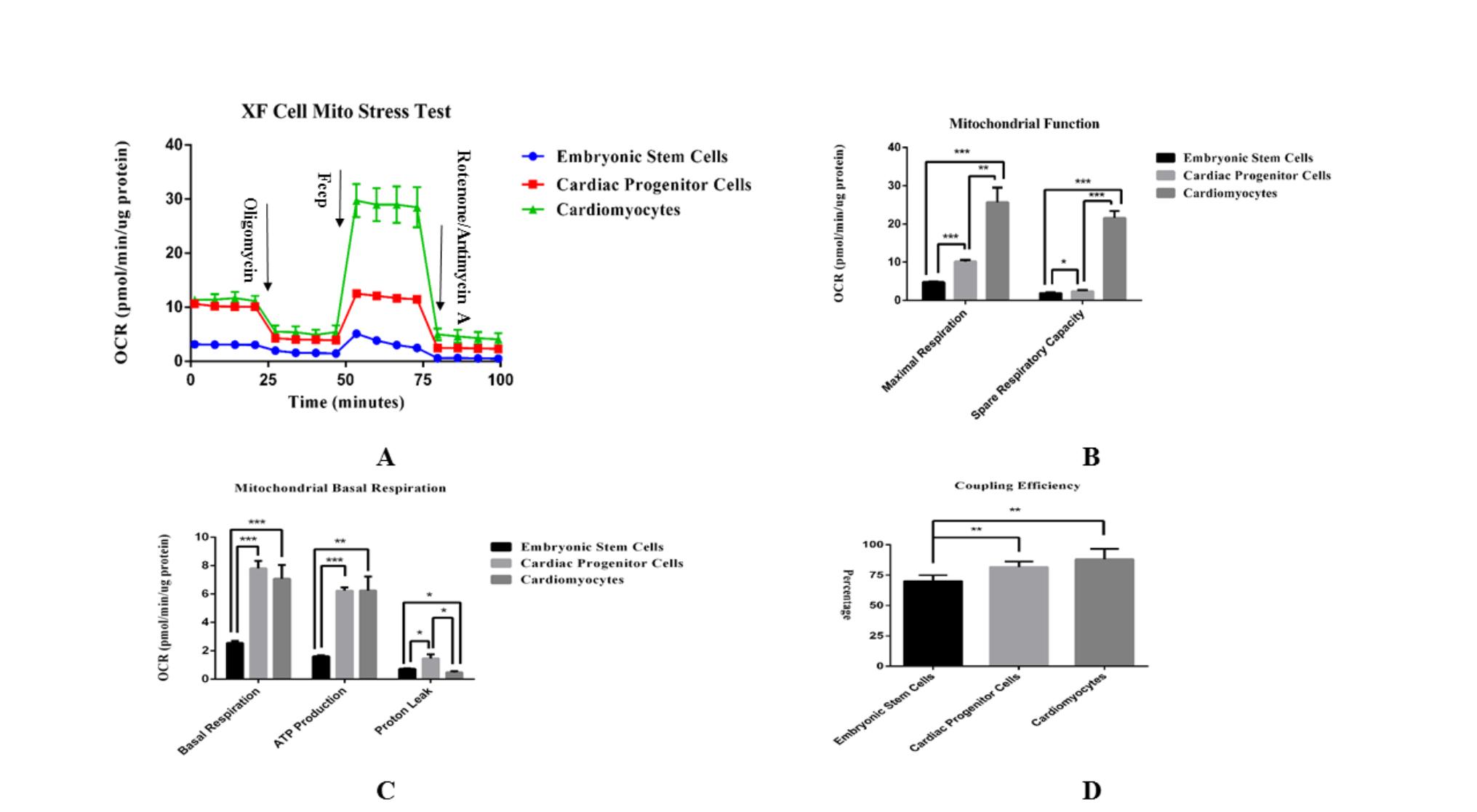
A. The typical hippocampal curve of embryonic stem cells, cardiac progenitor cells, and cardiomyocytes mitochondrial stress tests shows the changes in the oxygen consumption rate (OCR) of three types of cells over time. The measured value of each point in the figure is shown by the mean value X ? X-±standard error (SEM), n≥4. B. Calculate the maximum respiratory capacity and respiratory reserve value of different cells according to the cell mitochondrial stress test curve. C. Calculate the mitochondrial basal metabolism index according to the cell mitochondrial stress test curve, including basal respiration, ATP generation, proton leakage. D. Calculate the coupling efficiency of different cells according to the cell mitochondrial stress test curve, that is, the ratio of ATP production to basal respiration. The datas in each column of the histogram are shown as mean value X ? X-±standard error (SEM), n≥5. The significant difference P value was calculated by the student's t method, * represents P <0.05, ** represents P <0.01, and *** represents P <0.001
4、讨论
人心脏发育起始于胚胎发育早期,原肠胚期中胚层前体细胞迁移至前侧板中胚层后开始向心血管分化[8].目前,在体外诱导心肌细胞的产生是模拟胚胎心脏发育早期的关键步骤,阶段性激活或者抑制某些信号通路.Wnt 信号通路在心脏发育和血管生成中起重要作用,在心脏发育早期激活Wnt/β-catenin 信号通路,促进心脏祖细胞增殖和迁移,而心脏发育晚期抑制其活性,促进心肌细胞分化[9].人胚胎干细胞可以分化成三个胚层中各种类型的细胞,分化后的细胞在体外可长时间培养、传代,这种特性为研究治疗心肌梗死的细胞替代疗法和心肌组织工程提供了无限可能性.本工作在以往的研究基础上总结经验,优化了胚胎干细胞分化为心肌细胞的方法,用糖原合成激酶3(GSK3)抑制剂CHIR99021和Wnt信号通路小分子抑制剂IWP2的方法定向分化人胚胎干细胞为心肌祖细胞和心肌细胞.在分化第0d加入糖原合成激酶3(GSK3)抑制剂CHIR99021诱导中胚层细胞形成,第3d加入Wnt信号通路小分子抑制剂IWP2诱导心肌中胚层形成.实验结果显示,处在未分化状态的h9人胚胎干细胞系经细胞免疫荧光证明均表达Nanog、OCT4、SOX2干细胞特异性基因,开始分化后第7d天,流式细胞术测定细胞标志物Isl1比例为99.6±0.35%,n=3,确认为心肌祖细胞,分化到第14d,流式细胞术测定细胞标志物cTnT比例为83.6±0.67%,n=3,确认为心肌细胞.至此,本工作完成了分化过程中胚胎干细胞、心肌祖细胞和心肌细胞各个时期细胞标志物的鉴定,分化过程科学可靠.
体外的干细胞分化体系有助于研究分化过程中哪些必要的影响因子在发挥作用,可以得到有活性的功能细胞.在分化的过程中,细胞在代谢方面也在发生一系列的动态改变.从干细胞的分化开始直至最终功能细胞的形成,处于活细胞状态下的分化依赖的细胞代谢分析是非常值得研究者注意的.新陈代谢与细胞的生命过程密切相关,伴随着物质分子和能量的变化,直接或间接参与细胞各方面的功能[10],是一种积极的调控形式.细胞主要存在两种能量代谢途径,即细胞在无氧条件下的糖酵解作用和消耗氧气的氧化磷酸化作用.有研究显示即使在正常的氧气条件下,像癌细胞和干细胞这样快速增殖的细胞也会优先选择糖酵解作用,这种能量代谢机制的转换可以提供给细胞更多的代谢中间物以满足细胞生长需要,例如氨基酸等,同时可以避免细胞产生氧损伤,帮助细胞生成更多的NADPH[11].心肌细胞具有高密度的线粒体分布,线粒体ATP的合成随着心肌细胞能量需求变化而发生适应性改变[12],线粒体融合—分裂的动态平衡对心肌细胞能量代谢和收缩功能的维持起着至关重要的作用[13].本工作应用Seahorse XFe96细胞外流量分析方法对分化阶段的人胚胎干细胞、心肌祖细胞和心肌细胞糖酵解能力和线粒体氧化磷酸化能力进行实时和定量的检测.结果显示人胚胎干细胞糖酵解代谢能力最强,在基础糖酵解能力、最大糖酵解能力、糖酵解潜能方面高于其他两种细胞.心肌细胞线粒体功能最强,在线粒体最大呼吸能力和呼吸潜能方面高于其他两种细胞.心肌祖细胞处于两种代谢方式的过度阶段,在基础糖酵解,最大糖酵解能力与心肌细胞相似,糖酵解潜能偏向于胚胎干细胞;在基础ATP生成能力上与心肌细胞相似,线粒体最大呼吸潜能偏向于胚胎干细胞.说明在人胚胎干细胞向心肌细胞分化的过程中,细胞糖酵解能力逐渐减弱,线粒体氧化磷酸化能力逐渐增强,细胞的能量代谢类型发生转变.
总之,本研究优化了人胚胎干细胞定向分化为心肌细胞的方法,通过分析此分化过程中细胞两条主要的能量代谢通路糖酵解作用和线粒体氧化磷酸化作用,揭示了分化依赖的细胞能量代谢类型的转变,为心血管疾病的理论研究和临床治疗提供了基础.
参考文献
[1] 吴晓丹,曾志羽. 人诱导性多功能干细胞分化的心肌细胞在心血管疾病中的应用. 中华老年心脑血管病杂志. 2018, 20(05):106-8
[2] Bergmann O, Bhardwaj R D, Bernard S, et al. Evidence for cardiomyocyte renewal in humans. Science. 2009, 324(5923):98-102
[3] Lian X, Zhang J, Azarin S M, et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/beta-catenin signaling under fully defined conditions. Nat Protoc. 2013, 8(1):162-75
[4] Wendel J S, Ye L, Tao R, et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Transl Med. 2015, 4(11):1324-32
[5] Pekkanen-Mattila M, Chapman H, Kerkela E, et al. Human embryonic stem cell-derived cardiomyocytes: demonstration of a portion of cardiac cells with fairly mature electrical phenotype. Exp Biol Med (Maywood). 2010, 235(4):522-30
[6] Zhang J, Wilson G F, Soerens A G, et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circ Res. 2009, 104(4):e30-41
[7] Chan H Y, Cheung M C, Gao Y, et al. Expression and reconstitution of the bioluminescent Ca(2+) reporter aequorin in human embryonic stem cells, and exploration of the presence of functional IP3 and ryanodine receptors during the early stages of their differentiation into cardiomyocytes. Sci China Life Sci. 2016, 59(8):811-24
[8] Garry D J, Olson E N. A common progenitor at the heart of development. Cell. 2006, 127(6):1101-4
[9] Lian X, Zhang J, Zhu K, et al. Insulin inhibits cardiac mesoderm, not mesendoderm, formation during cardiac differentiation of human pluripotent stem cells and modulation of canonical Wnt signaling can rescue this inhibition. Stem Cells. 2013, 31(3):447-57
[10] Ryall J G, Cliff T, Dalton S, et al. Metabolic reprogramming of stem cell epigenetics. Cell Stem Cell. 2015, 17(6):651-62
[11] Ma T, Xie M, Laurent T, et al. Progress in the reprogramming of somatic cells. Circ Res. 2013, 112(3):562-74
[12] Sauvanet C, Duvezin-Caubet S, di Rago J P, et al. Energetic requirements and bioenergetic modulation of mitochondrial morphology and dynamics. Semin Cell Dev Biol. 2010, 21(6):558-65
[13] Chen L, Knowlton A A. Mitochondrial dynamics in heart failure. Congest Heart Fail. 2011, 17(6):257-61





