摘 要: Tau蛋白(简称Tau),是一种参与神经系统发育的微管相关蛋白。其可经历构象改变、异常mRNA剪接等,从微管解离,经系列翻译后修饰(Post-translational modification, PTM),自身形成病理性聚集,进而造成神经退行性病变,最终形成Tau病。研究Tau的病理过程,分析评估其PTM及定量检测其浓度变化,对Tau病的早期诊断、跟踪、预防和治疗具有重要意义。本文对目前国内外Tau的常规分析方法进行了概述和比较,重点阐述光学、电化学生物传感方法的最新研究进展与相关应用,对未来发展方向进行了展望,为Tau蛋白的深入研究与应用提供参考。
关键词: Tau蛋白; Tau病; 生物传感器; 翻译后修饰; 评述;
Abstract: Tau protein, simply referred to as Tau, is a type of microtubule-associated protein involved in the development of the nervous system. After experiencing conformational changes, abnormal mRNA splicing, etc. Tau dissociates from microtubules and undergoes a series of post-translational modification (PTM) to form pathological aggregation, which induces neurodegenerative diseases and tauopathies eventually. Numerous clinical studies suggest that studying the pathological process of Tau protein, analyzing and evaluating its PTM and quantitative detection of concentration changes are of great significance for the early diagnosis, tracking, prevention and treatment of tauopathies. In this paper, the conventional methods of Tau protein at home and abroad were summarized and compared. Specifically, the related applications and latest research progress of optical and electrochemical biosensors were mainly described. Furthermore, the summary of its future directions and the potential applications were proposed, which provided reference for the further research and application.
Keyword: Tau protein; Tauopathies; Biosensor; Post-translational modification; Review;
1 、引 言
Tau蛋白(简称Tau),是一种参与神经系统发育的微管相关蛋白,其富集于神经元轴突周围,与微管蛋白结合形成微管,可稳定微管并促进轴突运输[1]。Tau经历构象改变、异常mRNA剪接等,从微管解离,经系列翻译后修饰(Post-translational modification, PTM),自身形成病理性聚集,进而造成神经退行性病变,最终形成Tau病[2,3]。在进行性核上性麻痹、皮质基底节变性、额颞痴呆等原发性Tau病,C型Niemann-Pick病、阿尔兹海默病(Alzheimer disease, AD)等继发性Tau病中均可检测到Tau的异常修饰、含量变化及病理沉积[4,5]。其中,由Tau异常聚集形成的神经元纤维缠结(Neurofibrillary tangle, NFT)是AD的病理标志之一[6]。研究Tau的病理过程,分析评估其PTM及定量检测其浓度变化,对Tau病的早期诊断、跟踪、预防和治疗具有重要意义。目前,已有少量关于Tau的神经成像技术的评述与报道。如Villemagne[7]等研究了示踪剂的选择,Hall等[8]研究了Tau与认知障碍的相关性,Hammes等[9]研究了Tau在神经退行性疾病中的病理性聚集。但并没有全面反映近年来针对Tau的病理过程、分析检测方法的最新研究进展。基于Tau结构的特殊性、PTM与聚集过程的复杂性等,对Tau的分析方法的灵敏度、高效性提出了更高的要求。本文对Tau的常规分析方法进行了概述和比较,重点阐述光学、电化学生物传感方法的最新研究进展与应用,对其未来发展方向进行了展望。
2 、Tau的结构与形态
2.1、 结构
Tau由位于17染色体长臂的基因编码,含16个外显子,长352~441个氨基酸,分子量为45~65 kDa。Tau可分为N末端投射功能区(N端)、脯氨酸富集区、微管结合区(Microtubule -binding domain, MBD)和C末端功能区(C端)。其中,N端长度不确定,可插入由外显子2(E2)、3(E3)控制的额外片段。脯氨酸富集区含大量磷酸化位点,而C端提供了部分磷酸化位点[10,11]。重复序列(R1-R4)位于MBD,其微管结合力最强并促进微管自聚集[12,13],同时亦是双螺旋细丝(Paired helical filament, PHF)的核心结构。人类Tau因mRNA剪辑方式不同,表达出6种同工异构体,即Tau352、381、383、410、412和441,其差异在于C端是否存在3或4个重复序列,N端是否存在有1或2个插入物[12]。外显子10(E10)编码R2片段,能保留E10且具有四个重复序列的Tau统称为4RTau;不保留E10且只有3个重复序列的Tau统称为3RTau[14]。成年人脑内3RTau、4RTau表达量相当,而成年老鼠只表达4RTau[15]。
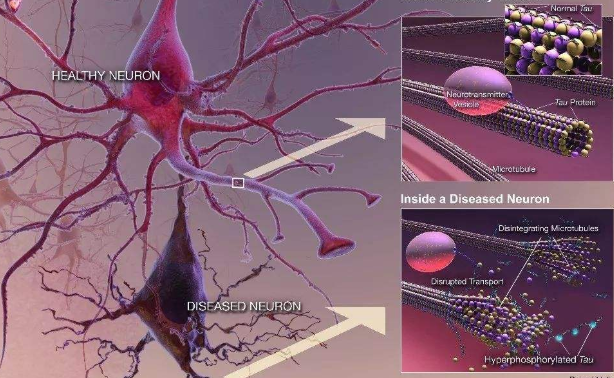
2.2 、形态
Tau单体结构类似“回形针”,如图1A。其可经历构象改变、异常mRNA剪接等,脱离微管致微管解聚并从惰性单体转变为可聚集的“种子”形式(病理性Tau)。病理性Tau经C端-MBD,N端-C端相互作用,折叠形成Tau的低聚物[16],如图1B。病理性Tau以朊病毒样形式沿突触在神经元间传播,形成的低聚物经系列PTM后进一步在神经元中聚集形成PHF[17],如图1C。
图 1 (A)Tau单体[16]; (B)Tau低聚物[16]; (C)病理性Tau的传播过程[17]
![图 1 (A)Tau单体[16]; (B)Tau低聚物[16]; (C)病理性Tau的传播过程[17]](/uploads/allimg/200401/36-20040115224Q28.jpg)
3、 Tau的PTM
Tau 的PTM种类包括磷酸化(Phosphorylation)、糖基化(Glycation)、硝化(Nitration)、泛素化(Ubiquitination)、乙酰化(Acetylation)、甲基化(Methylation)和脯氨酰异构化(Prolyl-isomerization)等[18]。PTM可影响Tau的活性、结构及与其它蛋白质的相互作用。其中,磷酸化作为关键致病步骤受到广泛关注[19]。
3.1、 磷酸化
磷酸化是在蛋白激酶(Protein kinases, PK)作用下将ATP的磷酸基团转移到Tau氨基酸残基上,形成磷酸化Tau(P-Tau)的过程。PK包括脯氨酸定向PK、非脯氨酸定向PK和酪氨酸蛋白PK [20,21]。去磷酸化是经蛋白磷酸酶(Protein phosphatase, PP)去除P-Tau氨基酸残基上的磷酸基团的过程,PP主要包括PP1、PP2A、PP2B、PP2C、PP3和PP5[22]。其中,PP2A的去磷酸化效应最强,在AD患者脑中的表达和活性均降低[23]。冈田酸(OA)可使PP1、PP2A失活引起氧化应激损伤,进而诱导P-Tau[24]。Tau含85个磷酸化位点,其中包括45个丝氨酸(Ser)、35个苏氨酸(Thr)和5个酪氨酸(Tyr)残基。部分磷酸化位点也可发生去磷酸化,但其发生反应所需PK、PP的种类与数量不同[25,26]。
健康神经元中,磷酸化与去磷酸化保持动态平衡。当PP、PK调控失衡,磷酸化水平提高至正常的2~3倍,即引起过度磷酸化[27],可使Tau失去生物活性而不可溶、抗降解且易聚集,丧失稳定微管的正常功能并干扰和分解细胞骨架,最终影响轴突运输机制并促成突触功能障碍和神经变性[28,29]。此外,β-淀粉样蛋白(Amyloid β-protein,Aβ)、异常糖基化的诱导也可促成过度磷酸化[30,31]。
3.2 、其它PTM
糖基化经非酶促反应在氨基酸上修饰糖基,可使Tau降解受阻而发生聚集 [32]。硝化经硝基(-NO2)共价修饰Tyr残基[33],抑制Tau结合与稳定微管的能力,使其更易聚集[34]。人体外硝化位点包括Tyr18、Tyr29、Tyr197和Tyr394,但Tyr29和Tyr197硝化更易引起Tau聚集[35]。泛素化是在系列酶的作用下将泛素修饰在C端MBD的赖氨酸(Lys)残基上,其随着PHF的增加而增加[36]。在AD患者PHF、脑脊液(Cerebrospinal fluid, CSF)中,泛素化Tau含量较高[37]。
乙酰化是经组蛋白乙酰转移酶在Lys残基修饰乙酰基,其可调节细胞功能和能量代谢并诱导P-Tau[38]。甲基化是通过在Lys和精氨酸残基上引入甲基,可影响Tau与微管结合及Tau同工异构体间的相互作用[39]。甲基化位点多分布于MBD,可促进磷酸化并与乙酰化、泛素化等存在竞争作用[40]。脯氨酰异构化于Thr231重排二硫键,使Tau从顺式构象转变为反式构象[41]。反式构象的Tau不与微管结合,经聚集形成PHF[42];肽基-脯氨酰顺/反异构酶可使其转变为顺式构象,恢复与微管结合力并促进PP2A去磷酸化[43]。
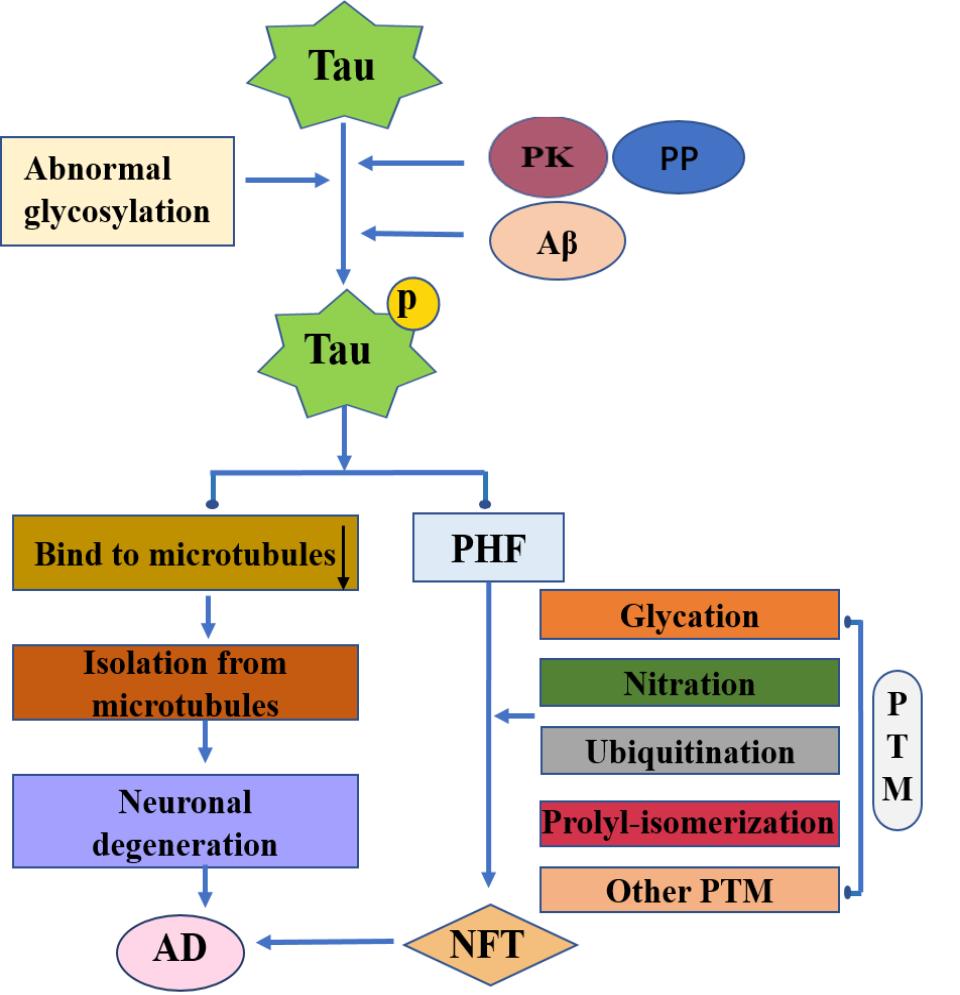
目前,磷酸化作为调控AD的关键步骤而受到广泛关注。正常情况下,磷酸化和去磷酸化分别负、正调控Tau与微管的亲和力,且二者保持动态平衡[44]。病理情况下,Tau因过度磷酸化形成P-Tau,其与微管结合力减小而脱离微管,致微管解聚、神经元发生变性和死亡,最终诱导AD[45];同时,易自我聚集的P-Tau在某些PTM影响下,经历形态改变、发生聚集并最终形成NFT[20],上述两种途径同时发生则进一步加快了AD的病理进程(图2)。
图 2 Tau引起AD的病理进程
4、 Tau的常规分析方法
Tau的常规分析方法主要包括神经成像、免疫检测和质谱(Mass spectrometry, MS)技术。其中,神经成像技术可用于研究Tau的病理成像,免疫检测方法用于血浆或CSF中Tau或P-Tau的分析,质谱技术则主要用于研究Tau的PTM。
4.1 、神经成像
神经成像泛指能够直接或间接对脑部的功能、结构和药理学特性进行成像的技术,可捕捉脑部Tau的形态改变,利于临床研究和诊断,包括正电子发射断层扫描(Positron emission computed tomography, PET)、单光子发射计算机化断层显像(Single-photon emission computed tomography, SPECT)和磁共振成像(Magnetic resonance imaging, MRI)等。PET经放射性示踪剂标记抗体,对细胞表面抗原进行扫描显像,为无创方法[46]。Tau与示踪剂标记的抗体特异性结合后,经PET显示分布情况,示踪剂保留的形貌与预期病理阶段对应,且Tau的沉积模式与代谢减退之间存在密切关系[47]。目前,18F-AV-T807和18F-AV-1451是Tau常用的示踪剂[48,49],但因示踪剂的半衰期较短(18F:110min),使PET检测Tau的应用受限[50]。
SPECT是以单光子放射性核素标记药物作为显像剂,通过扫描病人体内放射性标记药物发射的γ射线的成像技术。苯基二苄基苯并噻唑(PDB)是常用药物,小鼠的生物分布实验表明,PDB衍生物在大脑中呈持续放射性水平,目前尚不适合用于人体NFT成像[51]。
MRI经体外高频磁场对静磁场中的人体施加某特定频率的射频脉冲,激发人体内水和脂肪的氢质子而引起磁共振现象,并通过获得的电磁信号重建人体信息。多参数MRI、高分辨率结构MRI等对评估Tau病理改变意义重大[52,53]。
4.2 、免疫检测方法
免疫检测基于抗原-抗体的特异性结合,包括酶联免疫法(Enzyme-linked immunosorbent assay, ELISA)、蛋白质印迹法(Western blot, WB)、基于纳米粒子的免疫聚合酶链式反应(Nanoparticles-immuno polymerase chain reaction, Nano-iPCR)和免疫磁减量(Immunomagnetic reduction, IMR)等。
ELISA是目前应用最广泛的方法之一。Arai等[54]采用ELISA证明AD患者的CSF-Tau((95.6±105.3)pg/mL) 显着高于正常人((32.7±43.2)pg/mL),灵敏度为93.8%,特异性为75%,提示可经CSF-Tau预测AD。Kohnken等[55]利用夹心ELISA测定AD患者CSF-P-Tau的截断值为10.1 ng/ml,灵敏度为85%,特异性为97%,总体准确度为91%。与CSF-Tau相比,CSF-P-Tau因与AD进程高度相关更受关注。
WB又称免疫印迹,是将蛋白质经凝胶电泳分离后,通过抗原-抗体的特异性结合完成检测。其操作简单,可直接对抗体进行荧光标记,广泛用于定量检测Tau和P-Tau [56]。R?thlisberger等[57]采用WB获得AD患者唾液中P-Tau和总Tau的比值(P-Tau/T-Tau),与正常人相比(0.96),75%的AD患者P-Tau/T-Tau可升高至1.00,该法灵敏度为73%,特异性为50%。唾液与血浆、CSF相比,因无创、易得等优点广受关注。但因敏感性和特异性不足,尚无法直接用于临床测试。
Nano-iPCR是经纳米粒子放大信号,结合免疫PCR检测的技术。Stegurová [58]等采用Nano-iPCR定量检测Tau,经PCR板孔内的抗体捕获Tau形成抗原-抗体复合物后,结合金纳米粒子(AuNPs)标记的二抗,形成双抗夹心复合物,经免疫PCR检测。Tau的检出限(Limit of detection, LOD)为5 pg/mL,线性范围为10-10000 pg/mL,回收率为89%~113%,明显优于ELISA的分析性能(LOD,140 pg/mL;线性范围,75-600 pg/mL)。
IMR是通过测量靶蛋白与磁性纳米颗粒(Magnetic Nanoparticles, MNPs)结合导致检测体系中分散的MNPs混合频率降低的百分比来测定靶分子。Chiu等[59]应用标记MNPs的抗体捕获Tau,随着Tau含量增高,分散的MNPs形成团簇,使检测体系中分散的MNPs混合频率降低,基于IMR信号值的变化定量检测Tau。结果显示,早期AD组血浆的Tau为(53.9±11.7)pg/mL,明显高于健康老年组((15.6±6.9)pg/mL)和轻度认知障碍组((33.2±5.4)pg/mL),提示经测量血浆Tau可预测AD。
4.3、 质谱技术
MS技术具有灵敏度高、样品用量少、可同时进行分离和鉴定等优势,多用于研究Tau的PTM。Min等[60]采用MS技术研究了Tau的乙酰化,证实其直接导致P-Tau积累并调节PP和PK活性;干扰乙酰化,可直接影响磷酸化进程。Thomas等[61]分析了Tau的甲基化和泛素化,证实甲基化Lys分布于N端和MBD,在Lys254位点与泛素化竞争底物,与乙酰化、磷酸化等PTM共同调节Tau的功能。研究表明,小鼠和人的Tau序列具有高度相似性,如小鼠Tau430的序列与人类Tau441相比,有89%相同、92%相似[15]。Morris等[62]经研究野生型小鼠和人淀粉样前体蛋白小鼠内源性Tau430的PTM,证实两种类型小鼠的Tau430具有类似的PTM,同一Lys位点存在乙酰化、泛素化和甲基化的竞争;发生磷酸化的位点多在MBD附近,且因MBD存在高密度的带正电荷Lys残基,更易发生乙酰化和甲基化。目前,MS被广泛应用于研究Tau的PTM,但其维护成本高、操作复杂。
目前,Tau的常规分析方法在安全性、灵敏度及检测成本等方面仍存在一定的不足,开发更加高效、经济、快速、准确的分析方法对Tau病的预防、干预和治疗具有重要意义。
5 、生物传感方法
目前,应用于Tau分析检测研究的生物传感方法主要包括光学和电化学生物传感方法。
5.1 、光学生物传感方法
基于输出的特征光学信号,检测Tau的光学生物传感方法包括表面等离子共振(Surface plasmon resonance, SPR)、局部表面等离子共振(Localized surface plasmon resonance, LSPR)、荧光共振能量转移(Fluorescence resonance energy transfer, FRET)和表面增强拉曼散射(Surface-enhanced raman scattering, SERS)等。
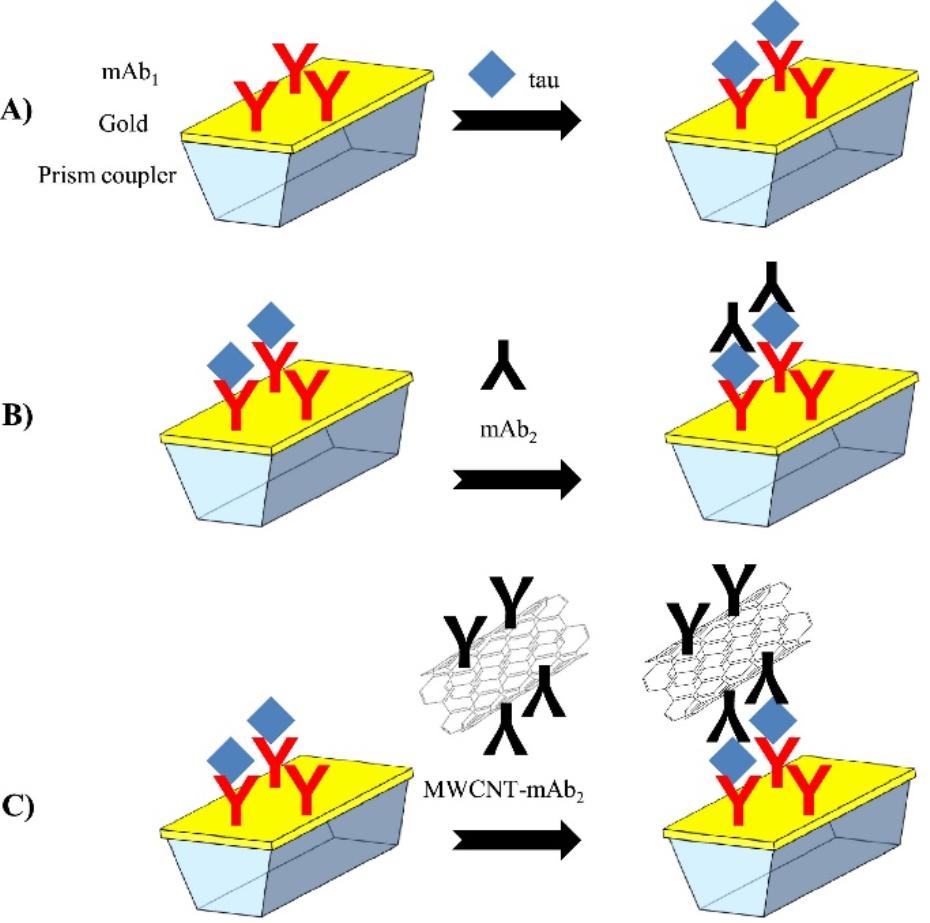
SPR是金属介质表面的自由电子吸收入射光的能量后发生共振的现象。在目标分子结合金属介质表面吸附的生物分子后,引起折射率发生改变,进而造成共振光谱的移动,可据此实现对目标分子的定量检测 [63]。Lisi等[64]基于SPR平台,采用抗体捕获Tau,设计了直接检测(A)、无标记三明治夹心(B)及标记三明治夹心(C)三种模式定量检测Tau,如图3所示。检测Tau的线性范围分别为7~250、2~25和125~1000 nmol/L,LOD分别为15、2和0.125 nmol/L。
图 3基于表面等离子体共振技术检测Tau的三种模式:(A)直接检测;(B)无标记三明治夹心法;(C)标记三明治夹心法
适配体是经指数富集的配体系统进化(SELEX)技术筛选得到的人工合成的单链核酸序列,可直接与靶分子(金属离子、蛋白质、细胞和微生物等)结合,与抗体相比,其批次间差异小、稳定性和特异性更佳[65]。Kim等基于SPR平台联用抗体-适配体检测Tau381 [66]及同时检测Tau381与α-1抗胰蛋白酶(Antitrypsin, AAT)[67]。如图4A和4B所示,在SPR传感片表面固定适配体,捕获靶标物并结合抗体,形成类三明治复合物。该法检测Tau381的LOD为10 fmol/L,线性范围为2~80 pmol/L,并用于同时检测人血浆样品AAT和Tau,显示了临床应用的潜能。
图 4 基于抗体和适配体联用的SPR平台检测Tau[66] (A)和同时检测AAT、Tau[67] (B)的示意图
![图 4 基于抗体和适配体联用的SPR平台检测Tau[66] (A)和同时检测AAT、Tau[67] (B)的示意图](/uploads/allimg/200401/36-200401152353644.jpg)
LSPR是电介质包围的金属纳米结构中的自由电子在局部表面发生共振产生的光学现象,受金属纳米颗粒的种类、形状以及大小的变化影响 [68]。Vestergaard等[69]基于多点定位的LSPR芯片检测Tau,LSPR芯片经活化、固定Tau抗体并进一步捕获Tau后,引起LSPR芯片表面厚度的增加,通过测定吸光度的变化实现测定。该法可检测低至10 pg/mL的CSF-Tau,低于临床区分AD患者与正常人的CSF-Tau的临界值(195 pg/mL)。Kim等[70]基于LSPR平台,利用不同类型的AuNPs偶联抗体,同时完成多靶标的准确分离和鉴定。球形AuNPs (直径50 nm)、长宽比分别为1.6、3.6的短棒、长棒状AuNPs偶联抗体后,分别用于捕获Tau、Aβ1-40和Aβ1-42,然后采用光谱仪检测。结果显示,Tau、Aβ1-40和Aβ1-42的LOD分别为23.6、34.9、26 fmol/L,可在10~108 fmol/L的浓度范围对AD生物标志物进行同时快速检测。因血浆中存在多种AD生物标志物(Tau、Aβ1-40、Aβ1-42)干扰Tau的检测,Kim等[71]联用长宽比为3.67的长棒杆AuNPs和盐酸胍,提高靶向Tau的能力。盐酸胍可破坏Tau与其它蛋白质分子间氢键、减弱疏水作用而减少其折叠和聚集,从而提高对Tau的捕获量,该方法检测Tau的LOD为1.56 pmol/L,线性范围103~108 fmol/L。测定人血浆中Tau的含量的相对标准偏差(Relative standard deviation, RSD)为1.98%~3.60%,回收率为94.43%~102.27%。
SERS与纳米金属材料联用可增强拉曼信号并提高信噪比[72]。Zengin等[73]利用MNPs复合物固定的抗体捕获Tau,与AuNPs标记的二抗结合、形成三明治复合物后定量检测Tau,如图5A所示。该法无需纯化即可快速检测Tau,LOD低至25 fmol/L,线性范围25 fmol/L~500 nmol/L。
FRET是基于两个分别作为能量供体与能量受体的荧光基团距离处于1.0~10.0 nm之间时,供体的能量向受体转移而引起的现象[74]。Kjaergaard等[75]利用FRET研究了Tau的聚集,如图5B所示,分别用FRET供体和受体标记等量Tau。Tau发生聚集时,供体和受体标记的Tau距离缩小,发生FRET,产生荧光响应信号。该方法测定Tau低聚物的LOD为4.25 nmol/L,线性范围37~104 nmol/L。
图 5 (A) 基于SERS平台联用MNPs和AuNPs检测Tau的示意图 [73]; (B)基于FRET平台检测Tau[75]
![图 5 (A) 基于SERS平台联用MNPs和AuNPs检测Tau的示意图 [73]; (B)基于FRET平台检测Tau[75]](/uploads/allimg/200401/36-200401152414B7.jpg)
因光学传感具有灵敏度高、成本低、稳定性好和抗电磁干扰能力强等优点,针对Tau的光学传感研究具有巨大发展潜能。
5.2、 电化学生物传感方法
电化学生物传感方法[76]具有响应速度快、成本低、灵敏度高和易于微型化等特点,受到广泛关注。目前Tau的电化学生物传感研究包括病理学监测和定量检测,常用的电化学检测技术包括循环伏安法(Cyclic voltammetry, CV)、电化学阻抗谱(Electrochemical impedance spectroscopy, EIS)、方波伏安法(Square wave voltammetry, SWV)和差分脉冲伏安法(Differential pulse voltammetry, DPV)等。
5.2.1 、Tau的病理学监测
(1)针对P-Tau的研究
目前仅有少数对P-Tau的电化学研究报道,尚无直接检测P-Tau的报道。如Martic等[77]研究了5'-γ-二茂铁基三磷酸腺苷(Fc-ATP)与糖原合成激酶3-β(GSK-3β)、PKA、肉瘤相关激酶(Src)对P-Tau的催化作用,测定了其最大反应速度(Vmax)和在1/2Vmax的底物浓度(KM)。在金电极表面固定Tau,在Fc-ATP与PK的作用下发生磷酸化。Fc-ATP中负电荷的γ-磷酸基从ATP转移到Ser、Thr或Tyr残基引起电流密度改变,可用于检测Fc-ATP浓度,线性范围为5-200 μmol/L,LOD为2 μmol/L。浓度依赖性实验结果显示,GSK-3β、Src和PKA的KM值分别为(11±0.5)、(7±0.5)和(13±0.5)μmol/L,Vmax为 ((0.010-0.025)±0.005)μA/(cm2min)。因不同PK作用的磷酸化位点存在差异,Rains等[78]进一步监测了Fc-ATP与多种PK(Gsk-3β、Src、Abl、Fyn和TTBK等)对P-Tau的催化作用,结果显示,多种PK联用后对P-Tau的催化作用大于单一PK,且PK的种类和磷酸化顺序对Tau膜的电化学特性影响不同。
Jahnke等[79]基于人神经母细胞瘤细胞(SH-SY5Y)和微电极测量平台研究了P-Tau。在环状培养容器固定细胞后,施加交流电压并记录Rct,结果显示,SH-SY5Y经OA处理后,在10h内Rct降至28%±19%,提示OA具有诱导P-Tau的作用;在OA处理前,将SH-SY5Y与Tau激酶抑制剂SRN预孵育1小时后,在前8h内Rct无显着变化,10h后降低至24%±7%,表明SRN对OA诱导P-Tau的阻碍作用。
(2) Tau-蛋白质相互作用
为了监测Tau之间的相互作用,分析其早期错误折叠,Esteves等[80]采用EIS监测固定于Au电极上的Tau在Tau溶液中孵育前后的电化学阻抗信号变化。Tau-Tau相互作用时,带正电的Tau与检测液中的氧化还原探针Fe(CN)63- / 4-发生静电作用,使电荷转移电阻(Rct)从(2.9±0.6)kΩ降到(0.3±0.61)kΩ,Tau溶液浓度在0.2~1.0 μ mol/L时与Rct变化值呈线性关系,其浓度低至0.2 μ mol/L时,仍可观察到Tau-Tau相互作用。
(3)Tau-金属离子相互作用
大脑中高浓度的金属离子使Tau金属化,因此广受关注。在Cu2+与非磷酸化的Tau(n-Tau)和P-Tau相互作用的研究中[81],将n-Tau和P-Tau分别置于不同pH、浓度的含Cu2+溶液中孵育,经CV检测,结果显示,在中性pH(7.4)时,n-Tau和P-Tau与Cu2+的结合程度相似;pH过高或过低时,通过影响P-Tau结构而阻碍其结合Cu2+。此外,Cu2+和Zn2+可竞争性结合P-Tau,P-Tau与Zn2+优先结合形成络合物后,阻碍Cu2+与P-Tau结合。
Ahmadi等[82]研究了Tau、P-Tau与Fe2+、Fe3+的相互作用。在金电极表面固定Tau,分别置于含Fe2+和Fe3+的溶液中孵育。与Tau-Fe3+相比,在Tau-Fe2+中检测到明显降低的Rct和增大的电流密度,提示Fe2+更易结合Tau。经圆二色光谱测量Tau的二级结构(α螺旋,225nm)变化的峰强度,在Fe2+中该峰强度在前3小时内稳定增长,在24小时后恢复到225nm;在Fe3+中该峰强度缓慢增强,在24小时后仍未恢复到225nm,证实Fe2+、Fe3+可引起Tau构象改变,但Fe2+对Tau构象的影响是迅速、可逆的,Fe3+对Tau构象的影响是缓慢、不可逆的。经DPV测量P-Tau与Fe2+、Fe3+在不同PK作用下电流强度的变化显示,Tyr位点显着影响P-Tau、Fe2+相互作用,而Ser、Thr位点显着影响P-Tau与Fe3+相互作用。
5.2.2、 Tau的定量检测
目前,电化学定量检测Tau的研究报道较少。Derkus等[83]构建了双抗夹心型电化学生物传感器同时检测髓鞘碱性蛋白(Myelin basic protein, MBP)和Tau。丝网印刷碳电极经氧化石墨烯和聚酰胺-胺树枝状大分子修饰后,固定MBP和Tau的抗体,二抗分别缀合CdS和PbS,经DPV和EIS检测Cd2+和Pb2+的电化学信号。MBP和Tau的LOD分别为0.30 nmol/L和0.15 nmol/l,线性范围分别为0.50 nmol/L ~500 nmol/L和0.25~250 nmol/L。检测人工CSF中MBP、Tau的回收率分别为96.3%~111.1%和99.1%~111.1%,显示该传感器具有较好的临床应用潜能。
Wang等[84]构建了含四个金微带电极的电化学生物传感器检测Tau,如图6A所示,包括一个工作电极(WE)、一个对电极(CE)和两个参比电极(RE)。工作电极表面修饰自组装单层膜并固定Tau抗体,Tau-抗体特异性结合引起电化学信号变化,实现Tau的检测,方法的LOD为10-14 mol/L,线性范围是10-14~10-7 mol/L,灵敏度明显优于ELISA,可检测人血清中低至0.03 pmol/L的Tau。
结合适配体的高亲和力与AuNPs可放大信号的优势,Shui等[85]基于电化学生物传感方法联用抗体-适配体测定Tau,如图6B所示,金电极上固定的抗体捕获Tau后,与半胱胺、AuNPs和适配体结合形成复合物,进一步放大电化学信号。检测Tau的LOD为0.42 pmol/L,线性范围为0.5~100 pmol/L,人血清样本中Tau的回收率为97.1%~102.0%,RSD为4.8%~5.75%,显示其对复杂实际样品良好的检测效果。
图 6 (A) 四电极电化学生物传感器的构成和检测Tau工作原理[84]; (B) 联用抗体-适配体的三明治夹心型电化学生物传感器测定Tau的示意图[85]
![图 6 (A) 四电极电化学生物传感器的构成和检测Tau工作原理[84]; (B) 联用抗体-适配体的三明治夹心型电化学生物传感器测定Tau的示意图[85]](/uploads/allimg/200401/36-20040115243J12.jpg)
6、 结论与展望
本文介绍了Tau的结构与形态、主要的翻译和修饰过程以及常规分析方法,阐述了通过光学、电化学生物传感方法检测Tau的与最新研究与应用进展。因Tau结构的特殊性、PTM与聚集过程的复杂性,提高研究方法的灵敏度、选择性以及多样性仍然是当前研究重点。未来的研究将集中于应用新型纳米材料提高灵敏度、开发新型识别元件提高选择性以及提高方法的实用性方面。因检测Tau与P-Tau对Tau病早期诊断、跟踪、预防和治疗具有重要意义,拓展多样性研究并进一步促进其实用性,将是未来研究的方向。
TOC (Table of Contents):
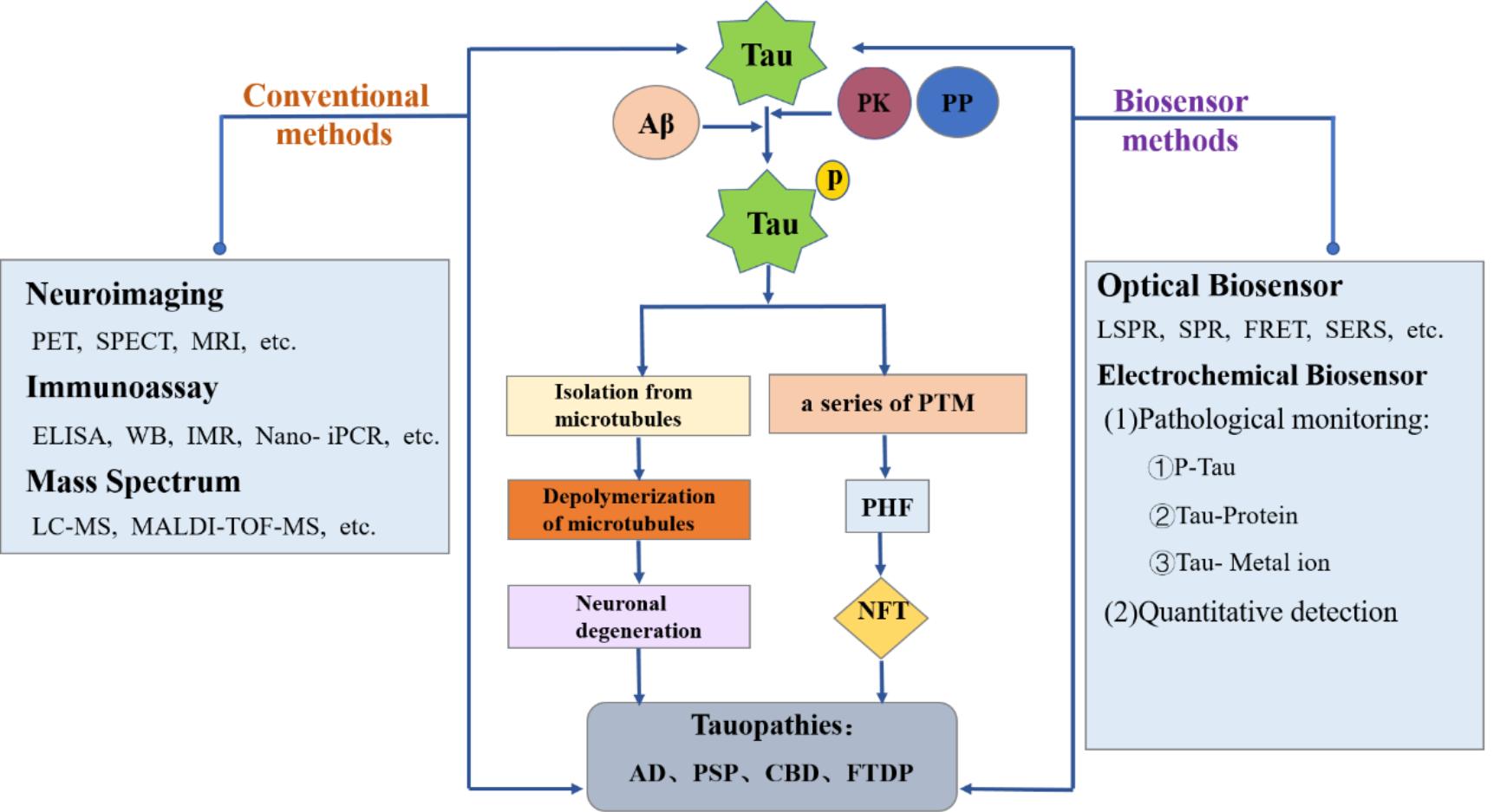
Tau蛋白是参与神经系统发育的微管相关蛋白,因构象改变、异常mRNA剪接、翻译后修饰等导致Tau病。本文基于Tau的结构和形态,在介绍常规检测方法的同时,重点关注光学、电化学生物传感的研究现状。
Tau, as a microtubule-related protein involved in the development of the nervous system, causing taupathy after undergoing a series of changes. For example, conformational changes, abnormal mRNA splicing and a series of post-translational modifications. Based on the structure and morphology of Tau, the conventional detection methods of Tau are introduced in this review. Meanwhile, the research status based on optical biosensor and electrochemical biosensor are focused emphatically.
参考文献
[1] Ittner L M, Ke Y D, Delerue F, Bi M, Gladbach A, van Eersel J, Wolfing H, Chieng B C, Christie M J, Napier A, Eckert A, Staufenbiel M, Hardeman E, Gotz J. Cell, 2010, 142(3): 387-397
[2] Scholl M, Maass A, Mattsson N, Ashton N J, Blennow K, Zetterberg H. Mol. Cell. Neurosci., 2019, 97: 18-33
[3] Rankovic M, Zweckstetter M. Neurosci. Biobehav. Rev., 2019, 98: 1-9
[4] Saha P, Sen N. Ageing Res. Rev., 2019, 178: 72-79
[5] Villemagne VL, Velakoulis D, Dore V, Bozinoski S, Masters C L, Rowe C C, Walterfang M. Eur. J. Nucl. Med. Mol. Imaging., 2019, 46(5): 1132-1138
[6] Takeda S. Neurosci. Res., 2019, 141: 36-42
[7] Villemagne V L, Fodero M T, Masters C L, Rowe C C. Lancet Neurol., 2015:14: 114-124
[8] Hall B, Mak E, Cervenka S, Aigbirhio F I, Rowe J B, O'Brien J T. Ageing Res. Rev., 2017: 36: 50-63
[9] Hammes J, Drzezga A, van Eimeren T. Curr. Neurol. Neurosci. Rep., 2018, 18(12): 86
[10] Bakota L, Ussif A, Jeserich G, Brandt R. Mol. Cell. Neurosci., 2017, 84: 132-141
[11] Combs B, Hamel C, Kanaan N M. Neurobiol. Dis., 2016, 94: 18-31
[12] Guo T, Noble W, Hanger D P. Acta Neuropathol., 2017, 133(5): 665-704
[13] Tochio N, Murata T, Utsunomiya-Tate N. Biochem. Biophys. Res. Commun., 2019, 508(1): 184-190
[14] Espindola S L, Damianich A, Alvarez R J, Sartor M, Belforte J E, Ferrario J E. Cell Rep., 2018, 23(3): 709-715
[15] Sealey M A, Vourkou E, Cowan C M, Bossing T, Quraishe S, Grammenoudi S. Neurobiol. Dis., 2017, 105: 74-83
[16] Himmelstein D S, Ward S M, Lancia J K, Patterson K R, Binder L I. Pharmacol. Ther., 2012, 136(1): 8-22
[17] Chu D, Liu F. ACS Chem. Neurosci., 2019, 10(2), 931-944
[18] Domise M, Didier S, Marinangeli C, Zhao H, Chandakkar P, Buee L, Viollet B, Davies P, Marambaud P, Vingtdeux V. Sci. Rep., 2016: 6: 26758
[19] Baas P W, Qiang L. Trends Cell Biol., 2019, 29(6): 452-461
[20] Martin L, Latypova X, Terro F. Neurochem. Int., 2011, 58(4): 458-471
[21] Vander Harg J M, Eggels L, Bangel F N, Ruigrok S R, Zwart R, Hoozemans J J M. Neurobiol. Dis., 2017, 103: 163-173
[22] Virshup D M, Shenolikar S. Mol. Cell. Biochem., 2009, 33(5): 537-545
[23] Martin L, Latypova X, Wilson C M, Magnaudeix A, Perrin M L, Terro,F. Ageing Res. Rev., 2013, 12(1): 39-49
[24] Virshup D M, Shenolikar S. Mol.Cell., 2009, 33(5): 537-545
[25] Hanger D P, Byers H L, Wray S, Leung K Y, Saxton M J, Seereeram A. J. Biol. Chem., 2007, 282(32): 23645-23654
[26] Noble W, Olm V, Takata K, Casey E, Mary O, Meyerson J. Neuron, 2003, 38(4): 555-565
[27] Lassen P S, Thygesen C, Larsen M R, Kempf S J. J. Proteomics, 2017, 161: 11-25
[28] Ono K. Neurochem. Int., 2018, 119: 57-70
[29] Buee L, Bussiere T, Buee-Scherrer V, Delacourte A, Hof P R. Brain Res. Rev., 2000, 33(1): 95-130
[30] Lloret A, Fuchsberger T, Giraldo E, Vina J. Free Radical Biol. Med., 2015, 83: 186-191
[31] Sato Y, Naito Y, Grundke-Iqbal I, Iqbal K, Endo T. FEBS Lett., 2001, 496(2-3): 52-60
[32] Necula M, Kuret J. J. Biol. Chem., 2004, 279(48): 49694-49703
[33] Ischiropoulos H. Biochem. Biophys. Res. Commun., 2003, 305(3): 776-783
[34] Reyes J F, Fu Y, Vana L, Kanaan N M, Binder L I. Am. J. Pathol., 2011, 178(5): 2275-2285
[35] Reynolds M R, Reyes J F, Fu Y, Bigio E H, Guillozet-Bongaarts A L, Berry R W. J. Neurosci., 2006, 26(42): 10636-10645
[36] Cripps D, Thomas S N, Jeng Y, Yang F, Davies P, Yang,A J. J. Biol. Chem., 2006, 281(16): 10825-10838
[37] Iqbal K, Grundke-Iqbal I. Mol. Neurobiol., 1991, 5(2-4): 399-410
[38] Min S W, Cho S H, Zhou Y, Schroeder S, Haroutunian V, Seeley W W. Neuron, 2010, 67(6): 953-966
[39] Funk K E, Thomas S N, Schafer K N, Cooper G L, Liao Z P, Clark D J. Biochem. J., 2014, 462: 77-88
[40] Tapia-Rojas C, Cabezas-Opazo F, Deaton C A, Vergara E H, Johnson G V W, Quintanilla R A. Prog. Neurobiol., 2019, 175: 54-76
[41] Bulbarelli A, Lonati E, Cazzaniga E, Gregori M, Masserini M. Mol. Cell. Neurosci., 2009, 42(1): 75-80
[42] Zhou X Z, Kops O, Werner A, Lu P J, Shen M, Stoller G. Mol. Cell., 2000, 6(4): 873-883
[43] Lavoie S B, Albert A L, Vincent M. M S-Med. Sci., 2003, 19(12): 1251-1258
[44] Pekeles H, Qureshi H Y, Paudel H K, Schipper H M, Gornistky M, Chertkow H. Alzheimer's Dementia, 2019, 11: 53-60
[45] Lassen P S, Thygesen C, Larsen M R, Kempf S J. J. Proteomics, 2017, 161: 11-25
[46] Jonasson M, Wall A, Chiotis K, Leuzy A, Eriksson J, Antoni G, Nordbergef A. NeuroImage Clin., 2019, 22(10):1016-1031
[47] Cho H, Choi J Y, Hwang M S, Lee J H, Kim Y J, Lee H M. Neurology, 2016, 87(4): 375-383
[48] Chien D T, Bahri S, Szardenings A K, Walsh J C, Mu F, Su M Y. J. Alzheimer's Dis., 2013, 34(2): 457-468
[49] Bejanin A, Schonhaut D R, La Joie R, Kramer J H, Baker S L, Sosa N. Brain, 2017, 140(12): 3286-3300
[50] Artun O. Radiat. Phys. Chem., 2018, 149: 73-83
[51] Benadiba M, Luurtsema G, Wichert-Ana L, Buchpigel C A, Filho G B. Rev. Bras. Psiquiatr., 2012, 34: 125-148
[52] Wells J A, O'Callaghan J M, Holmes H E, Powell N M, Johnson R A, Siow B. NeuroImage, 2015, 111: 369-378
[53] Hampel H, Blennow K, Shaw L M, Hoessler Y C, Zetterberg H, Trojanowski J. Exp. Gerontol, 2010, 45(1), 30-40
[54] Arai H, Terajima M, Miura M, Higuchi S, Muramatsu T, Machida N. Ann. Neurol., 1995, 38(4), 649-652
[55] Kohnken R, Buerger K, Zinkowski R, Miller C, Kerkman D, De Bernardis J. Neurosci. Lett., 2000, 287(3): 187-190
[56] Cohen L, Walt D R. Chem. Rev., 2019,119(1): 293-321
[57] R?thlisberger P, Hollenstein M. Adv. Drug Delivery Rev., 2018: 134: 3-21
[58] Stegurová L, Dráberová E, Bartos A, Dráber P, ?ípová D, Dráber P. J. Immunol. Methods, 2014, 406: 137-142
[59] Chiu M J, Chen Y F, Chen T F, Yang S Y, Yang F P G, Tseng T W. Hum. Brain Mapp., 2014, 35(7): 3132-3142
[60] Min S W, Cho S H, Zhou Y, Schroeder S, Haroutunian V, Seeley W W. Neuron, 2010, 67(6): 953-966
[61] Thomas S N, Funk K E, Wan Y, Liao Z, Davies P, Kuret J. Acta Neuropathol., 2012, 123(1): 105-117
[62] Morris M, Knudsen G M, Maeda S, Trinidad J C, Ioanoviciu A, Burlingame A L. Nat. Neurosci., 2015, 18(8): 1183-1189
[63] Ivanov A N, Kuzin Y I, Evtugyn G A. Sens. Actuators, B, 2019, 281: 574-581
[64] Lisi S, Scarano S, Fedeli S, Pascale E, Cicchi S, Ravelet C. Biosens. Bioelectron., 2017, 93: 289-292
[65] Wongkaew N, Simsek M, Griesche C, Baeumner A J. Chem. Rev., 2019, 119(1): 120-194
[66] Kim S, Wark A W, Lee H J. Anal. Chem., 2016, 88(15): 7793-7799
[67] Kim S, Park J W, Wark A W, Jhung S H, Lee H J. Anal. Chem., 2017, 89(22): 12562-12568
[68] Sepúlveda B, Angelomé P C, Lechuga L M, Liz-Marzán L M. Nano Today, 2009, 4: 244-251
[69] Vestergaard M, Kerman K, Kim D K, Hiep H M, Tamiya E. Talanta, 2008, 74(4): 1038-1042
[70] Kim H, Lee J U, Song S, Kim S, Sim S J. Biosens. Bioelectron., 2018, 101: 96-102
[71] Kim H, Lee J U, Kim S, Song S, Sim S J. ACS Sens., 2019, 4(3): 595-602
[72] Fateixa S, Pinheiro P C, Nogueira H I S, Trindade T. J. Mol. Struct., 2019, 1185: 333-340
[73] Zengin A, Tamer U, Caykara T. Biomacromolecules, 2013, 14(9): 3001-3009
[74] Achuth J, Renuka R M, Naveen S, Kadirvelu K. Sens. Actuators B, 2019, 291: 102-112
[75] Kjaergaard M, Dear A J, Kundel F, Qamar S, Meisl G, Knowles TPJ. ACS Chem. Neurosci., 2018, 9(12): 3060-3071
[76] Suprun E V. TrAC-Trend。Anal. Chem., 2019: 116: 44-60
[77] Martic S, Beheshti S, Rains M K, Kraatz H B. Analyst., 2012, 137(9): 2042-2046
[78] Rains M K, Martic S, Freeman D, Kraatz H B. ACS Chem. Neurosci., 2013, 4(8): 1194-1203
[79] Jahnke H G, Rothermel A, Sternberger I, Mack T G A, Kurz R G, Panke O. Lab Chip, 2009, 9(10): 1422-1428
[80] Esteves-Villanueva J O, Martic-Milne S. Anal. Biochem., 2016, 496: 55-62
[81] Martic S, Rains M K, Kraatz H B. Anal. Biochem., 2013, 442(2): 130-137
[82] Ahmadi S, Ebralidze I I, She Z, Kraatz H B. Electrochim. Acta, 2017, 236: 384-393
[83] Derkus B, Acar Bozkurt P, Tulu M, Emregul K C, Yucesan C, Emregul E. Biosens. Bioelectron., 2017, 89: 781-788
[84] Wang S X, Acha D, Shah A J, Hills F, Roitt I, Demosthenous A. Biosens. Bioelectron., 2017, 92: 482-488
[85] Shui B Q, Tao D, Cheng J, Mei Y, Jaffrezic-Renault N, Guo Z Z. Analyst, 2018, 143(15): 3549-3554





