
高原环境具有低压、低氧、酷寒等独有特点,这些环境应激必定导致机体各种生理代谢的变化[1].有研究发现,生活在高原上的人血糖水平一般较低,糖尿病的发病率也相对较低[2].平原糖尿病或糖耐量异常患者进入高原环境,其身体状况发生变化,用药剂量应如何适当增减,此方面研究较少.随着高原研究的日益增多,高原地区旅游经济的发展,高原缺氧与机体糖脂代谢关系的研究显得尤为重要.该实验拟通过模拟高原低压缺氧应激大鼠模型,观察高原大鼠糖代谢、脂代谢相关因素的变化,探讨高原缺氧环境对大鼠糖脂代谢的影响及其意义,为高原医学-内分泌代谢学的研究提供依据.
1材料与方法
1.1实验动物:Wistar大鼠,清洁级,♂,体质量180~220g,由兰州大学医学院动物实验中心提供,生产许可证号:SCXK(甘)2009-0004,动物合格证号:No.0000789,饲养于兰州军区兰州总医院动物实验科,饲料由该实验科自行配制,自由摄食进水,室温19~24℃.
1.2药品与试剂:血糖检测试剂盒 (批 号:1112071)、总 胆 固 醇 (TC)检 测 试 剂 盒 (批 号:1112091)、甘 油 三 酯 (TG)检 测 试 剂 盒 (批 号:1112101)均购自四川省迈克科技有限责任公司;高密度脂蛋白胆固醇(HDL-C)检测试剂盒(批号:1304091),低密度脂蛋白胆固醇(LDL-C)检测试剂盒(批号:120471)均购自中生北控生物科技股份有限公司;50%葡萄糖注射液(批号:1207103),陕西京西药业有限公司;胰岛素(FINS)放射免疫分析试剂盒(批号:20130412)、为天津九鼎生物技术有限公司产品.其他试剂均为国产分析纯.
1.3实验器材:Vitalab ISP-21半自动生化分析仪,荷兰Vital Scientific公司;BP210S电子天平,赛多利斯有限公司;HP-8453二级管阵列紫外可见分光光度计(美国惠普公司);IEC MICROMAX离心机,美国Thermo Electron公司;Biofuge Stratos高速台式冷冻离心机,德国Heraeus公司;Multi-scan MK3酶 标 仪,美 国Thermo Electron公 司;Telstar Mini-V PCR超净工作台,西班牙TER-RASSA-SPAIN医疗器械公司;SN-682放射免疫γ-计数器,中国科学院上海原子核研究所日环仪器厂.ABI7300定量PCR仪,美国应用生物系统公司.
1.4实验方法
1.4.1分组及高原缺氧模型的建立:将动物随机分为对照组(control)、低压缺氧应激组(hypoxia),每组10只.对照组大鼠在平原动物房内(海拔1000m)饲养.缺氧组在模拟海拔6000m低压氧舱内饲养48h后返回平原2h,再进入高原环境,如此反复3次.两组均给与充足的食物和饮水.实验结束后,缺氧组从低压氧舱中取出后立即断头处死,收集躯干血,4000rpm,4℃离心10min,将血浆分装于不同的离心管中-20℃保存待用.
1.4.2大鼠血糖:用葡萄糖氧化酶法测定血浆葡萄糖含量.具体测定方法按照试剂盒说明书操作.
1.4.3大鼠血浆中胰岛素含量的测定:将血浆室温放置解冻后,采用放免法测定其中胰岛素含量,具体操作步骤按试剂盒说明书进行.
1.4.4大鼠脏器重量:处死大鼠后,分别取大鼠的肝脏、肾脏、脾脏、肾上腺组织,去除结缔组织,洗净后称量.
1.4.5血脂的测定:将血浆室温放置解冻后测定血脂,血浆总甘油三酯(TG)用GPO-PAP法测定,血浆总胆固醇(TC)用COD-CE-PAP法测定,高密度脂蛋白-胆固醇(HDL-C)用PTA-Mg2+沉淀法测定,低密度脂蛋白-胆固醇(LDL-C)用聚乙烯硫酸沉淀法测定.具体测定方法按照试剂盒说明书操作.
1.4.6胰岛素β细胞功能:采用稳态模型评估胰岛β细胞功能,即采用HOMAβ反映基础胰岛素分泌功能:HOMAβ=20×I0/(G0-3.5),由于大鼠空腹血糖值较低,将此公式进行调整得,HOMAβ=20×I0/G0.
1.4.7肝糖原、肌糖原含量测定(蒽酮法):处死大鼠后取肝脏组织和右后肢肌肉组织,采用蒽酮-硫酸比色法分别测定各组大鼠肝糖原,肌糖原含量.
1.4.8 HPT轴激素水平的测定:将血浆室温放置解冻后测定HPT轴激素,促甲状腺激素释放激素(TRH),促甲状腺激素(TSH)用ELISA测定,T3、T4用放射免疫分析法测定.具体测定方法按照试剂盒说明书操作.
1.5统计学处理:使用SPSS11.5统计软件,各组实验数据均用(x珚±s)表示,组间差异的显着性用t检验进行统计学处理.
2结果
2.1大鼠血糖、胰岛素水平:相比较正常组,Hy-poxia组大鼠血糖值稍有降低,但无显着统计学意义,但胰岛素水平显着升高(P<0.05).Hypoxia组大鼠的胰岛β细胞功能指数HOMAβ高于正常对照组,但个体差异较大,见表1.
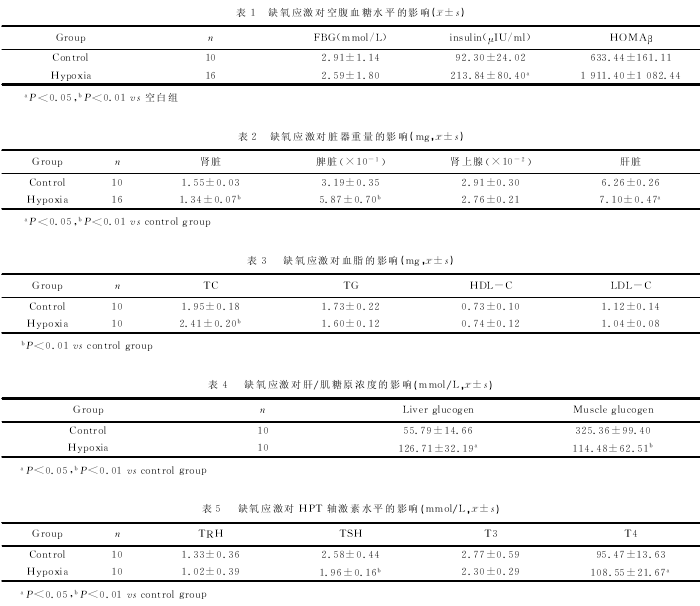
2.2大鼠脏器重量的变化:与正常对照组相比,Hypoxia组大鼠的肾脏重量显着降低(P<0.05),脾脏、肝脏重量显着升高(P<0.01,P<0.05),肾上腺重量有下降趋势,但无显着统计学差异,见表2.
2.3大鼠血脂水平的变化:与正常对照组相比,Hypoxia组大鼠TC含量显着增高(P<0.01),TG、LDL-C含量下降,但无显着统计学差异,见表3.
2.4大鼠肝糖原、肌糖原含量变化:相比较正常组,Hypoxia组大鼠肝糖原显着升高(P<0.05),而肌糖原显着降低(P<0.01),见表4.
2.5大鼠HPT轴激素水平的变化:相比较正常组,Hypoxia组大鼠TRH、TSH、T3具有下降趋势,仅TSH具有统计学意义(P<0.01),而T4显着升高(P<0.05),见表5.
3讨论
高原缺氧是高原环境中影响生命活动的主要因素.随着海拔升高,氧分压下降,为了保持在细胞水平的氧分压趋于正常,机体将产生一系列的习服机制.机体正常的糖脂代谢是维持机体稳态最重要的方面,而当受到环境缺氧应激后糖脂代谢表现出不同的反应.本实验研究发现,Hypoxia组大鼠血糖值较正常组降低,而胰岛素水平显着升高.
Hypoxia组胰岛β细胞功能指数HOMAβ较高.缺氧组血浆胰岛素水平高于对照组,其原因是多方面的,随着缺氧习服过程的延长,内分泌系统对胰岛的调节作用以及胰岛氧供的逐步改善使得胰岛素分泌功能得以上调.而胰岛素-胰岛素受体信号的变化可能是缺氧习服过程中葡萄糖摄取能力增强的重要机制[3].与正常对照组相比,Hypoxia组大鼠的脾脏、肝脏重量显着升高,肾脏、肾上腺重量降低.另外,Hypoxia组大鼠肝糖原显着升高,而肌糖原显着降低.肝糖原主要用于维持血糖浓度,肝糖原增加一方面说明血糖的去路增加,来路减少,血糖不高,另一方面说明血糖处于平衡稳态状态.肝糖原储备的增加导致肝脏重量的显着增加.肌糖原分解,则主要通过糖酵解途径为紧张活动的肌肉收缩提供ATP.肌肉组织是葡萄糖消耗的主要器官,有研究报道,缺氧大鼠骨骼肌对葡萄糖的摄取率显着高于正常大鼠[3],细胞膜与细胞内质膜上转运体密度均增加是缺氧习服后大鼠骨骼肌葡萄糖转运体的变化特点,是缺氧习服后骨骼肌葡萄糖摄取能力增强的重要原因之一[4].脾脏是机体重要的免疫器官之一,高原缺氧应激可能使得机体产生自我保护机制,免疫器官可储备能量物质.大量研究发现,缺氧耐受在人体多个器官发现,持续缺氧有可能导致组织器官在功能和形态的代偿,形成缺氧耐受.胰岛细胞也可能在缺氧状态下产生胰岛缺氧耐受.长期的慢性缺氧环境对胰岛的结构可能产生深远的影响[3].肾脏和肾上腺组织重量相对较低,其原因有待进一步深入研究.
脂代谢结果显示,与正常对照组相比,Hypoxia组大鼠TC含量显着增高,TG、LDL-C含量稍有下降,HDL-C含量稍有增高.一方面,可能是由于机体对抗寒冷的保护机制发挥作用,使得脂肪含量增加;另一方面,可能是由于机体内脂蛋白脂酶活力减弱,以及某些代谢关键基因的变化,导致游离TC浓度增高[5].对HPT轴激素水平的研究发现,相比较正常组,Hypoxia组大鼠TSH显着下降,TRH、T3具有下降趋势,而T4显着升高.说明高原缺氧应激可刺激大鼠机体HPT轴发生改变.大量研究报道发现,HPT轴功能变化与缺氧应激密切相关,各种不同程度的缺氧均可导致HPT轴功能异常及激素紊乱[6,7],推测HPT轴功能紊乱有可能是导致机体糖脂代谢紊乱的关键,但具体机制有待进一步阐明.
【参考文献】
[1]Schoene RB.Illnesses at high altitude[J].Chest,2008,134:402-416.
[2]Cantley J,Grey ST,Maxwell PH,et al.The hypoxia re-sponse pathway andβ-cell function[J].Diabetes ObesMetab,2010,(Suppl 2):159-167.
[3]黄缄,范有明,高钰琪,等.慢性缺氧对大鼠骨骼肌胰岛素受体的影响及其在增强葡萄糖摄取能力中的作用[J].第三军医大学学报,2005,27(1):9-11.
[4]黄缄,黄庆愿,高钰琪,等.缺氧习服大鼠骨骼肌葡萄糖转运体特点的研究[J].第三军医大学学报,2004,26(18):1607-1610.
[5]Klein S.Abdominal adiposity:An emerging marker intro-duction[J].Clin Cornerstone,2008,9(1):8-10.
[6]Ianko RV.The influence of normobaric hypoxia on themorphofunctional changes of thyroid gland in young rats[J].Fiziol Zh,2013,59(3):65-71.
[7]周珺,罗晓红.高原环境损伤与HPT轴的应激性变化[J].西北国防医学杂志,2013,34(1):57-59.





