摘 要: 目的 检测中电导钙激活性钾离子通道(IKCa1)在围着床期子宫内膜的表达及其在胚胎着床过程中的作用。方法 分别取分泌和增生早、中、晚期子宫内膜组织各5例。应用q PCR和免疫组化技术检测各期IKCa1 m RNA和蛋白的表达。体外培养人子宫内膜癌Ishikawa细胞,不同浓度(0、10、20、30?mol/L)IKCa1阻滞剂TRAM-34干预后,q PCR检测细胞IKCa1表达,CCK-8法检测细胞增殖能力,Transwell实验检测细胞体外胚胎黏附能力,Western blot检测细胞上皮-间质转化(EMT)相关蛋白E盒结合蛋白1(Zeb1)和上皮型钙黏蛋白(E-cadherin)表达。结果 IKCa1在人子宫内膜中呈时序性表达,分泌期表达水平较增生期显着增高,以分泌中期最高。TRAM-34抑制IKCa1表达后,Ishikawa细胞增殖和胚胎黏附能力减弱;EMT标志蛋白E-cadherin表达显着上调,Zeb1表达显着下调(P<0.05)。结论 IKCa1可能参与围着床期子宫内膜容受性的建立,并通过影响子宫内膜细胞增殖和EMT调控胚胎着床。
关键词: 瞬时电导钙激活钾通道; 子宫内膜; 胚胎植入; 上皮-间质转化; 钙黏着糖蛋白类; E盒结合锌指蛋白1;
Abstract: Objective To detect the expression of intermediate-conductance-Ca2+-activated K+channels(IKCa1) in endometrium during peri-implantation and explore the role of IKCa1 in embryo implantation.Methods tissue samples of early, middle and late secretory stages and early, middle and late proliferative stages were taken respectively in 5 cases. Immunohistochemistry and quantitative PCR(qPCR) were used to detect the expression of IKCa1 mRNA and protein in endometrial tissues of different stages. Ishikawa cells were cultured in vitro and treated with different concentrations(0, 10, 20 and 30 ?mol/L) of IKCa1 blocker TRAM-34. The expression of IKCa1 was detected by qPCR, cell proliferation was detected by CCK8, the cell adhesion was detected by Transwell and the expressions of EMT related proteins, E-box binding protein 1(Zeb1) and E-cadherin were detected by Western blot assay.Results The expression of IKCa1 was time-dependent in human endometrium. The expression level of IKCa1 was significantly higher in secretory phase than that in proliferative phase, especially in middle secretory phase. The expression of IKCa1 was inhibited by TRAM-34 in Ishikawa cells. The cell proliferation and embryo adhesion decreased, the expression of EMT marker protein Ecadherin was significantly up-regulated, and the expression of Zeb1 protein was significantly down regulated(P<0.05).Conclusion regulate embryo implantation by influencing endometrial cell proliferation and EMT.
Keyword: intermediate-conductance calcium-activated potassium channels; endometrium; embryo implantation; epithelial-mesenchymal transition; cadherins; zinc finger E-box-binding homeobox 1;
胚胎的成功着床取决于胚胎的侵入能力和子宫内膜的容受性。胚胎植入时需要迅速重塑子宫内膜上皮屏障和恢复其免疫功能,而子宫内膜上皮细胞的上皮-间质转化(EMT)对子宫内膜上皮细胞的容受性起着重要作用[1]。血管生成和血管重塑也为内膜容受性的建立提供物质基础[2]。胚胎着床是一个母胎相互识别、相互融合的复杂过程。围着床期母胎免疫调节的任一环节失常都可能导致着床失败。中电导钙激活性钾离子通道(IKCa1)属钙激活钾通道(KCa)蛋白家族成员,由IKCa1基因编码。研究证实IKCa1在子宫内膜上皮及其癌细胞株中表达,可促进EMT[3],并促进细胞增殖、迁移和侵袭[4,5,6];亦可调节Th1/Th2细胞功能,参与血管生成[7,8,9]。由此推测IKCa1可能通过促进胚胎侵入,诱导子宫内膜EMT和血管生成,加速子宫内膜重塑和建立容受性,调节母胎免疫耐受等参与调节胚胎植入。为探究IKCa1在胚胎着床过程中的作用,本研究采用免疫组化技术检测IKCa1和EMT标记蛋白在围着床期子宫内膜的表达,并利用IKCa1通道阻滞剂TRAM-34降低子宫内膜细胞IKCa1表达及活性,探讨IKCa1与内膜容受性和胚胎植入的关系。
1 、材料与方法
1.1、材料
1.1.1、组织标本
收集2018年1月—12月在西南医科大学附属医院生殖中心接受体外受精-胚胎移植(IVF-ET)助孕前1周期行子宫内膜活检的患者,分别取分泌和增生早、中、晚期子宫内膜组织各5例。纳入标准:年龄<38岁,月经周期规律且有排卵,基础性激素水平正常,周期25~35 d,近3个月无激素类药物使用史及宫腔操作史,宫腔形态正常。排除标准:有子宫黏膜下肌瘤、子宫畸形、内膜息肉、宫腔粘连者,宫腔形态异常、染色体异常者,性传播疾病者。所有标本一部分经10%中性福尔马林固定,石蜡包埋后用于免疫组化染色,一部分冻存于液氨内用于后续研究。本研究经医院伦理委员会讨论通过,所有患者均签署知情同意书。
1.1.2、细胞系
人子宫内膜癌Ishikawa细胞株和人绒毛膜癌JAR细胞购自西南医科大学附属医院医学实验中心,复苏后单层培养于含10%胎牛血清的DMEM培养液中,置于37℃、5%CO2培养箱中培养。
1.1.3、主要试剂
SP-9000免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,DAB染色试剂盒、4%多聚甲醛溶液、兔抗E-cadherin多克隆抗体购自武汉博士德生物工程有限公司,TRAM-34、DMSO购自美国Sigma公司,胎牛血清、DMEM培养液、Transwell小室购自美国Corning公司,结晶紫、SDS-PAGE凝胶试剂盒、PVDF膜、ECL发光液、BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司,兔抗GAPDH多克隆抗体购自武汉三鹰生物技术有限公司,兔抗IKCa1、E盒结合蛋白1(Zeb1)多克隆抗体购自美国SAB公司,SYBR Green荧光定量PCR(q PCR)检测试剂盒购自康为世纪生物科技有限公司,辣根过氧化物酶(HRP)标记山羊抗兔Ig G二抗购自安徽合肥兰杰柯科技有限公司,引物委托上海生工生物工程技术服务有限公司合成。
1.2、方法
1.2.1、qPCR检测子宫内膜组织和Ishikawa细胞IKCa1m RNA表达
增生期和分泌期子宫内膜组织以及Ishikawa细胞,按照TRIzol一步法提取总RNA,用Oligo(d T)18进行逆转录。IKCa1引物序列:上游5'-GTGCGTGCAGGATTTAGGG-3',下游5'-TGCTAAGCAGCTCAGTCAGGG-3';内参照GAPDH引物序列:上游5'-ATGCTGGCGCTGAGTACGTC-3',下游5'-GGTCATGAGTCCTTCCACGATA-3'。PCR总反应体系:c DNA 1?L,上、下游引物各1?L,2×Ultra SYBR Mix 10?L,dd H2O补充至20?L。PCR扩增反应条件:95℃预变性10 min;94℃变性10 s,65℃退火20 s,72℃延伸15 s,循环40次;72℃终末延伸10 min。以2-ΔCt方法分析IKCa1 m RNA的相对表达量。
1.2.2、免疫组化检测子宫内膜组织IKCa1蛋白表达
石蜡切片经脱蜡、水化后,置于柠檬酸盐缓冲液中加热至95~100℃12 min进行抗原修复。经PBS清洗3 min×3次,3%过氧化氢孵育10 min,清洗,5%山羊血清封闭20 min。加入IKCa1一抗(1∶100)4℃孵育过夜,清洗,生物素结合山羊抗兔Ig G聚合物室温30 min,HRP标记的链霉亲和素溶液室温30 min。DAB显色剂显色1~2 min,自来水冲洗,苏木素复染2 min,盐酸乙醇分化2 s。经脱水、透明、封片后,于显微镜下观察染色结果并拍照。染色强度分级:0分(无染色),1分(弱染色),2分(中度染色),3分(强烈染色)。阳性细胞百分率:0分(0~5%)、1分(6%~25%)、2分(26%~50%)和3分(51%~100%)。免疫组化评分即两者乘积,总分≥3分为阳性,<3分为阴性[10]。
1.2.3、细胞培养与分组
对数生长期Ishikawa细胞接种于含10%胎牛血清的DMEM中,置于37℃、5%CO2培养箱中常规培养。采用DMSO配制10 mmol/L TRAM-34储备液,待细胞贴壁后,实验组加入不同浓度TRAM-34,使其终浓度分别为0(仅加入等量DMSO)、10、20、30?mol/L,各组细胞继续培养48 h后分别收集细胞进行后续实验。
1.2.4、CCK-8法检测子宫内膜细胞增殖
取对数生长期Ishikawa细胞制备成细胞悬液,接种到96孔板中,每孔添加200?L细胞悬液,各组设3个重复样本。37℃,5%CO2培养48 h后每孔加入10?L CCK-8试剂,用酶标仪检测其在450nm处的光密度(OD)值。
1.2.5、体外模拟胚胎植入实验(Transwell法)
取对数生长期Ishikawa细胞用含10%胎牛血清的DMEM制成细胞悬液,每孔1×105个接种培养于24孔板,待细胞贴壁后加入不同浓度的TRAM-34。放置Transwell小室,JAR细胞接种前予无血清DMEM处理细胞24 h,每孔1×104个JAR细胞接种培养于小室上室,置CO2培养箱(5%CO2、37℃)中培养48 h。取出小室,将小室内侧面的细胞清除,保留外侧面的细胞。4%多聚甲醛固定细胞30 min。甩干,结晶紫孵育30 min,自来水冲洗5 min,室温下自然干燥。在倒置相差显微镜(OLYMPUS,日本)下观察并拍照。随机读取5个视野并计数穿膜细胞数。
1.2.6、Western blot检测子宫内膜细胞EMT标记蛋白表达变化
Ishikawa细胞裂解后12 000×g离心15 min,收集上清,以BCA法测蛋白浓度。配制10%分离胶和5%浓缩胶,蛋白样品煮沸10 min预变性,上样,以浓缩胶80 V 40 min,分离胶120 V 70 min进行恒压电泳,250 m A恒流转膜,PVDF膜置于5%脱脂牛奶室温2 h;TBST洗膜,一抗E-cadherin(1∶500)、Zeb1(1∶500)和GAPDH(1∶8 000)4℃过夜,二抗(1∶10 000)室温孵育2 h。洗膜后添加ECL发光液,置于Bio-Rad凝胶成像系统显影后分析目的蛋白的相对表达量。SPSS 19.0 Graphpad 6.0
1.3、统计学方法
所有数据采用SPSS 19.0和Graphpad 6.0进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,2组均数间比较采用独立样本t检验,多组均数间比较用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 、结果
2.1、 IKCa1在正常月经周期子宫内膜的表达情况
q PCR结果显示,IKCa1 m RNA在人子宫内膜月经周期各期均有表达,增生各期表达处于低水平,差异无统计学意义(F=0.563,P>0.05)。IKCa1 m RNA在分泌期子宫内膜的表达,以分泌中期(即围着床期)最为显着(F=27.750,P<0.01),见图1。免疫组化染色结果显示,IKCa1在子宫内膜增生各期呈低表达或不表达,在分泌期呈高表达,分泌中期表达最强,主要表达于腺上皮和腔上皮细胞胞浆,见图2。
图1 正常月经各周期子宫内膜IKCa1 m RNA表达水平
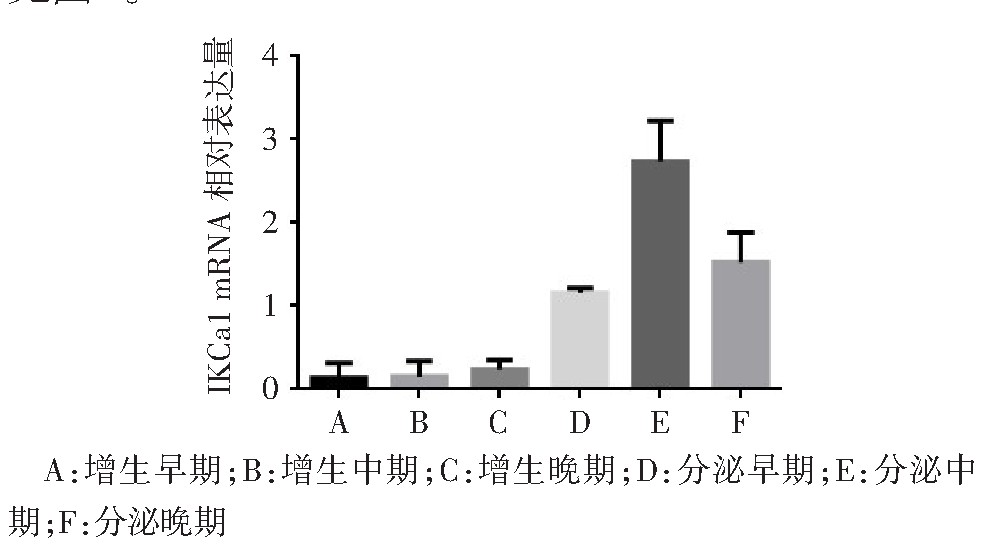
Fig.1 The expressions of IKCa1 m RNA in endometrium of normal menstrual cycle
2.2、 不同浓度TRAM-34对Ishikawa细胞增殖的影响
q PCR结果显示,与0?mol/L组相比,10、20、30?mol/L TRAM-34处理组IKCa1 m RNA表达水平随药物浓度增加明显下降(F=26.230,P<0.01),见图3。CCK-8结果显示,随TRAM-34浓度的增加,Ishikawa细胞增殖能力明显下降(F=275.100,P<0.01);其中以30?mol/L组下降最为显着,见图4。
2.3 、不同浓度TRAM-34对Ishikawa细胞体外胚胎植入能力的影响
Transwell结果显示TRAM-34干预子宫内膜Ishikawa细胞48 h,其对体外胚胎的黏附能力显着下降,穿过小室基底膜的JAR细胞数显着减少,差异有统计学意义(F=40.520,P<0.01),见图5、6。
图2 正常月经各周期子宫内膜IKCa1蛋白表达(免疫组化染色,×200)
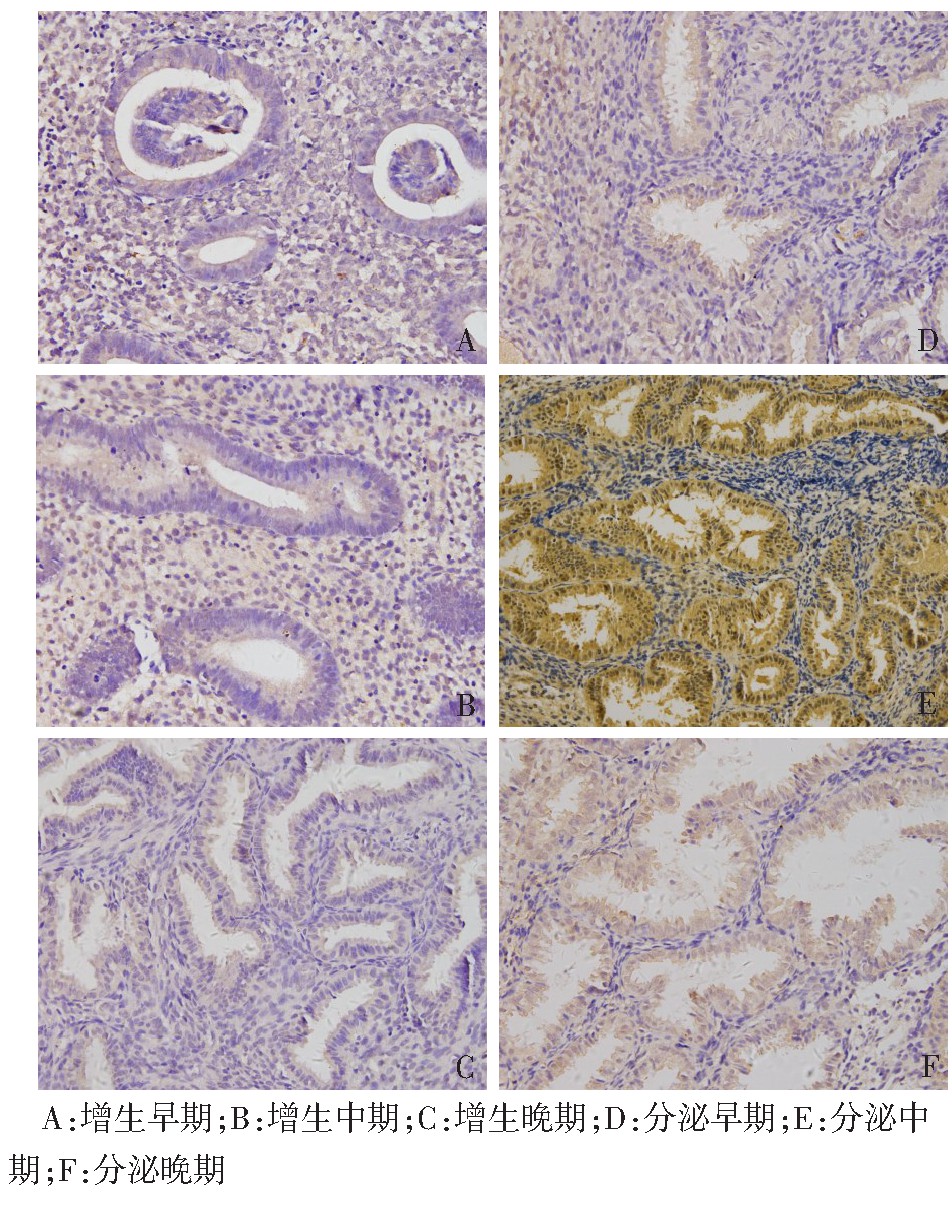
Fig.2 The IKCa1 expressions in endometrium of normal menstrual cycle(Immunohistochemical staining,×200)
图3 不同浓度TRAM-34处理后IKCa1 mRNA在子宫内膜细胞的表达
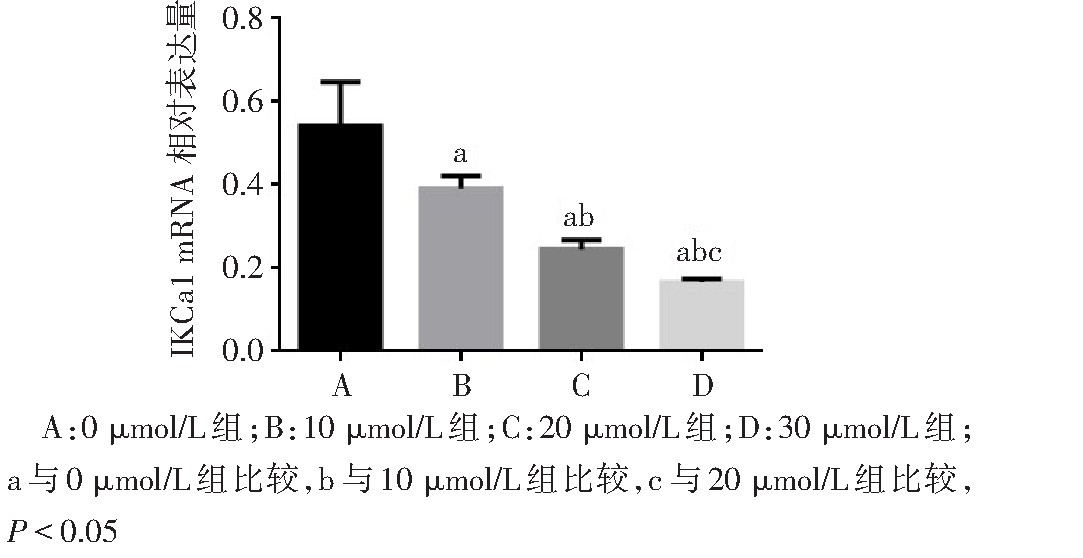
Fig.3 Expressions of IKCa1 mRNA in endometrial carcinomaIshikawa cells treatment with TRAM-34
图4 不同浓度TRAM-34处理后Ishikawa细胞增殖能力变化
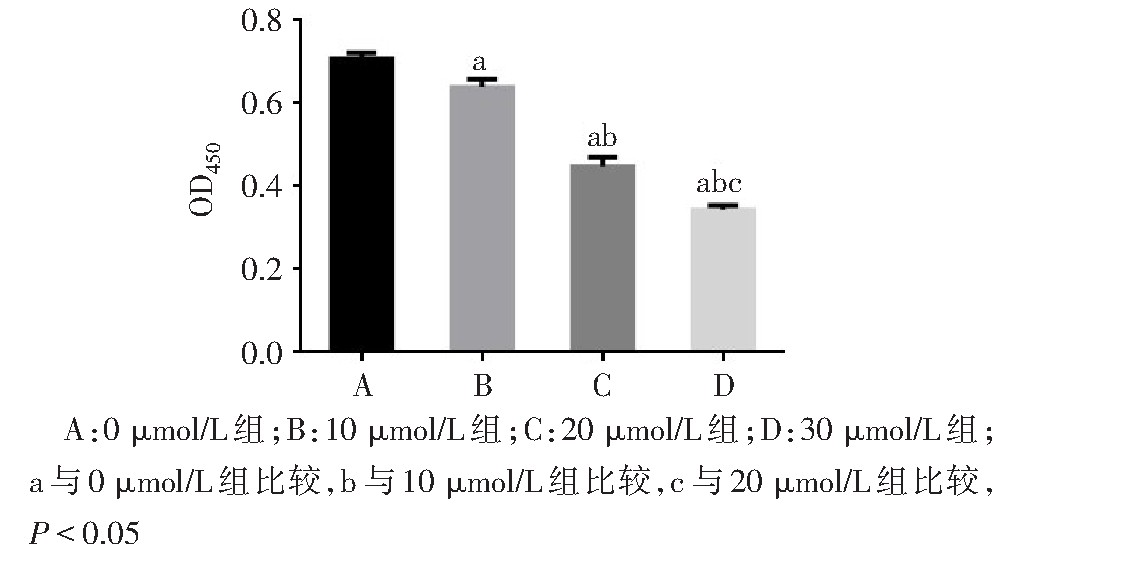
Fig.4 Changes of Ishikawa cell proliferation ability after treatment withdifferent concentrations of TRAM-34
图5 不同浓度TRAM-34处理后Ishikawa细胞对体外胚胎的黏附能力变化(Transwell实验,×200)
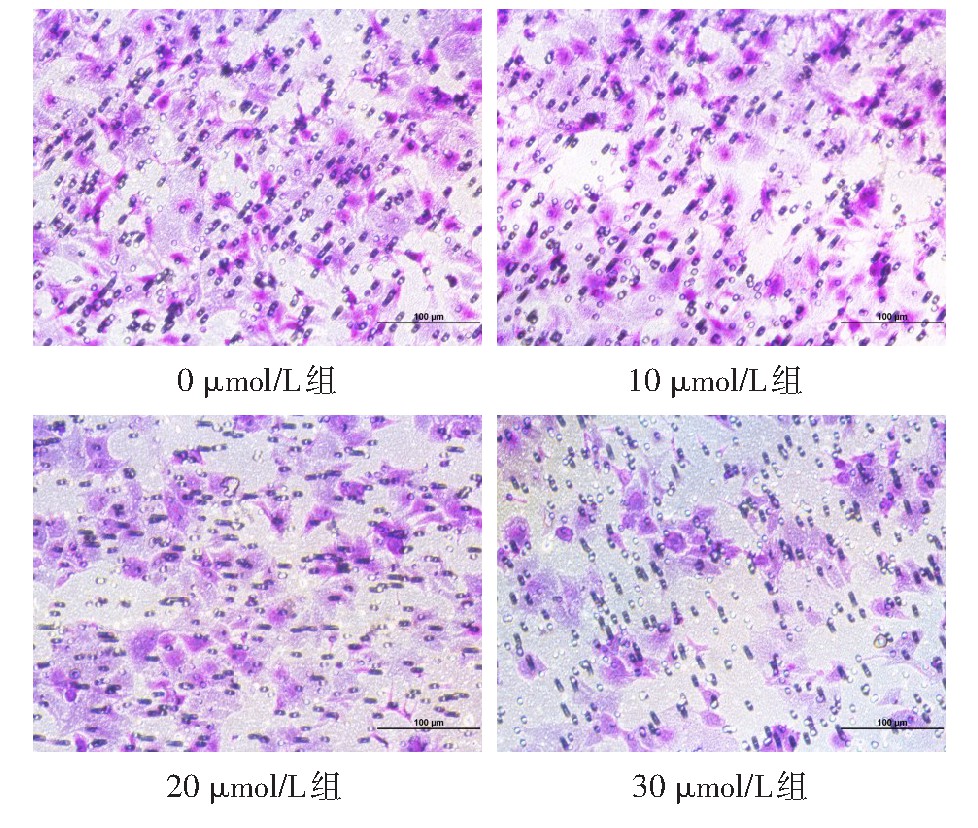
Fig.5 Changes of Ishikawa cell adhersion ability to embryos in vitro after treatment with different concentrations of TRAM-34(Transwell assay,×200)
图6 不同浓度TRAM-34处理后Ishikawa细胞侵袭数量比较
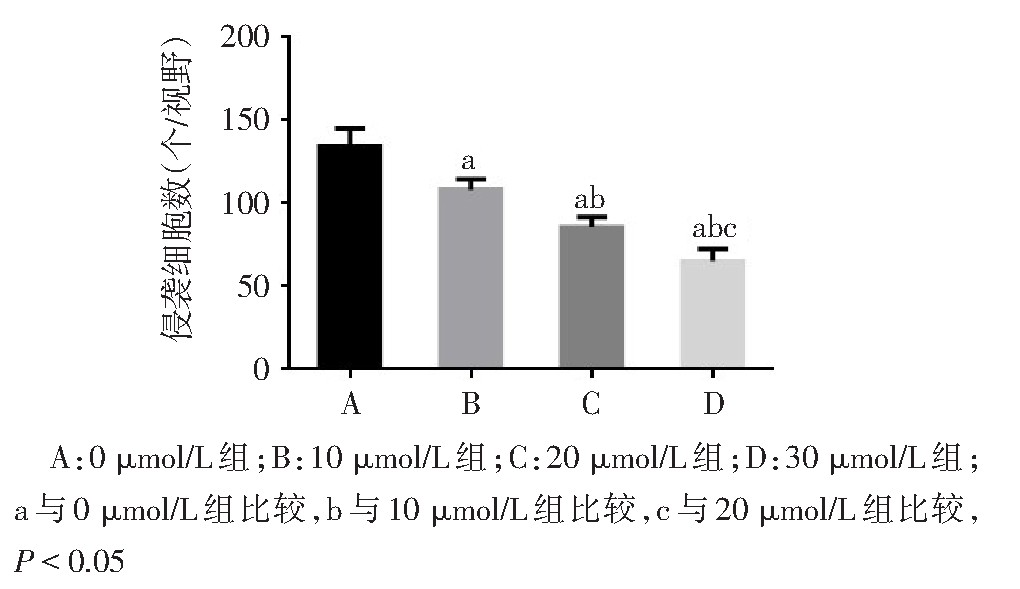
Fig.6 Comparison of the number of Ishikawa cells invaded by differentconcentrations of TRAM-34
2.4 、不同浓度TRAM-34对子宫内膜细胞EMT相关蛋白表达的影响
与0?mol/L组相比,30?mol/L组细胞E-cadherin蛋白表达明显上调(t=29.275,P<0.01),Zeb1蛋白表达明显下调(t=15.487,P<0.01),见图7。
3、 讨论
胚胎着床是妊娠的关键环节,是具备着床能力的胚胎与子宫建立紧密联系的过程[11]。围着床期子宫内膜处于容受状态,允许胚胎黏附并侵入子宫内膜,子宫内膜基质细胞广泛增殖和分化,发生蜕膜化形成初级蜕膜区,从而完成胚胎着床[12]。胚胎着床不仅需要发育成熟的囊胚,容受态的子宫内膜也是必不可少的,只有子宫内膜处于容受态时才会发生囊胚黏附[13]。在辅助生殖过程中胚胎移植成功率低的主要原因之一是胚胎移植时子宫内膜处于非容受态[14]。胚胎的正常着床对于后续妊娠维持和分娩均起重要作用,异常的胚胎着床可致流产、早产等[15]。
图7 TRAM-34处理后Ishikawa细胞EMT相关蛋白表达变化
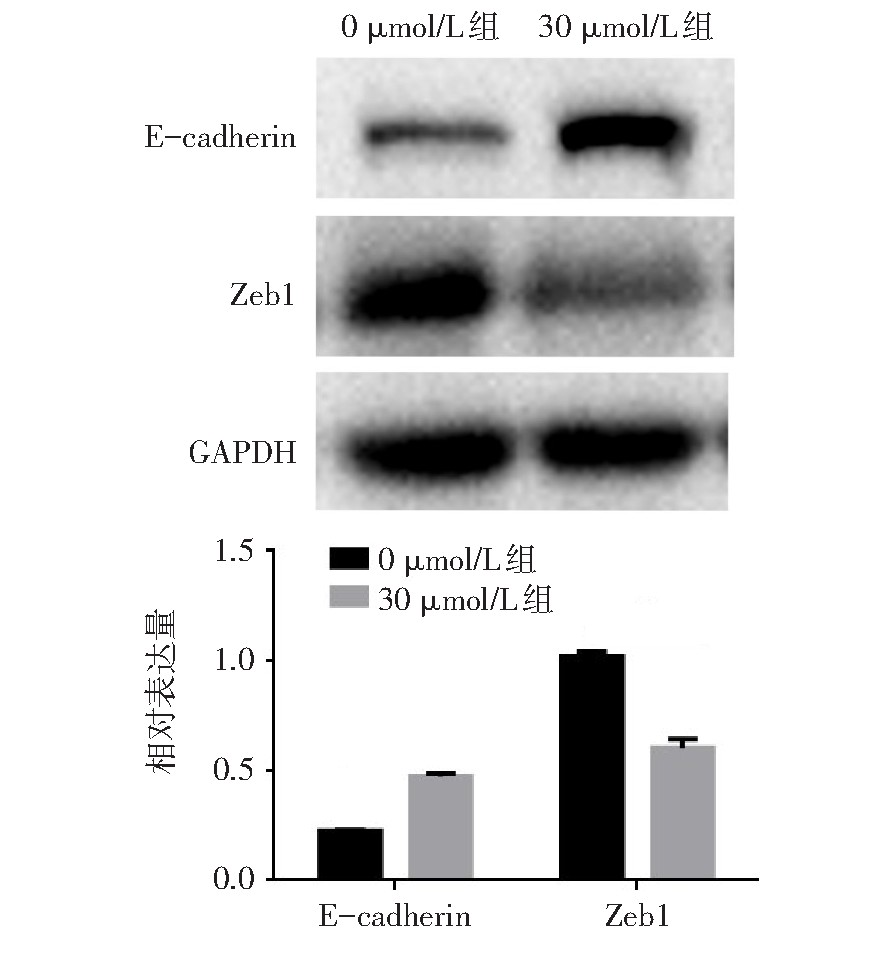
Fig.7 Expression of EMT-related proteins in Ishikawa cells after treatment with TRAM-34
KCa包括大电导KCa通道[BK(Ca)]、IKCa1和小电导KCa通道(SK3),均在子宫内膜细胞中表达,BK(Ca)通过介导子宫内膜感受性因子的表达来影响胚胎着床,SK3表达减少与妊娠失败相关,IKCa1则参与细胞增殖的调控[16,17]。IKCa1可促进血管内皮细胞增殖和血管生成[18],血管生成即建立血窦与血管网络系统,在胎盘形成之前,其为胚泡提供营养和输送氧,以保证胚胎生存和成功妊娠[19,20,21]。因此笔者推测,IKCa1通道可能也与胚胎着床有一定关系。本研究发现,子宫内膜分泌中期IKCa1表达明显升高,此期正处于围着床期,提示IKCa1可能参与子宫内膜着床窗的开放,有可能作为子宫内膜容受性的潜在分子标志物,促使子宫内膜达到容受态从而有利于胚胎黏附和植入。
胚胎着床时,胚胎外滋养层的细胞穿透子宫内膜上皮细胞并侵袭入子宫内膜间质细胞,此时子宫内膜上皮细胞迁移和转化的生物学行为和肿瘤细胞的侵袭和转移具有极大的相似性[22]。目前常利用人子宫内膜癌细胞与人绒毛膜癌细胞模拟体外胚胎着床过程[23]。有研究发现EMT也参与了胚胎植入的调节,其诱发植入部位的子宫内膜上皮细胞的运动和迁移,从而在胚胎到达之前使子宫内膜获得容受态[8]。本研究借鉴其实验方法,结果发现,TRAM-34降低子宫内膜癌Ishikawa细胞IKCa1表达后,细胞的增殖能力降低,EMT过程受到抑制,对体外胚胎黏附能力降低,提示IKCa1通道可能通过EMT参与了胚胎植入的调节,发挥促进胚胎着床的作用。
综上所述,IKCa1在子宫内膜的表达呈周期性,在围着床期高表达,有可能作为子宫内膜容受性的潜在标志物。因此,体外受精-胚胎移植前检测子宫内膜IKCa1的表达量,以评估子宫内膜的容受性,有助于提高胚胎移植成功率。
参考文献
[1] Xu Z,Zhao S,Zhou T,et al.Lipoxin A4 interferes with embryo implantation via suppression of epithelial-mesenchymal transition[J].Am J Reprod Immunol,2019,81(5):e13107.doi:10.1111/aji.13107.
[2] Kim M,Park HJ,Seol JW,et al.VEGF-A regulated by progesterone governs uterine angiogenesis and vascular remodelling during pregnancy[J].EMBO Mol Med,2013,5(9):1415-1430.doi:10.1002/emmm.201302618.
[3]Zhang P,Yang X,Yin Q,et al.Inhibition of SK4 potassium channels suppresses cell proliferation,migration and the epithelialmesenchymal transition in triple-negative breast cancer cells[J].PLo S One,2016,11 (4):e0154471.doi:10.1371/journal.pone.0154471.
[4] 程慧,高兰阳,詹平,等.IKCa1通道对He La细胞迁移、侵袭及mi RNA表达谱的影响[J].山东医药,2017,57(41):24-27.Chen H,Gao LY,Zhan P,et al.Effects of IKCa1 channels on migration,invasion,and mi RNA expression profile of human cervical cancer He La cells[J].Shandong Medical Journal,2017,57(41):24-27.doi:10.3969/j.issn.1002-266X.2017.41.007.
[5] Liu L,Zhan P,Nie D,et al.Intermediate-conductance-Ca2-activated K channel IKCa1 is upregulated and promotes cell proliferation in cervical cancer[J].Med Sci Monit Basic Res,2017,23:45-57.doi:10.12659/msmbr.901462.
[6] Zhang Y,Zhang P,Chen L,et al.The long non-coding RNA-14327.1 promotes migration and invasion potential of endometrial carcinoma cells by stabilizing the potassium channel Kca3.1[J].Onco Targets Ther,2019,12:10287-10297.doi:10.2147/OTT.S226737.
[7] Toldi G,Legány N,Ocsovszki I,et al.Calcium influx kinetics and the characteristics of potassium channels in peripheral Tlymphocytes in systemic sclerosis[J].Pathobiology,2020,87(5):311-316.doi:10.1159/000509674.
[8] Orbán C,SzabóD,Bajnok A,et al.Altered calcium influx of peripheral Th2 cells in pediatric Crohn's disease:infliximab may normalize activation patterns[J].Oncotarget,2016,7(29):44966-44974.doi:10.18632/oncotarget.10036.
[9] Mohr CJ,Steudel FA,Gross D,et al.Cancer-associated intermediate conductance Ca2+-activated K+channel KCa3.1[J].Cancers(Basel),2019,11(1):109.doi:10.3390/cancers11010109.
[10]Chen D,Zhou H,Liu G,et al.SPOCK1 promotes the invasion and metastasis of gastric cancer through Slug-induced epithelialmesenchymal transition[J].J Cell Mol Med,2018,22(2):797-807.doi:10.1111/jcmm.13357.
[11] Liu S,He J,Chen X,et al.Costimulatory molecule CD28participates in the process of embryo implantation in mice[J].Reprod Sci,2014,21 (6):686-695.doi:10.1177/1933719113512537.
[12] Liao XG,Li YL,Gao RF,et al.Folate deficiency decreases apoptosis of endometrium decidual cells in pregnant mice via the mitochondrial pathway[J].Nutrients,2015,7(3):1916-1932.doi:10.3390/nu7031916.
[13] 陈琦,彭洪英,张莹雷,等.胚胎植入研究的回顾和展望[J].科学通报,2009,54(18):2771-2782.Chen Q,Peng HY,Zhang YL,et al.Embryo implalltatlon:A time for recalling and forwarding[J].Chinese Science Bulletin,2009,54(18):2771-2782.doi:10.1007/s11434-009-0632-3.
[14] Haouzi D,Dechaud H,Assou S,et al.Insights into human endometrial receptivity from transcriptomic and proteomic data[J].Reprod Biomed Online,2012,24(1):23-34.doi:10.1016/j.rbmo.2011.09.009.
[15] Zhang S,Lin H,Kong S,et al.Physiological and molecular determinants of embryo implantation[J].Mol Aspects Med,2013,34(5):939-980.doi:10.1016/j.mam.2012.12.011.
[16] Zhang RJ,Zou LB,Zhang D,et al.Functional expression of largeconductance calcium-activated potassium channels in human endometrium:a novel mechanism involved in endometrial receptivity and embryo implantation[J].J Clin Endocrinol Metab,2012,97(2):543-553.doi:10.1210/jc.2011-2108.
[17]Lu YC,Yang J,Ding GL,et al.Small-conductance,calciumactivated potassium channel 3(SK3)is a modulator of endometrial remodeling during endometrial growth[J].J Clin Endocrinol Metab,2014,99(10):3800-3810.doi:10.1210/jc.2013-3389.
[18] Grgic I,Eichler I,Heinau P,et al.Selective blockade of the intermediate-conductance Ca2+-activated K+channel suppresses proliferation of microvascular and macrovascular endothelial cells and angiogenesis in vivo[J].Arterioscler Thromb Vasc Biol,2005,25(4):704-709.doi:10.1161/01.ATV.0000156399.12787.5c.
[19] Ramathal CY,Bagchi IC,Taylor RN,et al.Endometrial decidualization:of mice and men[J].Semin Reprod Med,2010,28(1):17-26.doi:10.1055/s-0029-1242989.
[20] Kim M,Park HJ,Seol JW,et al.VEGF-A regulated by progesterone governs uterine angiogenesis and vascular remodelling during pregnancy[J].EMBO Mol Med,2013,5(9):1415-1430.doi:10.1002/emmm.201302618.
[21] Karizbodagh MP,Rashidi B,Sahebkar A,et al.Implantation window and angiogenesis[J].J Cell Biochem,2017,118(12):4141-4151.doi:10.1002/jcb.26088.
[22] Manzo G.Similarities between embryo development and cancer process suggest new strategies for research and therapy of tumors:Anew point of view[J].Front Cell Dev Biol,2019,7:20.doi:10.3389/fcell.2019.00020.
[23] Yuan C,Li X,Song H,et al.BMP7 coordinates endometrial epithelial cell receptivity for blastocyst implantation through the endoglin pathway in cell lines and a mouse model[J].Exp Ther Med,2019,17(4):2547-2556.doi:10.3892/etm.2019.7265.





