
0 引 言.
雌激素受体是雌激素作用于靶器官的重要路径之一.雌激素水平、雌激素受体表达的差异,都会使细胞产生对雌激素的不同应答[1 -3].雌激素受体为配体依赖的类固醇超家族成员之一,有 α,β 2 种亚型,虽有高度同源性,但功能不同[4].骨髓基质干细胞具有高度自我更新和多向分化的潜能,可以定向或横向分化为多种细胞[5],目前已成为生命科学中的研究热点.作为雌激素靶器官的 BMSCs,不仅表达 ERα[6]
,更与 ERα 的生理功能相关.随着对ER 研究的深入,有关 ER 的实验要求也随之越来越高,如何建立一个稳定的实验平台更好地进行相关研究成了迫切需要解决的问题.本实验构建大鼠ERα 基因表达载体,并观察其在 rBMSCs 中的表达,为进一步探讨 ERα 的生理功能,尤其是在研究雌激素靶器官中的信号通路奠定基础.
1 材料与方法.
1. 1 实验动物 8 周龄雌性 SD 大鼠,4 只,购于北京大学医学部动物中心.动物实验合格证号: 京动字8910R018.动物实验遵从实验动物操作规范及伦理规范.SD 大鼠的饲养环境: 空气充足,12 h 光照,室温( 22 ±2) ℃,湿度45%~65%,自由饮食及饮水.
1. 2 实验材料 胎牛血清( 美国 Gibco 公司) ,DMEM培养液( 美国 Hyclone 公司) ,总 RNA 提取试剂( 北京欣博盛生物技术公司) ,cDNA 合成第一链试剂盒( 日本Toyobo 公司) ,2 × Trans Taq HIFI PCR SuperMixⅡ( 北京全式金生物技术公司) ,限制性内切酶 BamHⅠ及 XhoⅠ、T4 DNA 连接酶、Prime STARTM HS DNA 聚合酶、pMD18-T 载体、DNA marker DL2000( 大连宝生生物有限公司) ,质粒抽提及胶回收纯化试剂盒( 美国 QIA-GEN 公司) ,E. Coli 菌株 DH5( 上海第二军医大学生化教研室) ,pcDNA3.1(+) 质粒( 美国 Invitrogen 公司) ,rBMSCs( 广州赛业公司) ,LipofectamineLTX 转染试剂盒( 美国 Invitrogen 公司) ,兔抗大鼠 ERα、HRP 标记的羊抗-兔二抗( 美国 SouthernBiotech 公司) ,SYBR greenPCR master mix( 北京基诺来普试剂公司) .
1. 3 实验方法.
1. 3. 1 免疫细胞化学染色 培养皿中置入预先切割好的薄盖玻片( 1cm ×1 cm) ,细胞以 1 ×104/ cm2的密度接种于培养皿,使细胞在盖玻片上贴壁生长,培养2 d.将爬满细胞的盖玻片取出,按照免疫组化染色方法,对细胞进行脱水、固定、破膜、一抗孵育、二抗孵育、显色、透明,晾干后,中性树脂封片,显微镜观察.
1. 3. 2 大鼠 ERα基因的引物设计与 cDNA 合成①参照全长的 ERα 基因序列( GenBank 序列号 NM_012689) ,设计合成扩增大鼠全长 ERα 的引物,上游引 物 F-ER: 5'-GGATCCGCCGCCACCATGACCAT-GACCCTTCAC-3',下游引物 R-ER: 5'-CTCGAGAACT-CAGATGGTGTTGGGGAAGCCCT-3'.上游引物引入BamHⅠ位点,下游引入 XhoⅠ位点.引物由上海生工生物工程有限公司合成并经 PAGE 纯化定量.②大鼠子宫及双侧附件匀浆,Trizol 抽提 RNA.RNA 电泳检测结束后,对 RNA 浓度和 A 值进行测定.反转录按照 Toyobo 反转录试剂盒 First Strand cDNA SynthesisKit 说明书进行.对于所用的试剂均用 DEPC 处理水配制,置于冰上,在超净工作台上操作.
1. 3. 3 ERα 的 PCR 扩 增 ① PCR 反应体系为:
cDNA 5 μL,M 正向( F) 引物( 10 μmol / L) 1 μL,M 反向( R) 引物( 10μmol/L) 1μL,2 ×Trans Taq HIFI PCRSuperMi ×Ⅱ 12. 5 μL,去离子水 5. 5 μL,终体积为25 μL.②PCR 反应条件为: 94 ℃ 3 min→40 × ( 94 ℃30 s→55 ℃ 30 s→72 ℃ 1 min→72 ℃ 5 min→4 ℃ ∞ ,共35 个循环.③扩增结束后,取 PCR 产物 5 μL 在 1%的琼脂糖凝胶电泳上进行扩增产物检测分析.
1. 3. 4 重组 pcDNA3. 1(+) 表达质粒构建及鉴定 按照 DNA 回收试剂盒的说明,回收纯化 PCR 产物,与 T载体连接,用于转化感受态大肠埃希菌 DH5α.将转化的感受态细菌涂布于含氨苄青霉素的琼脂培养平板.挑选生长菌落,碱裂解法提取质粒 DNA,以BamHⅠ+ XhoⅠ酶切鉴定,并测序证实.
1. 3. 5 pcDNA3. 1(+) /ERα 质粒转入 rBMSCs ①将复苏成功并进入对数生长期的 rBMSCs 以 2 ×105个/孔的密度,接种于6 孔板,加入无抗生素的 DMEM,每孔2 mL.②37 ℃ 孵箱孵育至细胞铺满孔板的 60% ~80% .转染前 1 d,确定细胞形态正常,培养液颜色、性状正常.③按照 LipofectamineLTX 试剂盒说明书操作,转染0.2μg 重组质粒于 rBMSCs,同时转染空质粒作为对照,37 ℃培养箱培养 5 ~ 7 h.④去除培养液,加入含 10% 胎牛血清的 DMEM,继续培养,48 h后,提取细胞用做后续实验.
1. 3. 6 RT-PCR 及 Western blotting 检测鉴定转染后产物①收集转染 pcDNA3.1(+) /ERα 后的rBMSCs,按照1.3.2与1.3.3 的方法提取总 RNA,RT-PCR 检测 ERα mRNA的表达情况.②收集转染 pcDNA3. 1(+) /ERα 后的rBMSCs至 1. 5 mL 离心管,离心半径 10 cm,离心转速为5000 r / min,离心 5 min 后弃去培养液,加 10 倍体积的细胞裂解液于4℃裂解细胞沉淀30min,加适量的5 ×样缓冲液混合,100℃煮5min; 离心1min,取上清电泳.将电泳后的蛋白转至PVDF 膜,TBS 缓冲液洗膜、封闭,4℃过夜.加入兔抗大鼠 ERα 抗体( 1∶1000) 作为一抗,4℃过夜.HRP 标记的羊抗兔抗体作为二抗,37℃孵育1h.
TBST 漂洗 PVDF 膜,ECL 化学发光显色.
1. 3. 7 MTT 检测 将细胞悬浮于含 10% 胎牛血清的 DMEM 中,以 104个细胞/孔的密度接种于 96 孔板,每孔200μL.根据实验设计,选取不同的时间点进行 MTT 检测.将 25 mg/mL 的 MTT20 μL 加入待测孔,37 ℃ 孵育 4 h.去除上清液,加入 150 μL 的DMSO,震荡 10 min.选取 490 nm 的波长,在酶联免疫检测仪上,检测每孔的光吸收值,记录数值.
1. 3. 8 Realtime-PCR 检测 ①引物设计与合成 ERα:5'-GGATCCGCCGCCACCATGACCATGACCCTTCAC-3',5'-CTCGAGAACTCAGATGGTGTTGGGGAAGCCCT-3';β-actin: 5'-ACCTTCTACAATGAGCTGCG-3',5'-CCTG-GATAGCAACGTACATGG-3'.②提取 RNA 后,以反转录好的 cDNA 做为模板,进行 Realtime-PCR 实验.
PCR 反应体系为: SYBR Green 荧光燃料 MIX 5 μL,引物 UP( 10μmol/L) 0.5μL,引物 Down( 10μmol/L) 0.5μL,cDNA 第 1 条反应产物 2 μL,去离子水 2 μL,总体积 10 μL.③Realtime-PCR 反应程序: 95℃ 5 min→95 ℃ 30 s→40 × ( 62 ℃ 30 s)→4℃∞.④溶解曲线反应程序:95℃ 15s→60℃ 15s→95℃ 15s.
1. 4 统计学分析 采用 SPSS 12. 0 统计软件进行单因素方差分析,实验数据采用均数 ± 标准差( x ± s) 表示,两两组间比较用 LSD 检验.以 P≤0. 05为差异有统计学意义.
2 结 果.
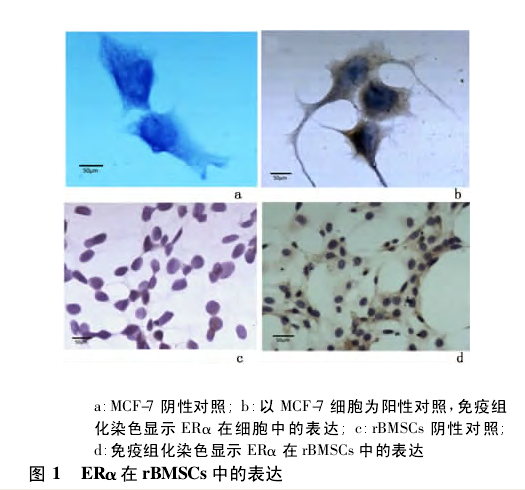
2. 1 免疫组化染色 以 MCF-7 细胞为阳性对照,rBMSCs 的细胞核、细胞质中都可见 ERα 阳性棕色颗粒表达,以细胞质表达为多,见图 1.
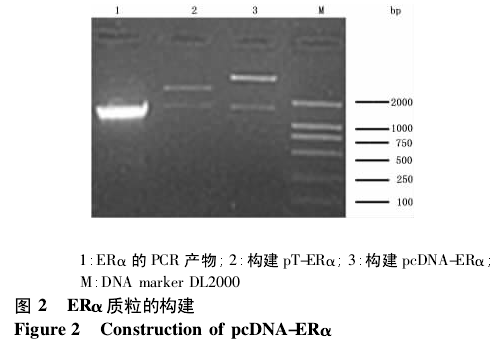
2. 2 重组质粒 pcDNA-ERα 的构建及鉴定 抽提大鼠子宫及双侧附件总 RNA,以 1.5%琼脂糖凝胶电泳进行鉴定.结果显示,抽提的 4 只大鼠的总 RNA 均完整.将抽提的总 RNA 逆转录,以合成的 cDNA 为模板,PCR 扩增全长 ERα 基因.将 PCR 产物纯化回收,克隆入载体,以 BamHⅠ+ XhoⅠ酶切筛选出阳性重组子,并进行 DNA 测序,测序结果显示与 GenBank 公布序列( 序列号: NM_012689) 完全吻合( 结果未显示) .重组质粒 pcDNA3. 1(+) /ERα 引入 BamHⅠ+XhoⅠ酶切位点,酶切鉴定,见图 2.
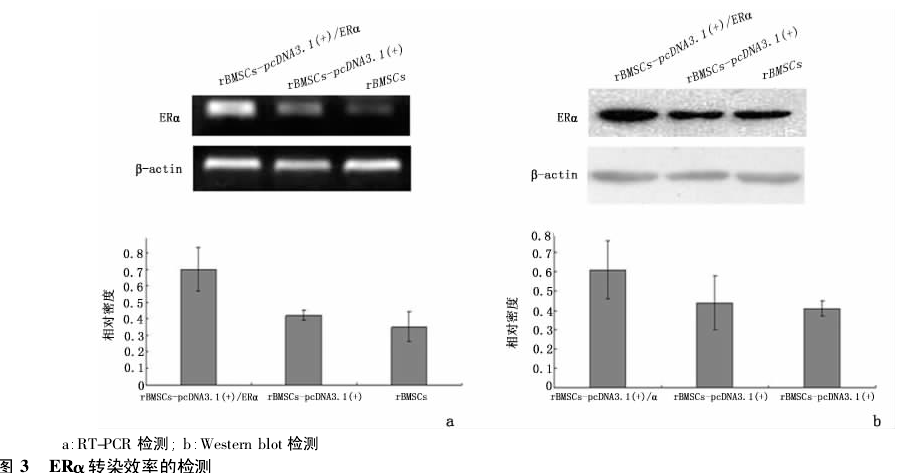
2. 3 重组质粒在 rBMSCs 中表达 分别提取瞬时转染组[rBMSCs-pcDNA3. 1(+) /ERα]、空载体转染组[rBMSCs-pcDNA3.1(+) ]、空白对照组( rBMSCs) 细胞总 RNA,做逆转录 PCR.取 RT-PCR 产物行 1%琼脂糖凝胶电泳,结果显示,在 β-actin 一致的条件下,瞬时转染组细胞 ERα 的表达与正常组、空载体转染组细胞相比有明显升高,表明 pcDNA3. 1(+) /ERα 转入细胞后,成功增加了 ERα 基因表达,见图3a.
分别提取瞬时转染组[rBMSCs-pcDNA3.1(+) /ERα]、空载体转染组[rBMSCs-pcDNA3. 1( +) ]、空白对照组( rBMSCs) 细胞蛋白,做免疫印迹分析.Westernblotting 显示,ERα 蛋白在空转染组和对照组细胞均有表达,而在转染组条带明显增强,表明重组质粒转入细胞后,成功增加了 PELP1 的蛋白表达,与基因水平鉴定结果相一致,见图 3b.
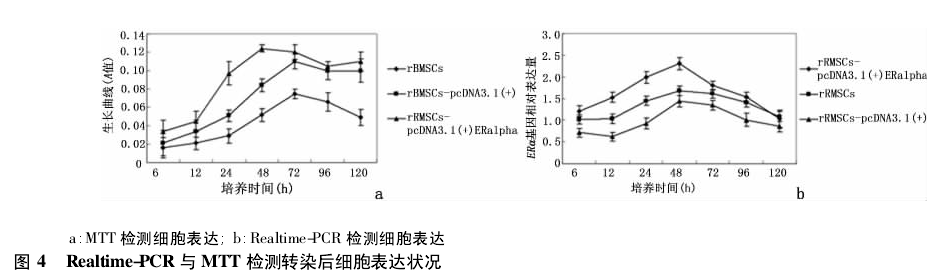
2. 4 重组质粒转染前后对细胞生长的影响 MTT 显示,ERα 的高表达对细胞的生长产生了抑制,但3 组细胞之间的生长曲线趋势未发生明显变化,见图 4a.
Realtime-PCR 显示,在 3 组不同处理的细胞组中,ERαmRNA 的表达存在差异,证明载体转入细胞后有效,在 mRNA 的水平成功增加了 ERα 的表达,见图4b.
3 讨 论
高表达载体的建立,目前应用的有多种方法[7 -8].为了最大程度地保证产物与模板的一致性,实验利用真核表达载体上的多克隆位点和重组质粒的酶切位点,将 ERαcDNA 定向连接于两酶切位点间,成功构建了 ERα 真核表达载体,并通过脂质体转染使 ERα 可以在 BMSCs 中高表达.实验中选择阳性菌落进行质粒小量提取[9],有利于简化步骤,提高效率.
构建的真核表达载体经酶切并测序后,证实结果与预期一致,表明 ERα 的真核表达载体构建成功,可作为转移 ERα 的工具.本实验在选择转染方法上采用了瞬时转染.因为稳定转染需要进行较长的稳定筛选,骨髓基质干细胞不断分化可能降低了其作为干细胞的特性.转染前细胞的状态与转染效率密切相关.
骨髓基质干细胞为贴壁生长的细胞,对数生长期为32 h左右,转染前 24 h 胰酶消化重新接种,转染前 4 h更换新鲜培养液,可以最大限度保证细胞的良好生长状态.基因转入细胞后,对其表达的检测受到时间限制,因为转染了外源基因的细胞代谢负荷大,增殖较慢,过长的筛选时间会使细胞被没有外源基因转入的细胞淹没,导致阳性克隆筛选失败.本实验在转染 48h 后收集细胞进行检测,在基因和蛋白水平均成功检测出了 ERα 的高表达.
骨髓基质干细胞具有多向分化潜能,可在条件分化液的作用下向成骨细胞、脂肪细胞、神经细胞、软骨细胞等分化[10 -11].作为雌激素的靶细胞,本实验也证明,骨髓基质干细胞在细胞核和细胞质中均表达 ERα.有研究表明,ERα 与骨髓基质干细胞的骨向分化能力正相关[7],参与细胞的多种生理功能.
选择骨髓基质干细胞作为受体细胞,不仅可更深入地研究 ERα 功能,更能拓展骨髓基质干细胞的研究范围,进而开拓更广的临床应用前景.
实时定量PCR 动力学较宽、在低表达水平下也可以分析基因表达的细微变化等,目前作为监测基因表达的有效工具[12 -13].实时定量检测结果显示了基因由外源性插入后,在细胞中表达的时间性变化.在 48h 时,基因的表达量达到峰值,随后随着培养时间的延长,基因表达水平随之下降.本实验选取 48 h 作为细胞检测时间点,可提高检测效率.MTT 检测显示,ERα 转入细胞后,抑制了细胞的生长.推测外源性ERα 基因的插入,改变了细胞中 ERα 的核浆表达比例,使细胞对于外环境的应答发生了改变,进而影响了细胞的生长.但增殖曲线的变化不能完全说明ERα 的转入对细胞生长的影响[6,14],因为外源基因的插入,细胞出现过负荷现象,自身的生长减缓,也会对生长曲线产生影响,需要进一步的实验证明 ERα 高表达与细胞生长的相关性.
综上所述,本实验成功构建了 ERα 真核表达载体,使骨髓基质干细胞中 ERα 过表达,并对转染后细胞的生理功能进行了初步探讨,为 ERα 和骨髓基质干细胞的后续研究奠定了基础.
【参考文献】
[1] Singh RR,Kumar R. Steroid hormone receptor signaling in tu-morigenesis[J]. J Cell Biochem,2005,96( 3) : 490-505.
[2] Gruber CJ,Gruber DM,Gruber IML,et al. Anatomy of the estrogenresponse element[J]. Trends Endocrin Met,2004,15( 2) : 73-78.
[3] Ijichi N,Ikeda K,Horie-Inoue K,et al. Estrogen-related receptora modulates the expression of adipogenesis-related genes during ad-ipocyte dierentiation[J]. BBRC,2007,358( 3) : 813-818.
[4] Wong CW,McNally C,Nickbarg E,et al. Estrogen receptor-in-teracting protein that modulates its nongenomic activity-crosstalkwith Src / Erk phosphorylation cascade[J]. Pro Soc Natl Acad SciUSA,2002,99( 23) : 696-699.
[5] 何秀华,李东良,江 军,等. 大鼠骨髓间充质干细胞的培养及示踪优化[J]. 解放军医学杂志,2011,36( 2) : 137-140.
[6] Wang Q,YU JH,Zhao QT,et al. Temporal expression of estro-gen receptor alpha in rat bone marrow mesenchymal stem cells[J]. Biochem Biophys Res Commun,2006,347( 1) : 117-123.
[7] 李 涛,于文燕,欧小利,等. 带 FLAG 标签小鼠 HuR 真核表达载体的构建及其生物学功能的鉴定[J]. 解放军医学杂志,2011,36( 4) : 352-355.
[8] 智深深,朱 静,田 杰,等. 小鼠 Islet-1 基因 RNAi 慢病毒载体的构建[J]. 解放军医学杂志,2011,36( 2) : 170-173.
[9] 李 菲,陆江阳,刘 茜,等. MARCH1 真核表达载体的构建及鉴定[J]. 解放军医学杂志,2012,37( 4) : 297-299





