
脊椎动物的血-脊髓屏障(blood-spinal cordbarrier,BSCB) 是血脑屏障(blood-brain barrier,BBB)的延伸,是中枢神经系统特有的屏障结构。BSCB 由脊髓微血管内皮细胞 (spinal cord mi-crovascular endothelial cell,SCMEC) 间的紧密连接及星形胶质细胞周足构成,可有效地阻止血液中的大分子进入脊髓实质,为中枢神经系统提供稳定的微环境[1].现有研究表明,多种脊髓病变与BSCB 屏障功能异常有关,如创伤性脊髓损伤[2, 3]、放射性损伤[4]、肌萎缩性脊髓侧索硬化症[5, 6]、感染[7]等。内皮细胞间的连接蛋白及细胞骨架是构成内皮细胞屏障的主要分子基础,其表达量、分布及相互作用的改变是导致内皮细胞通透性增高的直接原因[8].
血管生成素(angiopoietin,Ang1)是一种有效的血管生成因子,参与血管生成的各个阶段,许多其他血管生成因子可通过 Ang1 诱导新血管的生成。在血脑屏障,Ang1 作用于 Tie-2 酪氨酸激酶受体,参与维持屏障完整性及血管稳定[9, 10];近期有研究报道,Ang1 可通过上调紧密连接蛋白 ZO-2(zonula occludens-2)稳定脑微血管内皮细胞[11].在非中枢神经系统微血管内皮细胞,Ang1 可通过PI3K/Akt 途径发挥抗凋亡[12]及维持血管稳定性的作用[13].本研究以分离培养的大鼠 SCMEC 为研究对象,在体外建立 BSCB 模型,探讨 Ang1-Akt 途径对血脊髓屏障的通透性影响并初步分析其作用机制。
1 材料与方法
1.1 实验动物与试剂
成熟 Sprague-Dawley 大鼠(275~300 g)由中国医科大学实验动物部提供。DMEM/F12 培养基为 Sigma 公司(美国)产品;碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)、血管生成素 1(Ang1)购自 Peprotech 公司(美国);Wort-mannin 购自 Gene Operation(中国);蛋白 G 琼脂糖购自 Pierce 公司 (美国);PKA 抑制肽购自Merck Millipore 公司(德国);组蛋白 H2B 为 EnzoLife Sciences 公司(瑞士)产品;[γ-32P]ATP 购自北京福瑞生物科技有限公司(中国);兔 IgG、兔抗大鼠 occludin、ZO-1、β-catenin 抗体、驴抗兔 IgG(FITC)、Prolong Gold Antifade 封片剂购自 Invit-rogen 公司(美国);山羊抗大鼠 Akt1、β-actin、兔抗大鼠 pAkt 抗体、牛抗山羊 IgG(HRP)、牛抗兔 IgG(HRP) 购自 Santa Cruz 公司(美国);兔抗大鼠VE-cadherin 购自 Abcam 公司(美国);DC 蛋白定量试剂盒购自 Bio-Rad 公司(美国);增强型化学发光试剂盒购自 Pierce 公司(美国);其他常规试剂为 Sigma 公司(美国)产品。
1.2 主要仪器设备
Millicell誖ERS-2 细胞电阻仪;Millipore Milli-cell 插入式细胞培养皿;Beckman 液闪计数仪;Bio-Rad 电泳仪及电泳槽;Eppendorf 台式低温离心机;苏净 VS-1300U 超净台;Thermo ScientificSeries8000 CO2细胞培养箱;Olympus BX51 荧光显微镜。
1.3 实验方法
1.3.1 大鼠脊髓微血管内皮细胞 (SCMEC)的分离培养。按本实验室常规方法分离培养大鼠 SCMEC.
成熟 SD 大鼠 CO2窒息处死,手术分离椎管后注射冷 D-Hanks 液以分离脊髓组织,去除脑脊膜及大血管。冷 DMEM/F12 培养液中剪碎组织至1 mm3大小,冰上匀浆后于 37 ℃水浴胶原酶Ⅱ消化 30 min.消化产物 200 g 离心 5 min,22% BSA重悬组织沉淀,2 000 g 离心 10 min,弃上层髓磷脂成分,DMEM/F12 清洗下层血管组织。无菌滤器(BD Falcon,295 μm 及 40 μm) 依次过滤以进一步去除大血管及血细胞,收集微血管组分。0.1%胶原酶及脂肪酶于 37 ℃消化脊髓微血管 30 min,间歇搅拌并镜下观察,待内皮细胞出芽呈串珠样时 1 000×g 离心 5 min 终止消化。SCMEC 培养液(DMEM/F12、10%胎牛血清、10%马血清、2 mmol/L谷氨酸钠、1 g/L 肝素、1 μg/L bFGF、10 μg/L VEGF、50 mg/L 庆大霉素、3 μmol/L 嘌呤霉素)重悬消化后的微血管组分,接种于预铺 IV 型胶原及纤连蛋白(均为 5 μg/cm2)的培养平板,接种密度为 1×104/cm2.培养 6 d 待细胞融合成单层后常规免疫荧光观察因子Ⅷ表达情况,确定 SCMEC 分离培养纯度﹥95%.0.125%胰酶(含 0.02% EDTA)消化 SCMEC,按不同密度进行传代:1) 1∶1 接种于 6 孔培养板,用于蛋白样品制备;2) 1:5 接种于 6 孔培养板(内预置盖玻片),用于细胞免疫荧光;3) 1∶1 接种于Millicell 插入小室,置于 24 孔板(预铺胶质细胞)中,用于跨内皮电阻(TEER)测定。所有培养细胞于 37 ℃ 5% CO2培养箱中培养 7 d,每 2~3 d 更换培养液。
1.3.2 血管生成素 1 (Ang1)处理培养细胞为检测 Ang1 对体外 SCMEC 屏障功能的影响,于培养第 7 d 用 Ang1 (0.1 mg/L) 或 Ang1(100 mg/L)+Wortmannin(0.1 μmol/L)处理细胞12 h,于不同时间点(0、4、8、12 h)测量 Ang1 处理后跨内皮电阻变化,并收集 SCMEC 进行激酶活性测定及免疫印迹等检测。
1.3.3 Akt 激酶活性测定
通过测定 Akt 底物蛋白 H2B 的磷酸化状态反映 Akt 激酶活性,具体如下:收集 SCMEC 制备蛋白裂解液,蛋白 G 琼脂糖 4 ℃预孵育 30 min 后加入抗 Akt 抗体免疫沉淀 2 h,离心后依次用裂解液、纯水及激酶反应液(50 mmol/L HEPES、10 mmol/LMnCl2、10 mmol/L MgCl2、1 mmol/L 二硫苏糖醇、1μmol/L PKA 抑制剂,pH 7.2)清洗沉淀。在反应液中加入 20 μCi/mL[γ-32P]ATP 及 0.2 g/L 组蛋白 H2B,30 ℃孵育 10 min.取 25 μL 反应液滴于 Whatmanp81 阳离子交换滤纸,5%磷酸溶液终止反应,充分清洗后放入含 10 mL 蒸馏水的液闪瓶内,Beckman液闪计数仪测定 cpm 值。
此外,本研究亦采用放射自显影检测 Akt 激酶活性,即在上述激酶反应液中加入 50 μCi/mL[γ-32P]ATP 及组蛋白底物,30 ℃孵育 30 min 后用SDS 样品缓冲液终止反应,SDS-PAGE 分离蛋白成分后放射自显影观察 H2B 的磷酸化状态。
1.3.4 跨内皮电阻(TEER)测定
使用 Millicell誖ERS-2 细胞电阻仪测量双室培养系统中 SCMEC 跨内皮电阻值,以反映其内皮屏障功能及通透性。在 Ang1 处理后不同时间点(每个时间点设置 3 个平行孔),将正负电极分别置于培养内室及外室,记录待测孔电阻值(Ru),按公式 TEER=(Ru-Rc)×S 计算各组 TEER值(Ω·cm2),其中 Rc 为未接种细胞空白孔电阻值,S 为培养面积。
1.3.5 免疫印迹及免疫共沉淀
收 集 各 组 SCMEC,Nonidet P -40 裂 解 液(50 mmol/L Tris,150 mmol/L NaCl,2 mmol/L EG-TA,10% glycerol,1% Nonidet P -40,2 mmol/LPMSF,1 mmol/L Na3VO4,1 μg/mL 亮肽素,1 mg/L抑肽酶,pH 7.4) 处理后提取总蛋白,BCA 定量法测定蛋白浓度后制备蛋白样品。每组按 30 μg 上样量进行 SDS-PAGE 电泳分离蛋白成分,转印至PVDF 膜,50 g/L 脱脂奶粉封闭,依次经一抗、二抗孵育后进行 ECL 显色(β-actin 做为内参照)。
免疫共沉淀实验中每组取 400 μg 蛋白裂解液,用 2 μg 兔 IgG 进行预处理,加入蛋白 A 琼脂糖珠离心后,取上清加入 2 μg IP 抗体(ZO-1 或VE-cadherin,另设无 IP 抗体 IgG 对照),室温于旋转混匀过夜,加入蛋白 A 琼脂糖珠沉淀抗原抗体复合物,离心后用上样缓冲液处理琼脂糖珠,煮沸变性,SDS-PAGE 分离蛋白后按上述方法进行免疫印迹分析(抗 occludin 或抗 β-catenin 抗体)。
1.3.6 细胞免疫荧光
4% 多聚甲醛固定经 Ang1 处理 12 h 后的SCMEC,0.1% Triton-100 通透,5%牛血清白蛋白封闭,依次经抗 ZO-1 或 VE-cadherin 抗体及FITC 标记 IgG 孵育后,Prolong Gold Antifade 封片剂(含 DAPI)封片,于 Olympus BX51 荧光显微镜下观察结果。
1.3.7 统计学分析
本研究中 TEER、免疫印迹、放射自显影等实验结果均采用 GB-STAT 软件 (Dynamic Microsys-tems) 进行双因素方差分析及 Dunnett's 检验,P<0.05 为差异显着,P<0.01 为差异非常显着,有统计学意义。
2 结果
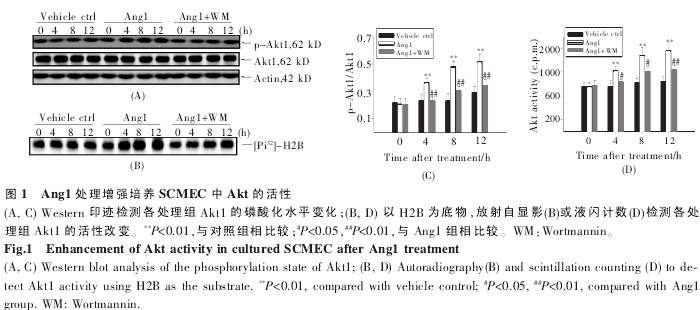
2.1 Ang1 处理增强体外培养 SCMEC 中 Akt 激酶活性。
体 外 分 离 大 鼠 脊 髓 微 血 管 内 皮 细 胞(SCMEC),建立体外血-脊髓屏障。由于在培养的内皮细胞系中 Ang1 可通过 Akt-PI3K 途径影响内皮细胞活力及血管生成过程[1],在本研究中我们首先检测了 Ang1 对 SCMEC 中 Akt 活性的影响。分别用 Ang1、Ang1+Wortmannin(WM,PI3K/Akt 途径抑制剂) 处理传代培养第 7 d 的 SCMEC单层,预处理后 0 h、4 h、8 h、12 h 收集各组细胞。免疫印迹结果显示,Ang1 处理 4 h 后,Akt1 磷酸化水平与对照组相比有明显升高,Wortmannin 则可抑制Ang1 引起的 Akt1 磷酸化(图 1A、C);以组蛋白 H2B为底物,放射自显影(图1B)及液闪计数(图 1D)均显示Ang1处理后,Akt活性有显着增高。该结果说明,Ang1 在本研究分离培养的 SCMEC 中可以活化Akt,且该作用可被 Wortmannin 所抑制。
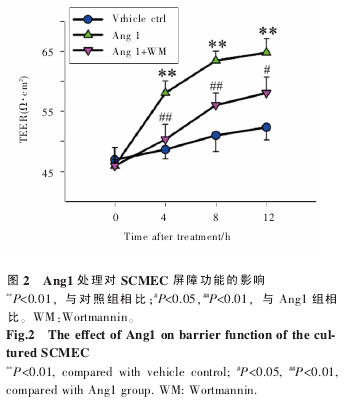
2.2 Ang1 通 过 影 响 Akt 活 性 增 强 体 外 培 养SCMEC 屏障功能。
为确定 Ang1-Akt 通路对 BSCB 屏障功能的影响,在 Ang1 处理双室培养的 SCMEC 后不同时间点测定跨内皮电阻(TEER)。结果显示,Ang1 处理后 4 h,SCMEC 单层上皮 TEER 值与对照组相比明显升高,即 Ang1 可增强体外培养 SCMEC 屏障功能;此外,该效应可被 Wortmannin 所拮抗,即与 Ang1 处理组相比,Ang1+WM 组 TEER 值有所下降(图 2)。该结果表明,Ang1 可能通过影响 Akt活性增强体外培养 SCMEC 屏障功能。
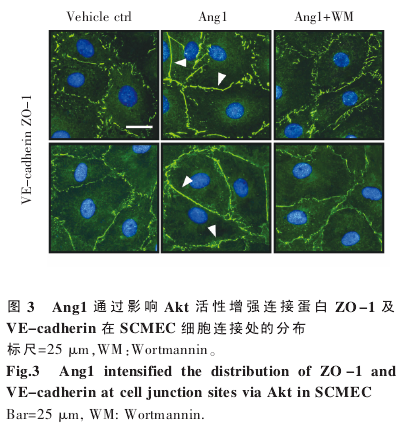
2.3 Ang1-Akt 通路影响连接蛋白在 SCMEC 细胞连接处的分布
为进一步明确 Ang1-Akt 途径影响 SCMEC屏障功能的机制,我们检测了几种细胞连接蛋白(occludin、ZO-1、VE-cadherin、β-catenin 等)经Ang1 处理后在细胞连接处的分布变化。为更清晰地观察细胞接触面,我们在细胞免疫荧光试验中采用 1∶5 比例进行传代培养,在该培养条件下,SCMEC 大多(>60%)呈现多角形。结果表明,紧密连接蛋白 ZO-1 及粘着连接蛋白 VE-cadherin 在Ang1 处理后在细胞连接处的分布显着增强,而Ang1+WM 组则无此改变(图 3),提示 Ang1 可通过 Akt 活性影响连接蛋白在细胞表面的分布,从而增强 SCMEC 的屏障功能。
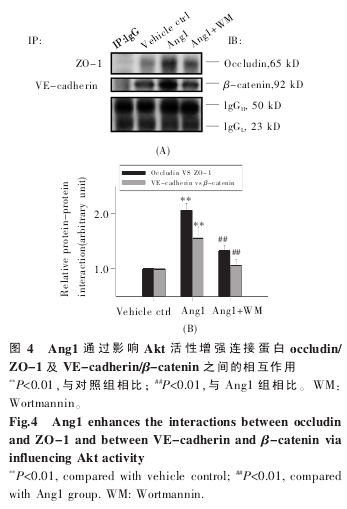
2.4 Ang1-Akt 通路影响 SCMEC 连接蛋白间的相互作用。
在观察到 Ang1 对 ZO-1 及 VE-cadherin 在细胞连接处的分布影响后,我们进一步通过免疫共沉淀检测了细胞连接蛋白间的相互作用改变。在 Ang1 处理 12 h 后,收集 SCMEC 裂解液,统计分析 Co-IP 结果显示,Ang1 可以增强 occludin/ZO-1 及 VE-cadherin/β-catenin 之间的相互作用分别达 200%及 150%以上,而 Ang1+WM 组与Ang1 处理组相比则抑制了连接蛋白间的相互作用,表明 Ang1-Akt 途径可通过促进细胞连接复合体的形成提高 SCMEC 的内皮屏障功能(图 4)。
3 讨论
脊髓微血管内皮细胞(SCMEC)在构成血脊髓屏障(BSCB) 中的功能与脑微血管内皮细胞(BMEC)构成血脑屏障(BBB)中的作用类似,近年来在血中枢神经系统屏障的研究中建立了许多成功模拟 BBB 或 BSCB 的体外模型[14~16].本研究通过分离培养成熟 SD 大鼠脊髓微血管,在适当条件下消化培养 SCMEC,经因子Ⅷ特异性抗体检测,SCMEC 纯度可达 95%[14, 15];在此基础上,于双室培养系统中共培养 SCMEC 和胶质细胞(已知后者可诱导中枢神经系统血脑屏障的形成[17]),通过每日测定 TEER 反映内皮屏障功能,发现在该培养条件下经 6~7 d 的培养,TEER 值可达 45~60Ω·cm2,表明成功建立体外 BSCB 模型。
Ang1 基因位于染色体 8q22,由 498 个氨基酸组成,主要由周细胞及血管平滑肌细胞表达,作用于内皮特异性酪氨酸激酶受体 Tie-2,其同源蛋白 Ang2 为其天然的竞争性拮抗剂。转基因研究证实,Ang1 基因缺失或 Tie-2 基因敲除的小鼠胚胎血管形成障碍、通透性增高且缺乏连续性从而不能形成血管网;而 Ang1 过表达的转基因动物则表现为血管增生变粗且内皮细胞与周细胞的连接完整[18].Ang1 在维持血管稳定性方面发挥重要作用,有报道称其中涉及 Akt 介导的抗凋亡效应[9, 12];此外,Ang1 可通过激活磷脂酰肌醇激酶(PI3K)引起柱蛋白(paxillin)磷酸化,加强内皮-基质间的相互作用,增加内皮管状结构的完整性。
在本研究中,我们首先检测了 Ang1 对体外培养的脊髓微血管内皮细胞 Akt 激酶活性的影响,即用 Ang1 处理培养 SCMEC 后收集细胞裂解液,采用[32P]-掺入试验测定激酶活性,放射自显影及液闪计数结果均显示 Ang1 处理后可引起 SCMEC中的 Akt 活性增高。结合以往报道,该结果提示Ang1 对 PI3K/Akt 途径的调节作用在内皮细胞中是普遍存在的。在此基础上,我们又进一步检测了Ang1 对体外 BSCB 屏障功能的影响,TEER 测定结果表明 Ang1 处理 4 h 后,SCMEC 屏障功能显着增强,同时发现该作用可被 PI3K/Akt 途径特异性抑制剂 Wortmannin 所拮抗,说明 Ang1 可通过影响 Akt 活性调节 BSCB 功能,降低其通透性,维持 BSCB 的稳定。
在内皮屏障结构中,相邻内皮细胞间的细胞连接的形成及完整性对内皮通透性的维持至关重要。因此,我们检测了 Ang1 处理后几种连接蛋白(occludin、ZO -1、ZO -2、VE -cadherin、β -catenin)的表达情况,免疫印迹结果显示无明显改变,说明Ang1 不是通过影响连接蛋白的表达量调节 BSCB的通透性。进一步通过免疫荧光技术发现,Ang1处理后支架蛋白 ZO-1 与钙黏蛋白 VE-cadherin在细胞接触面的分布明显增加;此外,紧密连接蛋白 occludin 与 ZO-1,以及 VE-cadherin 与连环蛋白 β-catenin 之间的相互作用也在 Ang1 处理后增强,且 Ang1 所引起的效应均可被 PI3K-Akt 途径抑制剂 Wortmannin 所抑制。
综上结果表明,Ang1 可通过 Akt 改变连接蛋白在 SCMEC 细胞连接处的分布状态,并影响连接蛋白之间的直接作用,从而改变 BSCB 的通透性及屏障功能,该结论仍需进一步在体内研究中进行验证。此外,Ang1 还可通过其他途径参与维持血管稳定性及诱导新血管生成,如有研究表明Ang1 可促进胞浆素和金属基质蛋白酶-2(MMP-2)的分泌和基底膜的降解,从而促进内皮迁移和管状结构生成,还可通过降低血小板内皮细胞粘附分子(PECAM)的磷酸化加强内皮间的连接,维持微血管壁的完整性[19]等等,这些信号转导分子在 Ang1 调节 BSCB 屏障功能的过程中是否发挥作用仍需进一步的研究阐明。
参考文献(References):
[1] ABBOTT N J, PATABENDIGE A A, DOLMAN D E, et al.Structure and function of the blood-brain barrier[J]. Neurobio-lo-gy of Disease, 2010, 37(1):13-25.
[2] BALENTINE J D. Pathology of experimental spinal cord trau-ma. I. The necrotic lesion as a function of vascular injury[J].Laboratory Investigation, 1978, 39(3):236-253.
[3] NOBLE L J, WRATHALL J R. Blood spinal cord barrier dis-ruption proximal to a spinal cord transaction in the rat: timecourse and pathways associated with protein leakage[J]. Expe-rimental Neurology, 1988, 99(3):567-578.
[4] NORDAL R A, WONG C S. Intercellular adhesion molecule-1and blood -spinal cord barrier disruption in central nervoussystem radiation injury[J]. Journal of Neuropatholology Exper-imental Neurology, 2004, 63(5):474-483.
[5] NICAISE C, MITRECIC D, DEMETTER P, et al. Impairedblood-brain and blood-spinal cord barriers in mutant SOD1-linked ALS rat[J]. Brain Research, 2009, 1301:152-162.





