摘 要: 目的 探讨二氧化硫 (sulfur dioxide, SO2) 对D-半乳糖 (D-galactose, D-gal) 诱导的衰老大鼠血管内皮功能的影响及其机制。方法 清洁级健康SD大鼠随机分为D-半乳糖组, D-半乳糖+SO2组和对照组, 连续3个月分别注射D-半乳糖、D-半乳糖和SO2供体、等量生理盐水。然后检测大鼠的收缩压 (systolic blood pressure, SBP) 、舒张压 (diastolic blood pressure, DBP) 和平均动脉压 (mean arterial pressure, MAP) 变化;检测离体胸主动脉环舒张功能变化;检测血管组织中过氧化氢 (hydrogen peroxide, H2O2) 浓度、丙二醛 (malondialdehyde, MDA) 水平、超氧化物歧化酶 (superoxide dismutase, SOD) 的含量及活性。结果 ①连续注射3个月后, 与对照组相比, D-半乳糖组大鼠的收缩压、舒张压及平均动脉压较高 (P<0.05) ;给予SO2处理的D-半乳糖+SO2组大鼠与D-半乳糖组相比, 收缩压、舒张压和平均动脉压较低 (P<0.05) ;②与对照组相比, D-半乳糖组大鼠胸主动脉环乙酰胆碱 (acetycholine, ACh) 诱导的舒张反应受损, 最大舒张率明显降低 (P<0.05) ;给予SO2处理的D-半乳糖+SO2组大鼠胸主动脉环舒张功能与D-半乳糖组相比有了明显改善, 最大舒张率显着升高 (P<0.05) ;③与对照组相比, D-半乳糖组大鼠胸主动脉血管组织中H2O2与MDA的表达均较高 (P<0.05) , 给予SO2处理后的D-半乳糖+SO2组大鼠胸主动脉血管组织中H2O2, MDA的表达与D-半乳糖组相比较低 (P<0.05) ;④三组大鼠胸主动脉血管组织中SOD含量无显着性差异;与对照组相比, D-半乳糖组大鼠胸主动脉血管组织中SOD活性明显较低 (P<0.05) , 给予SO2处理后的D-半乳糖+SO2组大鼠胸主动脉血管组织中SOD的活性与D-半乳糖组无显着性差异。结论 SO2可以减轻衰老大鼠的血管内皮功能障碍, 其机制可能与减轻氧化应激损伤有关。
关键词: 衰老; 二氧化硫; 血管内皮功能; 氧化应激损伤;
Abstract: Objective To investigate the effect of sulfur dioxide (SO2) on vascular endothelial function of D-galactose (D-gal) induced aging rats. Methods SD rats were randomly divided into D-gal group, D-gal + SO2 group and control group, then injected with D-gal, D-gal + SO2 donor, equivalent saline. The systolic blood pressure (SBP) , diastolic blood pressure (DBP) and mean arterial pressure (MAP) of these mice were measured. The diastolic function of thoracic aorta induced by acetycholine (ACh) were detected. The concentration of hydrogen peroxide (H2 O2) , malondialdehyde (MDA) and superoxide dismutase (SOD) in vascular tissues as well as the activity of SOD were determined. Results ①Compared with the control group, SBP, DBP and MAP of the D-gal group were higher (P<0.05) .The SBP, DBP and MAP of the D-gal + SO2 group were significantly lower than that of the D-gal group (P<0.05) .②Compared with the control group, the ACh-induced diastolic response of thoracic aorta in D-gal group was impaired, with a significantly reduced in the maximum diastolic rate (P<0.05) . The diastolic function of thoracic aortia in the D-gal+ SO2 group was improved, with a significantly increased in the maximum diastolic rate (P<0.05) . ③Compared with the control group, the expression of H2 O2 and MDA in the thoracic aortic tissue of the D-gal group was higher (P<0.05) , H2 O2 and MDA expression in D-gal+SO2 group was lower than that in the D-gal group (P<0.05) . ④There was no significant difference in SOD content among the three groups. Compared with the control group, SOD activity was lower in the thoracic aortic tissue of D-gal group rats (P<0.05) , but the administration of SO2 failed to change the SOD activity. Conclusion SO2 can alleviate vascular endothelial dysfunction in aging rats, and its mechanism may be related to the reduction of oxidative stress injury.
Keyword: Aging; Sulfur dioxide; Vascular endothelial function; Oxidative stress injury;
衰老是由多种因素引起的复杂的、不可避免的生理过程。衰老作为心血管疾病的独立危险因素,与高血压、冠心病、动脉粥样硬化等心血管疾病的发生发展密切相关[1,2]。随着年龄的增长,血管内皮、血管壁及血管外膜发生结构性和功能性的改变,主要表现为内皮功能障碍、血管壁增厚和细胞外基质重塑等,从而导致血管硬化和血管张力增加[3,4]。其中,内皮功能障碍被广泛认为是导致血管老化的关键因素[5,6]。
与衰老相关的内皮功能障碍存在多种机制,包括一氧化氮(Nitric Oxide, NO)浓度的降低、活性氧(Reactive oxygen species, ROS)的增加、促炎性细胞因子的刺激及内皮细胞的衰老等[7,8]。虽然血管老化的分子机制已经得到了广泛研究,但有效的治疗方法仍然非常缺乏,目前的干预还是仅限于改善生活习惯,如在饮食上注意限制热量的摄入及在生活中进行适度的运动等。随着我国人口老龄化的不断加重,对血管老化干预的研究具有十分重要的临床意义。

二氧化硫(sulfur dioxide, SO2)是一种无色且具有刺激性臭味的有毒气体,一开始人们对SO2的认识只停留在其毒性层面,近年来越多越多的研究表明,SO2不但可以内源性的由机体内含硫氨基酸氧化产生(如在心血管系统,半胱氨酸和同型半胱氨酸可以被天冬氨酸转氨酶AAT催化生成SO2),而且其在调节心率、维持血管舒张等过程中发挥着重要的生理作用[9,10]。实验研究发现,SO2参与了许多与血管疾病相关的病理生理过程,如可以减轻自发性高血压大鼠和缺氧性肺动脉高压大鼠模型中的血压增加及血管重建[11];可以下调TGF-β/Smad信号通路并减轻血管钙化[12],可以减弱AngⅡ诱导的高血压小鼠血管平滑肌细胞增殖等[13]。尽管已经有大量文献报道了SO2对心血管的各种保护作用,但其对血管衰老的作用,尤其是对衰老相关内皮功能障碍的作用及其机制,目前还没有得到充分研究。
本研究通过在D-半乳糖构建的衰老动物模型上对血压的变化、血管环舒张功能变化、氧化应激损伤的改善情况等方面综合探究SO2在衰老相关内皮功能障碍中的作用。
1、 材料与方法
1.1、 动物模型的建立及分组
8周大的健康雄性清洁级SD大鼠购于维通利华,在恒定的环境条件下饲养(12h光照/黑暗节律),环境温度(22±1)℃,自由摄取食物和水。待大鼠适应环境后将24只SD大鼠随机分为对照组(Control组)、D-半乳糖组(D-gal组)、D-半乳糖+SO2组(D-gal+SO2组),各8只。D-半乳糖、D-半乳糖+SO2组大鼠连续3个月皮下注射D-半乳糖(150mg/kg),对照组大鼠给予等量生理盐水。D-半乳糖+SO2组以亚硫酸钠(Na2SO3)和亚硫酸氢钠(NaHSO3)作为SO2供体(调整Na2SO3和NaHSO3的摩尔比为3∶1, pH7.4),连续3个月腹腔注射85mg/kg剂量,对照组和D-半乳糖组大鼠在同一时间点腹腔注射等量生理盐水。
1.2、血压的测量
3个月后, 静止状态下, 采用尾袖法用BP-100A全自动无创血压测量仪 (成都泰盟) 测量大鼠的收缩压 (SBP) 、舒张压 (DBP) 和平均动脉压 (MAP) 。各血压的取值方法为去除离群值和过量噪音或动物活动后的读数之后至少3次测量值的平均值。
1.3、 大鼠主动脉环的制备及等长张力实验
3个月后,CO2窒息法处死大鼠,解剖分离出胸主动脉,清除结缔组织后将主动脉切成3mm的血管环。然后按照通用的方法在这些分离出的胸主动脉环上评估血管舒张功能。即首先给予血管环一个2g前负荷的静息张力,经过60min平衡后,对动脉环进行苯肾上腺素(1μmol/L)预处理,待达到稳定收缩后,以累加的方式添加乙酰胆碱(ACh, 10-8~10-4mol/L),记录内皮依赖性舒张反应曲线。舒张反应结果以占苯肾上腺素收缩值的百分比表示(%)。
1.4、 活性氧及抗氧化酶活性的测定
胸主动脉组织在液氮中研磨后,在50mmol/L磷酸钾缓冲液中均质,然后10 000g离心5min,根据试剂说明书,用相应的检测试剂盒(建成生物)测定上清液中过氧化氢(H2O2)、丙二醛(MDA)浓度及超氧化物歧化酶(SOD)活性,均通过蛋白含量标准化,使用BCA蛋白检测试剂盒进行测定。
1.5、 Western Blot检测
将胸主动脉蛋白抽提后用BCA试剂盒进行蛋白浓度测定,而后进行WB实验,上样量为60μg, 10%SDS-聚丙烯酰胺凝胶电泳后转至PVDF膜上,5%脱脂牛奶封闭1h。而后一抗4℃孵育过夜:SOD1 (1∶1000, Abcam)。洗膜液洗3次后,2抗室温孵育1h,显影,利用Image J软件对条带灰度进行量化。
1.6、 统计学方法
运用SPSS 17.0统计学软件进行数据分析。两组间比较采用独立样本t检验,用表示,三组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2、 结果
2.1、 SO2对衰老大鼠血压的影响
连续注射3个月后,与对照组相比,D-半乳糖组大鼠的收缩压、舒张压和平均动脉压较高(P<0.05);给予SO2处理的D-半乳糖+SO2组衰老大鼠与D-半乳糖组大鼠相比,收缩压、舒张压和平均动脉压较低(P<0.05),见表1。
表1 三组大鼠血压的比较
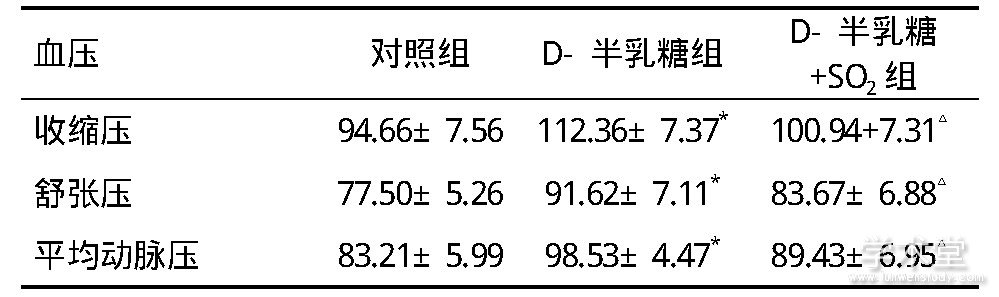
注:与对照组比较, *P<0.05;与D-半乳糖组比较, △P<0.05
2.2 、SO2对衰老大鼠胸主动脉环舒张功能的影响
血管环张力实验表明,D-半乳糖组大鼠胸主动脉环ACh诱导的舒张功能与对照组相比明显受损,最大舒张率显着下降[(65.90±8.90)%与(91.52±6.64)%,P<0.05];给予SO2处理的D-半乳糖+SO2组大鼠胸主动脉环舒张功能与D-半乳糖组相比有了明显改善,最大舒张率明显升高[(84.96±7.79)%与(65.90±8.90)%,P<0.05],见图1。
图1 三组大鼠离体胸主动脉环的血管内皮依赖性舒张功能变化
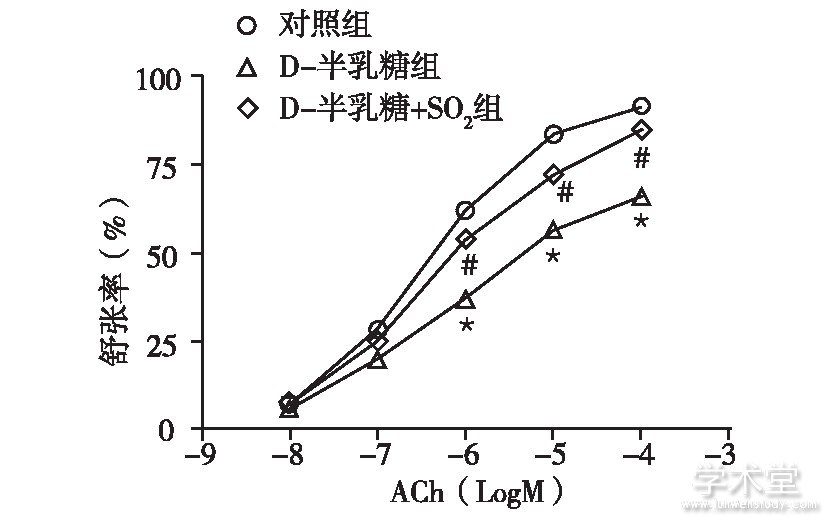
注:与对照组比较, *P<0.05;与D-半乳糖组比较, #P<0.05
2.3、 SO2拮抗D-半乳糖组衰老大鼠的氧化应激损伤
与对照组相比,D-半乳糖组衰老大鼠胸主动脉血管组织中的H2O2水平明显较高(P<0.05);给予SO2处理的D-半乳糖+SO2组与D-半乳糖组相比,衰老大鼠胸主动脉血管组织中的H2O2水平较明显降低(P<0.05),见表2。与对照组相比,D-半乳糖组衰老大鼠胸主动脉血管组织中的MDA水平明显较高(P<0.05);给予SO2处理可以明显降低D-半乳糖+SO2组衰老大鼠胸主动脉血管组织中的MDA水平(P<0.05),见表2。
表2 三组大鼠离体胸主动脉中H2O2及MDA含量比较(nmol/mg蛋白)
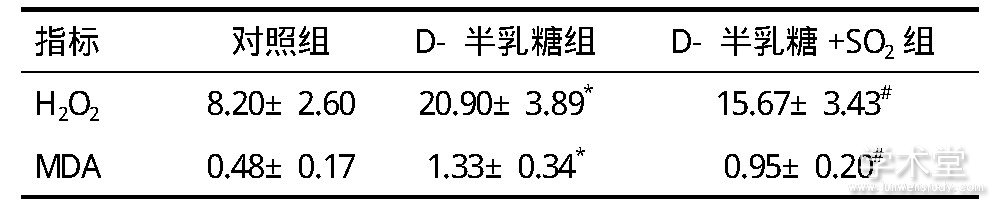
注:与对照组比较, *P<0.05;与D-半乳糖组比较, #P<0.05
2.4、 SO2对衰老大鼠胸主动脉血管组织中抗氧化酶SOD的含量及活性的影响
D-半乳糖组大鼠胸主动脉血管组织中抗氧化酶SOD1的含量与对照组相比没有明显变化,SO2注射也不能改变组织中SOD1的含量,见图2。
图2 三组大鼠离体胸主动脉组织中SOD1蛋白表达的比较
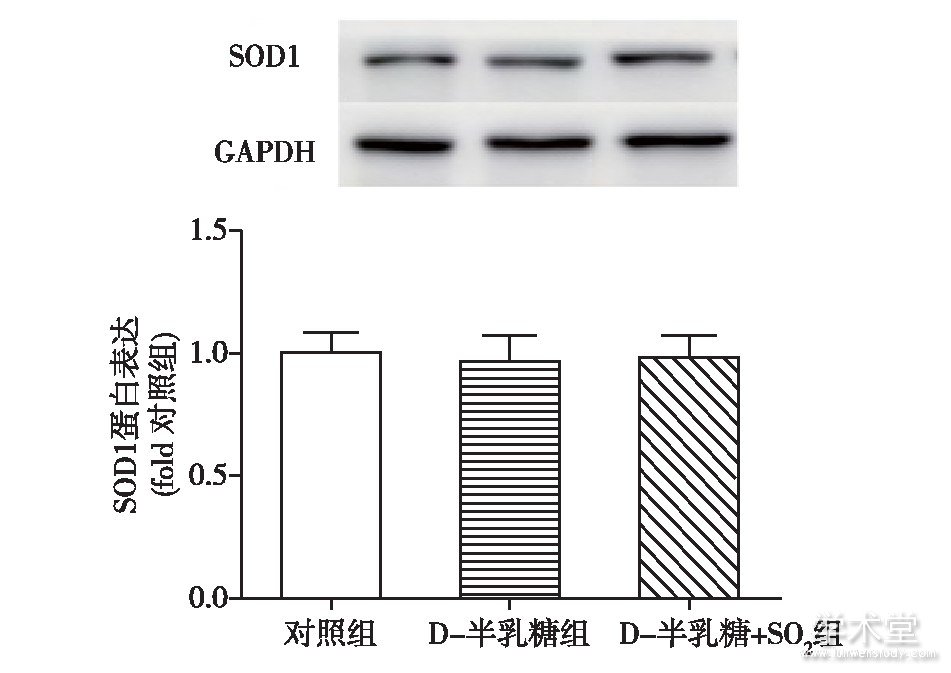
随着H2O2和MDA水平的升高,D-半乳糖组大鼠主动脉胸血管组织中抗氧化酶SOD的活性与对照组相比较低[(19.44±6.14) U/mg蛋白与(29.64±5.30) U/mg蛋白,P<0.05],但与D-半乳糖组相比,SO2注射并不能提高D-半乳糖+SO2组大鼠胸主动脉血管组织中抗氧化酶SOD的活性[(23.69±4.89) U/mg蛋白与(19.44±6.14) U/mg蛋白,P>0.05]。
3、 讨论
衰老是一个复杂且不可逆的过程,由衰老导致的血管结构和功能性改变是心血管疾病的主要危险因素。随着人口老龄化的不断加剧,研究对抗血管老化的干预措施不仅可以改善老年人的健康情况,而且可以通过延缓心血管疾病的相关死亡而延长老年人的寿命。
D-半乳糖是人体内正常存在的还原糖,可被半乳糖氧化酶氧化形成H2O2,导致高水平的氧化应激、炎症和凋亡。D-半乳糖诱导的衰老模型是目前存在的多种衰老模型中最常见的,大量研究表明D-半乳糖诱导的衰老啮齿动物表现出的特征与自然衰老的啮齿动物非常相似[14]。因此,长期注射D-半乳糖已被认为是研究衰老相关疾病(尤其是血管老化)机制的理想模型。在本实验中,连续3个月的D-半乳糖诱导使衰老大鼠产生血管内皮依赖性的舒张损伤,伴随着血压升高,这与之前关于血管老化的研究结果一致。本研究结果表明SO2处理使得衰老大鼠的收缩压、舒张压和平均动脉压都有了明显降低、胸主动脉环最大舒张率也有了明显提高,提示SO2可以减轻D-半乳糖诱导的衰老引起的血管内皮功能障碍。
氧源性自由基增多引起的氧化应激被广泛认为是与衰老相关的重要因素,过量的超氧化物可以损害内皮细胞功能并导致血管老化[15]。在此我们研究了SO2在D-半乳糖诱导的衰老大鼠模型中的抗氧化作用,结果表明,D-半乳糖诱导的衰老大鼠模型中脂质氧化的两种最终产物MDA和H2O2的水平均明显增高,而SO2处理则可以降低MDA和H2O2的水平,减轻D-半乳糖引起的氧化应激损伤。线粒体、内质网及NADPH氧化酶系统是细胞呼吸、代谢和吞噬作用产生ROS的主要部位,NADPH氧化酶生成的O2-可以经SOD转化为H2O2, H2O2再经过过氧化氢酶转化为H2O或在Fe2+存在的情况下转化为羟基自由基[16]。此外,过氧化氢也可以被抗氧化剂如谷胱甘肽过氧化物酶降低。有报道,SO2预处理可以增加心肌缺血再灌注损伤大鼠血浆SOD水平和心肌SOD1蛋白表达[17]。在此,我们也检测了衰老大鼠胸主动脉组织中SOD蛋白的活性及SOD1蛋白的表达情况,试图验证SO2是否是通过上调SOD1的表达或增加其活性来增加了衰老大鼠主动脉的抗氧化能力。本研究结果表明,SO2处理不影响SOD1的蛋白表达及其活性,这意味着SO2对活性氧的抑制可能是通过其他途径进行的,有待进一步研究。
综上所述,本研究发现SO2可以减轻衰老大鼠的血管内皮功能障碍,这可能与抑制氧化应激、减轻氧化应激损伤有关。这些结果为SO2可能成为一种潜在的治疗老年患者血管内皮功能紊乱的药物提供了实验依据,说明SO2具有潜在的临床应用价值。当然,本实验也存在着一些局限性,如SO2抑制活性氧的确切机制还未找到,还有待进一步的实验验证。此外,如果将SO2应用于临床,还要充分考虑其在超生理水平上的毒性作用。
参考文献
[1] North BJ, Sinclair DA.The intersection between aging and cardiovascular disease[J].Circ Res, 2012, 110 (8) :1097-1098
[2] Koldas ZL.What is aging and cardiovascular aging?[J].Turk Kardiyol Dern Ars, 2017, 45 (Suppl 5) :1-4
[3] Sun Z.Aging, arterial stiffness, and hypertension[J].Hypertension, 2015, 65 (2) :252-256
[4] Faconti L, Bruno RM, Ghiadoni L, et al.Ventricular and vascular stiffening in aging and hypertension[J].Curr Hypertens Rev, 2015, 11 (2) :100-109
[5] Ghebre YT, Yakubov E, Wong WT, et al.Vascular Aging:Implications for Cardiovascular Disease and Therapy[J].Transl Med (Sunnyvale) , 2016, 6 (4) :136
[6] Harvey A, Montezano AC, Touyz RM.Vascular biology of ageingImplications in hypertension[J].J Mol Cell Cardiol, 2015, 83:112-121
[7] Siragusa M, Fleming I.The eNOS signalosome and its link to endothelial dysfunction[J].Pflugers Arch, 2016, 468 (7) :1125-1137
[8] Ismaeel A, Brumberg RS, Kirk JS, et al.Oxidative Stress and Arterial Dysfunction in Peripheral Artery Disease[J].Antioxidants (Basel) , 2018, 7 (10) :145
[9] Wang W, Wang B.SO2 Donors and Prodrugs, and Their Possible Applications:A Review[J].Front Chem, 2018, 6:559
[10] Wang XB, Du JB, Cui H.Sulfur dioxide, a double-faced molecule in mammals[J].Life Sci, 2014, 98 (2) :63-67
[11] Zhao X, Jin HF, Tang CS, et al.Effects of sulfur dioxide, on the proliferation and apoptosis of aorta smooth muscle cells in hypertension:experiments with rats[J].Zhonghua Yi Xue Za Zhi, 2008, 88 (18) :1279-1283
[12] Huang Y, Shen Z, Chen Q, et al.Endogenous sulfur dioxide alleviates collagen remodeling via inhibiting TGF-beta/Smad pathway in vascular smooth muscle cells[J].Sci Rep, 2016, 6:19503
[13] Chen Q, Zhang L, Chen S, et al.Downregulated endogenous sulfur dioxide/aspartate aminotransferase pathway is involved in angiotensin II-stimulated cardiomyocyte autophagy and myocardial hypertrophy in mice[J].Int J Cardiol, 2016, 225:392-401
[14] Liao CH, Chen BH, Chiang HS, et al.Optimizing a Male Reproductive Aging Mouse Model by D-Galactose Injection[J].Int J Mol Sci, 2016, 17 (1) :98
[15] Cai H, Harrison DG.Endothelial dysfunction in cardiovascular diseases:the role of oxidant stress[J].Circ Res, 2000, 87 (10) :840-844
[16] Ewald CY.Redox Signaling of NADPH Oxidases Regulates Oxidative Stress Responses, Immunity and Aging[J].Antioxidants (Basel) , 2018, 7 (10) :130
[17] Jin H, Wang Y, Wang X, et al.Sulfur dioxide preconditioning increases antioxidative capacity in rat with myocardial ischemia reperfusion (I/R) injury[J].Nitric Oxide, 2013, 32:56-61





