
单克隆抗体作为治疗药物始于上世纪 80 年代初,因其具有高度的特异性、有效性和安全性的特点,在恶性肿瘤、自身免疫性疾病、感染和器官移植排斥等多种疾病中取得了较好的治疗效果,现已成为推动全球生物产业发展的引擎。截至 2014 年 11 月,已有 50 个抗体类药物上市。2013 年全球销售排名前十位的处方药中有 6 个为抗体类药物,分别是 Humira、Remicade、Mabthera、Enbrel、Avastin 和 Herceptin,单品种销售额均超过 50 亿美元[1].抗体药物的接连上市和重磅销售引发国内外抗体类生物治疗药物的研发热潮。完善的质控标准是抗体类药物批准上市的必要条件,面对抗体类药物的快速发展,迫切需要建立相应的抗体药物质量评价技术体系,而活性测定是对药物的有效成分和含量以及药物效价的测定,是确保抗体类药物有效性的重要质控指标。抗体与其特异的靶点结合后,通过细胞因子信号的阻断、补体系统的活化、细胞杀伤等生物学作用发挥重组抗体的治疗作用,其生物学活性测定主要是在体外建立相应的细胞评价模型,模拟其作用机制,产生客观的全程量效反应,并通过与活性标准品的比较对其生物学活性进行评价[2].近年来,转基因细胞技术和一些新技术也被应用于抗体类药物的生物学活性测定。本文将对应用于抗体药物活性评价的传统方法和前沿技术进行简要介绍,为新型抗体药物活性方法的建立提供新的思路。
1 基于细胞的生物活性测定方法
随着药物高通量筛选平台的建立和生产规模的扩大,以及对 3R( Reduction,Refinement,Replacement) 原则理解的不断深化,人们越来越多地寻求动物实验替代方法。而基于细胞系的体外生物活性分析方法由于其高通量、高效率、高精确度等优势,越来越受到研究者和生产企业的青睐。单克隆抗体药物的作用靶点分为细胞因子及其受体、肿瘤细胞表面抗原、CD 分子、病原微生物及其产物、以及其他靶点,根据抗体药物作用的特点,目前主要有以下几类基于细胞的测活方法。
1. 1 细胞增殖抑制法
针对生长因子靶点的抗体药物多是采用细胞增殖抑制的方法来反映抗体的生物学活性,包括抗血管内皮生长因子( vascular endothelial growth factor,VEGF)单抗、抗人表皮生长因子受体2( human epidermal growthfactor receptor 2,HER2) 单抗及抗人表皮生长因子受体( epidermal growth factor receptor,EGFR 或 HER1) 单抗等。其中抗 VEGF 单抗的经典测活方法是人脐静脉内皮细胞( human umbilical vein endothelial cell,HUVEC)增殖抑制法,即在刺激因子 VEGF 存在的情况下,抗VEGF 单抗能够以剂量依赖性的方式抑制 HUVEC 细胞的增殖。抗 HER2 单抗[3]的活性测定通常选取 HER2阳性的乳腺癌细胞,如 BT474、SK-BR-3、SKOV3 等作为靶细胞,抗体与靶细胞表面 HER2 抗原结合后,能够有效抑制细胞生长信号传递,从而抑制细胞增殖。抗EGFR 靶点单抗[4]也是通过特异结合并封闭表皮生长因子受体,有效抑制肿瘤细胞生长,如 DiFi 细胞、A431细胞增殖抑制法等。
1. 2 细胞毒性法
细胞凋亡有两条途径,一是线粒体依赖途径,另一个为死亡受体介导途径。肿瘤坏死因子-α ( tumornecrosis factor-alpha,TNF-α) 和受体结合后,可启动死亡受体介导途径,使 procaspe-8 自我水解、活化,形成活性caspase-8,后者再激活 caspase3、6、7 等,引起下面的级联反应,导致细胞发生凋亡[5].重组人 II 型肿瘤坏死因子受体-抗体融合蛋白的活性测定可以利用其能够抑制 TNF-α 所引起的敏感细胞系 U-937 中 caspase 3/7 活化,通过 Caspase-Glo 3/7 检测试剂盒中萤光素酶发光信号的改变来反映该制品的活性。此外,针对 TNF-α的单抗还可以采用对 TNF-α 杀伤敏感的细胞系,如小鼠成纤维细胞 L929、小鼠纤维肉瘤细胞 WEHI164 等,抗体能够抑制 TNF-α 所诱导的细胞凋亡作用,通过检测细胞存活的染色来评价抗体的生物学活性。在细胞存活相关染料的选择上,包括结晶紫、MTT、MTS、CCK-8等在内的染料具有各自的优缺点。结晶紫是一种三苯甲烷类染料,常用作生物染色剂和无机离子的显色剂。
其染色过程虽然相对简单,但是不能区分死活细胞,只能反映细胞数量。而 MTT 作为线粒体脱氢酶的作用底物,被活细胞还原成水不溶性的橙黄色甲臜产物并沉积在细胞中,而死细胞无此功能,因此可间接反映活细胞数量,但 MTT 还原产物不溶于水,需被溶解后才能检测。MTS 还原产物是水溶性的甲臜,无需洗涤和溶解步骤,使用更方便,重复性优于 MTT.而 CCK-8 溶液可以直接加入到细胞样品中,溶液相当稳定,对细胞没有毒性,可长时间孵育,是用于测定细胞毒性或细胞增殖试验中活细胞数目的一种简便快速、灵敏度高、重复性好的染料。
1. 3 补体依赖的细胞毒法 ( complement dependentcytotoxicity,CDC)
单抗药物与靶细胞表面分子结合后,可介导补体C1q 结合到抗体的 Fc 段,并于肿瘤细胞膜上形成类似于穿孔素效应的攻膜复合体( membrane attack complex,MAC) ,造成细胞外离子大量内流,最终导致肿瘤细胞的溶解。CDC 生物学活性测定中一个的关键环节是补体的选择及对其质量的控制,补体组分多,且热不稳定,容易失活,目前所用的补体来源包括正常人血清、豚鼠、家兔等,来源复杂、剂型不同,因此在 CDC 实验中需要考虑补体效力、稳定性,尽量减少活性测定反应终点和测定结果的变异。以 CD( cluster of differentiation)分子为靶点的单抗药物,如抗 CD20 单抗[6]、抗 CD52单抗等,其生物学活性评价方法主要为 CDC 活性测定,即将重组抗体进行系列稀释后与高表达相应 CD 抗原的靶细胞结合,在补体存在的情况下,抗体与细胞表面抗原形成抗原抗体复合物,激活补体经典活化途径,完成攻膜复合物的装配并在细胞表面打孔,最终导致细胞溶解。利用上述检测细胞存活的染料可以对抗体的CDC 作用效果进行评价。
1. 4 抗体依赖性细胞介导的细胞毒性法 ( antibody-dependent cell-mediated cytotoxicity,ADCC)
单抗药物通过 Fc 段介导的免疫效应除了 CDC 作用外,另外一个重要的效应即是抗体依赖性细胞介导的细胞毒作用( ADCC) .传统的 ADCC 检测方法多为基于新鲜制备的外周血单个核细胞( peripheral bloodmononuclear cell,PBMC ) 或者自然杀伤细胞 ( naturalkiller,NK) 作为效应细胞的杀伤试验,以上方法存在细胞分离和培养困难、变异大、操作繁琐、高背景值等缺陷[7].研究表明,在 NK 细胞中 Fc 受体( FcR) 活化,尤其是 FcRγIIIa 受 体 ( CD16 ) 活 化 能 够 引 起 NFAT( nuclear factor of activated T-cells) 信号通路的激活。近年来基于报告基因法已建立了稳定而可靠的抗 CD20单抗的转基因细胞 ADCC 评价方法。该方法以 WIL2-S细胞系( 人 B 淋巴细胞) 作为靶细胞,使用工程改造的Jurkat 细胞作为效应细胞,该细胞稳定表达了 FcγRIIIa受体和由 NFAT 应答元件驱动表达的荧光素酶报告基因。当高表达 CD20 抗原的靶细胞与表达 FcγRIIIa 受体的 Jurkat 细胞通过抗 CD20 单抗桥联时,可引起NFAT 荧光素酶报告基因的活化,通过检测荧光素酶化学发光信号来反映抗体的 ADCC 效应[8].该方法操作简便易行,专属性强、重复性好、准确性高,可作为抗CD20 单抗 ADCC 生物学活性的常规检查方法,用于评价包括人鼠嵌合单抗、人源化单抗、全人源单抗和糖基化改造单抗在内的各类抗 CD20 单抗的 ADCC 活性; 更重要的是该方法可用于评价糖基化修饰与抗 CD20 单抗功能的关系,这也为该类制品工艺稳定性评价及结构与功能关系研究奠定基础。
1. 5 细胞 ELISA 法
除了检测抗体对细胞的增殖和毒性作用外,还可以通过 ELISA 法[9]测定靶细胞与抗体及刺激因子共培养后分泌的细胞因子来评价抗体的生物学活性。例如抗 IL-17 单抗可以根据其抑制 IL-17 诱导靶细胞释放IL-6 或 GROα 等细胞因子的能力来评价其生物学活性。将 IL-17 和 IL-17 单抗以及靶细胞接种到 96 孔板上,培养过夜。再通过 ELISA 法定量测定细胞上清液中分泌的细胞因子的含量,细胞因子的含量与抗体活性成反比。
2 转基因细胞生物活性测定方法
由于很多生物技术药物没有强反应性的细胞系,或者没有易检测的细胞学效应,构建转基因细胞株成了很好的选择。构建药物反应性转基因细胞株是依据药物的作用机制来制定方案的。首先应该全面深入地研究药物的作用机制,包括受体激活、信号转导、信号传递以及终效应,选择合适的靶标作为药物活性测定的指标。目前国内在建立转基因细胞法测定生物治疗药物生物学活性领域已走在世界的前列。中国食品药品检定研究院通过多年的技术储备,通过体外模拟创新药作用的信号转导机制,以“导入药物作用受体、报告基因或效应分子”为策略,率先构建了简便、快速、准确、非生物安全、动物替代的系列转基因活性评价模型,其中干扰素测活的荧光素酶报告基因法,克服了国际通用的病毒抑制法中由操作活病毒导致的缺点,并使检测周期缩短至原来的 1/3[10]; 脑利钠肽测活的第二信使 cGMP 竞争检测法,与传统的家兔主动脉条法相比,变异系数由 66% 降至 13%[11]; 促红细胞生成素的荧光素酶报告基因法无需复杂的动物实验并可获得与传统体内红细胞计数法高度一致的评价结果[12].系列研究成果实现了“转基因细胞”理念用于解决一类新药测活和传统测活方法改进的突破,为保证用药的安全性和时效性,提高检验质量提供了保障。
目前国际上已有多个靶点的单克隆抗体药物应用报告基因法进行生物学活性测定[13].例如,血管内皮生长因子抑制剂( VEGF Trap) 的活性测定方法是在HEK293 细胞中稳定转染 NFκB 荧光素酶报告基因质粒和 2 个嵌合受体基因。这 2 个嵌合受体是将 VEGF受体 1 ( VEGFR1) 胞外区分别与 IL-18 受体 α ( IL-18Rα) 和 IL-18 受体 β ( IL-18Rβ) 胞内区融合而成。
VEGF 与 VEGFR1 结合后发生二聚化,使得 IL-18Rα 和IL-18Rβ 胞内结构域相互作用,并传递信号,引起 NFκB荧光素酶报告基因活化; 而 VEGF Trap 能够抑制 VEGF所引起 NFκB 通路的激活[14-15].针对 PD-1 靶点的抗体是国内外新抗体研发的热点,PD-1 表达于活化的 T 细胞,当与配体 PD-L1 和 PD-L2 结合后,可抑制 T 细胞的增殖以及相关细胞因子的产生[16].目前抗 PD-1 单抗大多采用竞争 ELISA 法来评价其结合活性,各研发单位也在积极探索稳定而可靠的抗 PD-1 单抗细胞生物学活性评价新方法。例如利用稳定转染 NFAT 报告基因/PD-1 的 Jurkat 细胞作为效应细胞,高表达 PD-L1 的CHO 或 HEK293 转基因细胞系作为靶细胞。通过微孔板包被的抗 CD3 抗体充分激活 Jurkat 后,将系列梯度稀释的 PD-1 或 PD-L1 单抗与两株细胞系经过一定时间的孵育后,通过荧光素酶检测系统来评价抗 PD-1 或PD-L1 单抗的生物学活性。此外另一个免疫调节类的热点抗体是针对 T 细胞表面的细胞毒性 T 淋巴细胞抗原 4( Cytotoxic T-Lymphocyte Antigen 4,CTLA4) 的抗体,它能够阻止 CTLA-4 与其配体 ( B7. 1/CD80,B7. 2/CD86) 结合,从而恢复 CD28-B7 共刺激信号通路的信号传导[14].针对 CTLA-4 单抗的生物学活性测定可以基于稳定转染 IL-2 启动子报告基因的 Jurkat 细胞,在Daudi B 细胞和抗 CD3 抗体的共同刺激下,抗 CTLA-4单抗能够激活 Jurkat 细胞中 IL-2 信号通路,启动荧光素酶表达,通过荧光素酶检测系统进行该抗体生物学活性评价。
3 基于新技术的生物学活性测定方法
3. 1 表面等离子共振( Surface Plasmon Resonance,SPR) 效价测定法
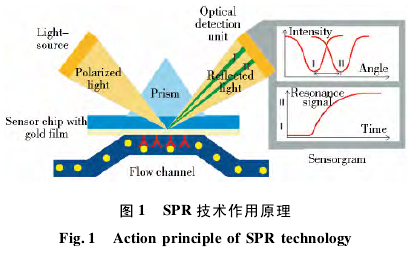
表面等离子共振现象是发生在两种折射率不同的介质界面上的一种光学现象,最早于 1902 年由 Wood发现,并由 Otto 和 Kretschmann 等在 1968 年对其原理进行了详尽的阐述。简单而言,当光源的一束入射光从高折射率介质( 如玻璃) 射向低折射率介质( 如溶液)的界面时,如果入射角大于一定的临界角,入射光将会被 100% 地反射至光源的同一侧,这叫做全内反射现象。当两种介质之间有一层极薄的金属膜( 最为常见的 50nm 金膜) ,这时入射光的能量将会引起金膜中等离子体的共振并以一种电磁场( 称作消逝波) 的方式弥散至低折射率介质一侧( 如溶液) ,从而导致反射光的能量在某个特定的角度降至最低( 图1) ,这一角度被称作 SPR dip 角。表面等离子共振作为一种生物传感器技术广泛地应用于分子相互作用分析领域,当分子间发生结合或者解离时,会定量改变金膜表面附近分子的浓度,从而导致金膜附近折射率的变化,进而导致SPR dip 角的改变,通过实时监测 SPR dip 角度的变化,就可以实时分析分子间的结合与解离过程。该技术无需预先标记荧光、二抗的分子,避免了标记基团对分子构象的影响,从而反映出分子间真实的结合性质; 该技术样品消耗量低,一般仅有微克级; 除了获取一般的亲和力信息外,还能够给出对阐述分子间结合机理更为宝贵的动力学信息。SPR 技术已广泛应用于小分子制药和生物制药领域[17-18],在抗体分析领域,其应用主要包括: ( 1) 抗体候选物的筛选与评价,如从杂交瘤上清液中筛选出解离速率最慢的抗体分子; ( 2) 抗体与抗原结合活性的分析,如人源化叶酸受体 α 单抗与重组人叶酸受体 α 的动力学与亲和力[19]; ( 3) 抗体与受体结。合活性的分析,如抗体与 FcγRIIIa,FcγR IIIb 等受体结合的亲和力、动力学信息; ( 4) 抗体活性浓度分析,包括基于标准品的活性成分浓度分析和无需依赖标准品的活性成分浓度分析方法; ( 5) 安全性评价中的免疫原性分析; ( 6) 生物类似药一致性分析。
3. 2 均 相 时 间 分 辨 荧 光 ( Homogeneous Time-Resolved Fluorescence,HTRF)
均相时间分辨荧光是用来检测纯液相体系中待测物的一种常用方法,也是用来研究药物靶标的理想平台[20].该技术结合了荧光共振能量转移( FluorescenceResonance Energy Transfer,FRET) 和时间分辨荧光( Time-Resolved Fluorescence,TRF ) 两种技术。这种结合 将FRET 的均相实验方式和 TRF 的低背景特点融合在一起,使得 HTRF 技术拥有操作简单、灵敏度高、通量大、实验数据稳定可靠、假阳性率较低的优势。在 HTRF 实验中,当供体和受体相离很近时,在供体和受体之间会有荧光共振能量转移而产生信号。采用双波长检测能够显着减小缓冲液和培养基的干扰,最终的信号与产物形成的量成比例。HTRF 技术进入药物研发领域以来,加快了很多基于抗体的研究,HTRF 技术也可以取代大部分ELISA,因为 HTRF 具有同等的检测范围和检测极限,而且更节省实验时间,并且不需要洗板的步骤,所以该技术近年来已被应用于抗体的活性检测。例如,抗肝细胞生长因子( hepatocyte growth factor,HGF) 单抗的结合活性测定就是一种竞争性抑制受体-配体结合的效价测定。
通过镧系元素螯合物均相时间分辨荧光法( LANCEHTRF) 测定抗 HGF 单抗与 HGF 结合,并阻止 HGF 结合至其受体的能力。在测定中,将铕标记的 HGF 受体( hu-HGFR-Eu) 结合至生物素标记的 HGF( biotin-huHGF) ,后者结合至链霉亲和素-别藻蓝蛋白( SA-APC) .该结合诱导铕和 APC 分子接近,而使荧光发生共振能量转移,通过具有检测 HTRF 功能的酶标仪进行检测。抗 HGF 单抗能够抑制biotin-huHGF 结合至hu-HGFR-Eu,并阻止能量转移,因此降低了荧光信号输出,即抗体的量与产生的荧光量呈负相关。
3. 3 Alpha 技术 ( Amplified Luminescent ProximityHomogeneous Assay)
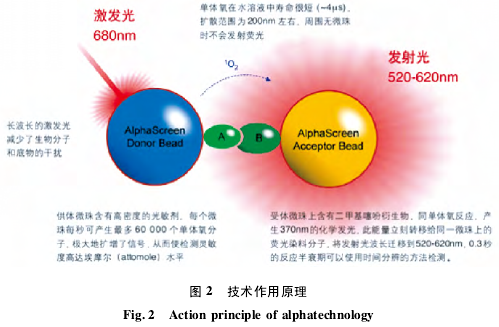
该技术既可用于检测细胞内各个 Biomarker,也可进行各类分子相互作用研究[21],简单可靠。近年来,Alpha 技术也应用于抗体的活性检测,该技术主要含有两种微珠,一种为供体,另一为受体。当供体微珠所带有的抗原分子( A) 与受体微珠所带有的抗体分子( B)距离非常接近时,可以使用 680nm 激发光去引发其表面所带有的光敏感物质,使其催化周围的氧分子形成活化态,产生效率可达每秒 60 000 个氧分子活化态产生,借此将讯号放大,此活化态氧分子再与邻近的受体微珠上的二甲基噻吩化合物产生化学冷光反应,产生冷光效应( 波长大约 370nm) ,此冷光进一步借由能量转换激发让受体微珠产生 520 ~ 620nm 的发散光荧光信号,由于氧分子活化态非常不稳定,此反应相当快速仅 4μs,加上若此二种微珠距离超过 200nm,反应随之下降,所以只有抗原抗体分子结合才能触发反应,通过测定荧光量来反映抗体的活性( 图 2)
3. 4 荧光染料标记法
荧光染料标记法具有灵敏度高、选择性高、方法简便快捷、样品用量少等优点,已经广泛地应用于生物、化学、医药、卫生、农业、环境保护等领域中。应用在抗体活性检测中,荧光染料可以标记分子或细胞。( 1) 荧光染料标记细胞: 荧光染料作为荧光检测分析方法的载体,其性能的优劣直接决定了检测方法的可行性及灵敏性。Calcein-AM( 钙黄绿素-AM) 是一种可对活细胞进行荧光标记的细胞染色试剂,Calcein-AM 由于在Calcein( 钙黄绿素) 的基础上加强了疏水性,因此能够轻易穿透活细胞膜。当其进入到细胞质后,酯酶会将其水解为 Calcein( 钙黄绿素) 留在细胞内,发出强绿色荧光。与其它同类试剂 ( 如 BCECF-AM 和 Carboxy-fluorescein diacetate) 相比,Calcein-AM 是最适合作为荧光探针去标记活细胞的,因为它的细胞毒性很低。
Calcein( 钙黄绿素) 不会抑制任何的细胞功能,如增殖或趋化性等。( 2) 荧光染料标记分子: BODIPY( 氟化硼二吡咯) 类荧光染料作为一类新型的荧光染料,因其良好的光物理性质,在过去的二十年内得到广泛的研究。
与其它的荧光染料相比,BODIPY 类荧光染料具有较窄的吸收和发射峰、较高的摩尔吸光系数、较高的光稳定性和化学稳定性以及较高的荧光量子产率等。例如,抗 PCSK9 单抗的的生物活性测定即是用 BODIPY 标记的低密度脂蛋白( LDL) 通过 HepG2 细胞来测定其生物活性。PCSK9 是前蛋白转化酶枯草溶菌素 9,能与低密度脂蛋白受体( LDLR) 直接结合,促使 LDLR 内化和降解。降低肝细胞上 LDLR 的数量能够降低肝脏从循环中清除 LDL 的能力。抗 PCSK9 抗体能够与 PCSK9 结合,阻滞 PCSK9 与 LDLR 结合,增加 LDLR 数目,从而增加 HepG2 细胞中 BODIPY 标记的 LDL 荧光量。
4 生物学试验的统计学分析
在生物活性的定量测定中,一般有两种反应类型,一种是直线性反应,另一种是曲线性反应。关于选择何种拟合模型和统计学分析软件更合适的问题,主要从反应的实际曲线、拟合优度和简便性三个方面考虑[22].目 前 美 国 药 典 ( United States Pharmacopeia,USP) 、欧洲药典( European Pharmacopeia,EP) 等比较常用的 统 计 学 分 析 软 件 包 括 UNISTAT、CombiStats、StatLIA、PLA、4-Parameter 等。PLA 2. 0 是一个不受硬件约束的,商业化的生物学分析软件。它是 Stegmannsystem 的主要产品,目前有 200 余家公司在 GMP 环境下使用该软件。该软件基于欧洲药典 5. 3 版、美国药典和其他科学出版物。StatLIA Quantum 统计软件在使用规模,数据储存,可使用范围,统计分析,人性化报告上具有很好的优势,可用于活性检测、定量检验、免疫原性质量筛选等方面。CombiStat 软件是由 EDQM( European Directorate for the Quality of Medicines &HealthCare) 研发,包括平行线分析、四参数和五参数、slope ratio model、probit model 等,在欧洲应用广泛。我国研发单位对于生物学活性的评价应用四参数( 4-Parameter) 模型拟合的较多,其数据呈典型的 S 型曲线,可反映出上下渐近线、EC50 值和斜率等指标。
USP、EP 等国外药典都强调生物统计在生物学试验中的应用及其重要性,尤其是在数据类型和分析模式、数据采集、稳定性试验和离散度的选择方面对于生物学试验的设计和发展至关重要。然而统计学分析手段在2010 年版《中国药典》三部治疗性生物制品活性测定中的应用是总体基本缺失的,这个问题在未来应充分重视。
5 结 语
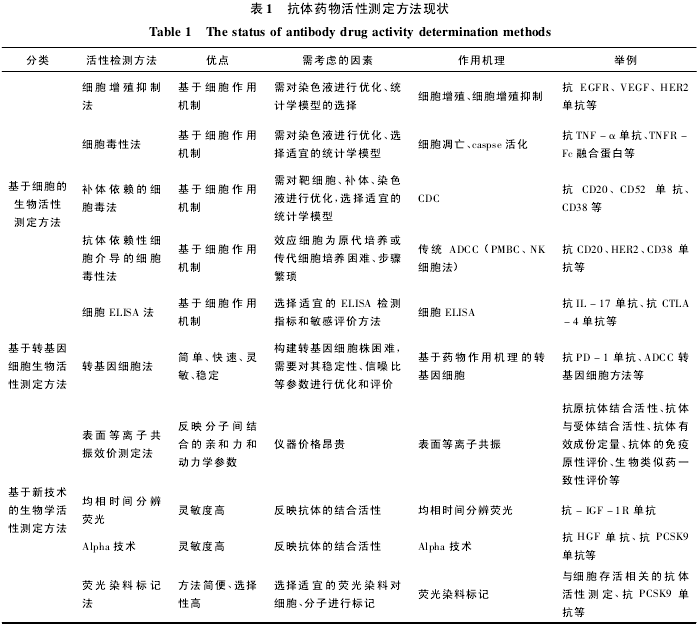
分子生物学的快速发展和细胞信号通路的深入研究促进了基于细胞的生物活性测定方法的发展,而转基因细胞法特别是报告基因法的建立能更加快速、灵敏地反映抗体的生物学活性。越来越多的新型技术用于单抗药物的活性检测,可以实现对抗体药物进行精准、多方位、动态的分析,为抗体药物的质量提供了新的保障。本文对应用于抗体药物活性评价的传统方法和前沿技术进行了简要介绍( 表1) ,对国内抗体药物研发企业在质量控制尤其是活性测定方面具有重要的指导作用和参考价值。
药品的质量源于设计,而非靠检测即可保证( ICHQ8) ,这一国际公认的药品质量控制理念已逐渐被研发主体、药品监管机构接受,即药品质量应该在基于对药物分子生物学特性、作用机制全面了解的前提下,设计开发相应的生产工艺以求药物分子达到其预期的质量属性[23].对于抗体药物的效价评价,在临床情况下,采用反映产品生物学活性的生物测定是较好的方式,但在批放行中未必是可行的。对于利用动物实验或原代细胞等操作复杂、变异性大的传统活性测定方法,在充分了解产品特性和作用机制的情况下,基于新技术和新思路,开发稳定而可靠的活性替代方法用于放行中是可行的,其前提是研发主体要充分了解生产工艺、产品的质量属性( 包括生物学活性等) 以及药效学的关系,开展传统方法与新方法的比较和验证研究,以求切实可行的确保产品有效、质量可控。
参考文献
[1]王兰,朱磊,高凯,等。 单克隆抗体生物治疗药物研究进展。 中国药学杂志,2014,49( 23) : 2058-2064.Wang L,Zhu L,Gao K,et al. Progress of research anddevelopment of antibody-based therapeutics. Chin Pharm J,2014,49( 23) : 2058-2064.
[2]高凯,陶磊,王军志,等。 重组抗体药物的质量控制。 中国新药杂志,2011,20( 19) : 1848-1855.Gao K,Tao L,Wang J Z,et al. Quality control for recombinanttherapeutic antibodies. Chinese Journal of New Drugs,2011,20( 19) : 1848-1855.
[3]钱卫珠,侯盛,李博华,等。 抗 HER2 人源化单克隆抗体体内外抗肿瘤活性评价方法的建立。 第二军医大学学报,2005,26( 5) : 484-487.





