
昆虫免疫主要是以产生的抗菌肽、抗病毒因子、凝集素、溶菌酶及蛋白酶抑制剂等多种活性物质,配合多种功能的血细胞建立的一个开放防御体系.昆虫仅具有先天性免疫,不具有适应性免疫.昆虫的先天免疫系统主要分为细胞免疫和体液免疫2大部分.体液免疫中转录因子Rel/ NF-κB介导的信号转导通路主要有Toll通路和Imd通路[1],昆虫主要通过这2种通路抵抗微生物的侵染.
研究发现,这2种通路通过激活不同的Rel/ NF-κB家族成员调控不同抗菌肽基因的表达,其中Toll通路主要激活转录因子Dorsal和Dif,Imd通路主要激活转录因子Relish[1-5].已知的Rel/ NF-κB蛋白家族成员有8种,哺乳动物中有5种,昆虫细胞中的3种分别是Dorsal、Dif和Relish.其中Dorsal和Dif无锚定重复序列,Relish有锚定重复序列. Rel/ NF-κB蛋白的主要功能是调节机体免疫应答、炎症反应、细胞凋亡和生长发育,炎症、癌症、自身免疫疾病等病理过程与NF-κB的过度活化相关[6].
由于Rel/ NF-κB介导的Toll通路与Imd通路在无脊椎动物和脊椎动物中非常保守[1,7],因此,对昆虫Rel/ NF-κB的研究不仅能够系统了解昆虫的先天免疫机制,而且可为深入了解高等动物的免疫机制及疾病防治提供重要依据.尽管Rel/ NF-κB蛋白在先天免疫过程中起着非常重要的作用,但目前为止尚未见到有关柞蚕Rel/ NF-κB家族成员的报道.本项研究利用生物信息学方法和分子生物学技术,以柞蚕蛹为试验材料,克隆柞蚕免疫相关基因Apdorsal的全长cDNA序列,并将其编码的氨基酸序列与其它物种的Rel/ NF-κB氨基酸序列进行比对及构建系统进化树,利用实时荧光定量PCR技术检测Apdorsal基因经不同微生物诱导处理后的组织表达变化,为探讨柞蚕的先天免疫机制提供参考.
1材料与方法
1.1材料和主要试剂
供试柞蚕品种为青6号,柞蚕蛹由辽宁省蚕业科学研究所惠赠,4 ℃条件下保存备用.大肠杆菌(E.coli)Top10、枯草芽孢杆菌(Bacillus subtilis)、毕赤酵母(Pichia pastoris)、柞蚕核 型 多 角 体 病 毒(ApNPV)等微生物由本实验室保存.Trizol试剂,Reverse Transcriptase M-MLV试剂盒,ExTaq酶,凝胶回收试剂盒,pMD18-T载体,T4-DNA连接酶,限制性内切酶EcoRⅠ和HindⅢ,RLM-RACE试 剂 盒, SYBR-PrimeScript-RT-PCR Kit(Perfect Real Time),均购自宝生物工程(大连)有限公司.
1. 2柞蚕蛹总RNA提取及目的基因的RT-PCR扩增
取20 μL培养过夜的E.coliTop10,注射到柞蚕蛹体内,12 h后解剖取脂肪体组织,用Trizol试剂提取柞蚕蛹脂肪体总RNA,然后按照Reverse Tran-scriptase M-MLV试剂盒说明书将提取的总RNA反转录成cDNA.
根据GeneBank登录的烟草天蛾Dorsal(登录号:ADK39025)、家蚕Rel(登录号:NP_001036896)和冈比亚按蚊Rel(登录号:XP_310177)的cDNA序列设计简并引物F(5′-TGCGARGGMCGSTCGG-3′)、R[(5′-CATKGCCTTCTTRTCG(T/ A) AGATG-3′)].简并引物F/ R进行cDNA片段扩增,反应条件如下:94 ℃预变性5 min;94 ℃变性3 s,55 ℃退火30s,72 ℃延伸30 s,35个循环;72 ℃终延伸7 min.PCR产物经电泳检测后纯化回收,连接到pMD18-T载体,转化E.coliTop10感受态细胞,通过酶切鉴定筛选阳性克隆,送至宝生物工程(大连)有限公司进行测序分析.
1. 3目的基因的RLM-RACE扩增
根据"1. 2"中扩增得到的cDNA序列设计RACE扩增特异引物:Dor-5′RACE outer primer(5′-CCAGGTTGTGCGAGTGAGGC-3′),Dor-5′RACE innerprimer(5′-ATTGTAGGGTAGGTGCGGTTCTCG-3′),Dor-3′RACE outer primer(5′-CTCGGCATCCAGTGCGTCAA-3′),Dor-3′RACE inner primer(5′-GGAATCACCCGC-AGAGCATC-3′). 5′-RACE和3′-RACE扩增分别按照RLM-RACE试剂盒说明书进行,PCR扩增产物经琼脂糖凝胶电泳、纯化回收后连接到pMD18-T载体,转化E.coliTop10感受态细胞,通过酶切鉴定筛选阳性克隆,送至宝生物工程(大连)有限公司进行测序.
1.4目的基因的序列分析
测序结果用GenBank的BLAST比对,并用在线软件Expasy进行蛋白质分子质量和等电点分析.获得的柞蚕Dorsal基因用在线软件BLASTW进行氨基酸序列同源性比对,并用MEGA5. 0软件构建系统进化树.
1. 5不同微生物对柞蚕蛹的诱导处理及各组织总RNA提取
取30只健康柞蚕蛹随机分为5组,每组6只,雌雄各3只.第1组为空白对照;第2组注射50 μLE.coliTop10[D(600 nm)= 1. 2,用无菌水稀释 10倍];第3组注射50 μL枯草芽孢杆菌[D(600 nm)=1. 2,用无菌水稀释10倍];第4组注射50 μL毕赤酵母[D(600 nm)= 1. 2,用无菌水稀释 10 倍];第 5组注射50 μL ApNPV(2×106mL-1病毒悬液,用无菌水稀释10倍).用一次性无菌注射器从柞蚕蛹第1腹节处注射,常温孵育24 h后,分别取柞蚕蛹的表皮、生殖腺、脂肪体、血淋巴、头部、气管6个组织器官,加液氮研磨成粉后,用Trizol试剂提取总RNA,然后按照Reverse Transcriptase M-MLV说明书将提取的总RNA反转录成cDNA.
1. 6目的基因表达的实时荧光定量PCR检测
1. 6. 1引物设计 根据获得的柞蚕Dorsal基因序列设计real-time PCR引物: QTF-ApdorsalA(5′-AG-GATCATTTACGCTGGAGGTACG-3′), QTR-ApdorsalA(5′-CTTCTCAGTTTCAACAGGTGTCCG-3′);QTF-Ap-dorsalB ( 5′-TGCGCGAGTGTCAGTGTAGTTTGA-3′),QTR-ApdorsalB(5′-CGCAGTGTTCGCTTCCAAGAA-TCA-3′).以组成型表达的柞蚕β-actin基因作为内参,引物为:A3F(5′-ACCAACTGGGACGACATGGA-GAAA-3′),A3R(5′-TCTCTCTGTTGGCCTTTGGGT-TGA-3′).
1. 6. 2实时荧光定量PCR 实时荧光定量PCR反应采用荧光染料SYBR Green(R)Ⅰ在Rotor Gene3000-6实时荧光定量基因扩增仪(上海天呈科技有限公司)上进行.按照SYBR-PrimeScript-RT-PCRKit说明书配制25 μL反应体系:cDNA模板2 μL,2×SYBR Premix ExTaq酶12. 5 μL,10 μmol/ L正向引物0. 5 μL,10 μmol/ L反向引物0. 5 μL,RNaseFree dH2O 9. 5 μL. PCR反应条件: 95 ℃预变性30s,30个循环(95 ℃变性3~5 s,60 ℃退火/延伸20s).
反应结束后,20 min缓慢升温绘制熔解曲线,利用Botor Gene 6软件的2-ΔΔCt方法[8]对目标基因的表达水平进行分析.
2 结果与分析
2.1 Apdorsal基因的获得与序列特征
利用RLM-RACE扩增从柞蚕蛹脂肪体中克隆得到了2个Apdorsal基因的cDNA序列,分别命名为ApdorsalA和ApdorsalB (登 录 号: JF488068、JF488069).其中,ApdorsalA的cDNA全长1 872bp,有一个1 158 bp的开放阅读框(266~1 423 nt),编码386个氨基酸,该cDNA还包括265 bp的5′端非编码区和449 bp的3′端非编码区;ApdorsalB的cDNA全长1 860 bp,有一个1 008 bp的开放阅读框(404~1 411 nt),编码336个氨基酸,该cDNA还包括403 bp的5′端非编码区和449 bp的3′端非编码区.
推导的氨基酸序列中都包含Rel/ NF-κB蛋白家族的特征区RHD,但是3′端没有Dorsal蛋白通常所具有的TD转录激活区(图1).
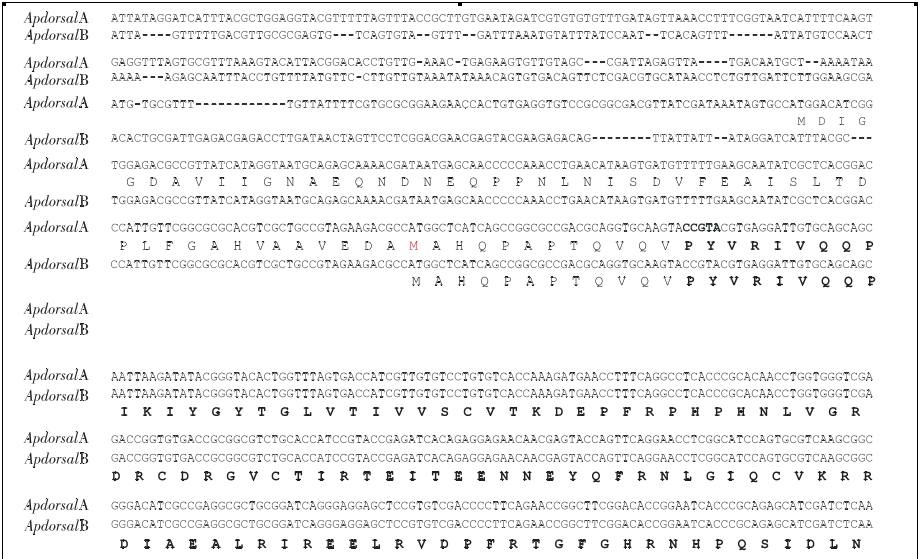

将ApdorsalA蛋白与其它物种的Rel/ NF-κB家族蛋白进行全长氨基酸序列比对,结果显示柞蚕ApdorsalA蛋白与Dorsal、Dif、P65都属于无锚定重复 序 列 的 一 类 蛋 白, ApdorsalA与 烟 草 天 蛾MsDorsal、家蚕BmRelA、冈比亚按蚊Gambif、皱纹盘鲍AbRel、人Hsp65、褐家鼠Rnp65、果蝇DmDif、家蚕BmReish1和果蝇DmRelish的序列相似度分别为78%、70%、56%、48%、45%、45%、41%、32%、34%.
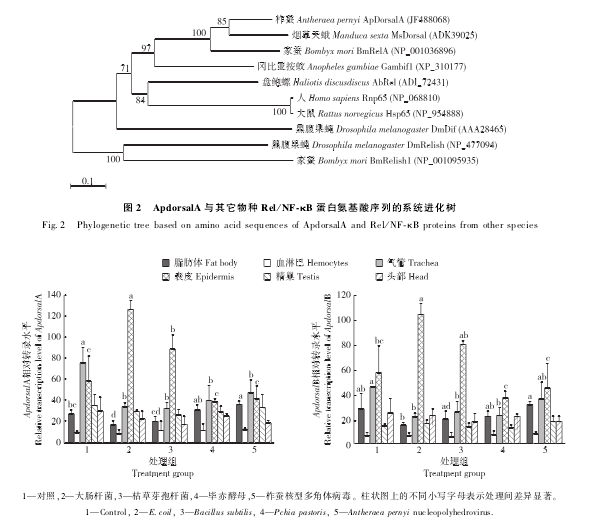
应用MEGA5. 0软件构建柞蚕ApdorsalA蛋白与其它物种Rel/ NF-κB蛋白的系统进化树,结果显示ApdorsalA蛋白与烟草天蛾Msdorsal、家蚕BmRelA蛋白有较近的亲缘关系(图2).
2.2 Apdorsal基因mRNA组织分布及不同微生物诱导的表达变化
为了进一步了解Apdorsal基因在柞蚕不同组织中的表达情况及Apdorsal是否参与了对不同微生物的免疫应答反应,利用real-time PCR技术以柞蚕β-actin基因为内参检测各种组织中ApdorsalA和ApdorsalB基因mRNA的转录情况.结果表明2个Apdorsal基因mRNA在柞蚕蛹各组织中都有转录,在表皮和气管中的转录水平最高,在脂肪体和头部中的转录水平次之,在血淋巴中的转录水平较低.柞蚕蛹脂肪体中的Apdorsal基因mRNA经ApNPV诱导处理后的转录水平最高,经毕赤酵母和枯草芽孢杆菌诱导处理后的转录水平次之,经E.coli诱导处理后的转录水平最低(图3).
3 讨论
本实验克隆得到了2个编码柞蚕Dorsal蛋白的cDNA序列,二者的5′端部分序列不同,推导的氨基酸序列仅仅是N端的50个氨基酸残基有差异.出现这种现象可能是由于可变剪切的结果,在其它物种的研究中也出现过由于可变剪切编码不同Rel/ NF-κB蛋白的现象,例如家蚕BmRelA和BmRelB的氨基酸序列也仅是N端52个氨基酸残基有差异[9].本实验克隆的2个Apdorsal基因的编码蛋白质都有典型的Rel/ NF-κB蛋白特征,N端含有由293个氨基酸组成的Rel同源区(RHD),其中包括核定位信号(NLS)和DNA结合结构域等基序. Apdorsal C末端与果蝇和家蚕的Relish[10-11]不同的是该区域中没有锚定重复序列.虽然Apdorsal的结构特征与BmRelA[9]和Gambif1[12]类似,但不具有BmRelA和Gambif1的亮氨酸锌指结构与脯氨酸富集区.值得注意的是,Apdorsal有一个相对较短的C末端片段,这与典型的Dorsal蛋白不同,而且Apdorsal也没有典型的Dorsal转录激活域,这可能是可变剪切造成的[13].
从系统进化树中可以看出,Apdorsal与家蚕BmRelA和烟草天蛾Msdorsal有很近的亲缘关系,同属于Rel/ NF-κB蛋白家族的Dorsal类,表明它们可能起源于同一个祖先.应用real-time PCR技术检测到2个Apdorsal基因在柞蚕蛹脂肪体、血细胞、气管、表皮、生殖腺和头部6个组织器官中都有表达,体现了该蛋白质在柞蚕中的多功能性[6].Apdorsal基因在表皮和气管中的表达量最高,在脂肪体和头部中的表达量次之,在血淋巴中的表达量较低,这是由于表皮是昆虫抵御微生物感染的第一道防线,而脂肪体是参与免疫应答的重要组织器官.用不同微生物诱导处理柞蚕蛹后,部分组织中Apdorsal基因的表达量比空白对照偏低,出现这种现象的原因可能是注射处理过程中物理性伤害产生的抑制作用,这与家蚕注射NaCl溶液后各组织中的BmToll9基因的表达量出现降低的结果相一致[14].
柞蚕蛹脂肪体中的Apdorsal基因经ApNPV诱导处理后的表达水平最高,经毕赤酵母和枯草芽孢杆菌诱导处理后的表达水平次之,经E.coli诱导处理后的表达水平最低.该结果说明柞蚕蛹脂肪体中的Apdorsal可能与对病毒、真菌、革兰阳性菌的免疫有关,而与对革兰阴性菌的免疫无关.这与Dorsal蛋白在Toll通路中对革兰阳性菌和真菌侵染具有抵抗作用的研究结果一致[1,8].对于病毒侵染昆虫后是否激活了NF-κB信号通路尚无定论.已有文献报道Toll样受体(TLRs)参与了病毒的识别,进而激活Toll通路[15];Zambon等[16]也报道果蝇在抵抗病毒侵染的过程中通过激活Toll通路产生抗菌肽(AMPs),但不是通过AMPs抗病毒,而是由Toll通路激活细胞免疫杀灭病毒,说明病毒侵染可能会使Toll通路中的Dorsal的表达量增加.
这与本实验对柞蚕蛹注射ApNPV悬液后脂肪体中的Apdorsal基因的表达量增加的结果相一致.然而Hirai等[17]用病毒侵染柞蚕后未检测到抗菌肽Attacin基因的表达,认为病毒不能激活NF-κB信号通路.对于病毒是否激活NF-κB信号通路及病毒侵染使Apdorsal表达量增加的分子机制仍需继续探究.
参考文献References)
[1] Hoffmann J A. The immune response ofDrosophila[J]. Nature,2003,426(6962):33-38
[2] Lemaitre B,Reichhart J M,Hoffmann J A.Drosophilahost defense:differential induction of antimicrobial peptide genes after infectionby various classes of microorganisms[J].Proc Natl Acad Sci USA,1997,94(26):14614-14619
[3] Lemaitre B,Nicolas E,Michaut L,et al.The dorsoventral regulatorygene cassette sp-tzle/ Toll/ cactus controls the potent antifungal re-sponse inDrosophilaadults[J].Cell,1996,86(6):973-983
[4] Gillespie S K, Wasserman S A. Dorsal, aDrosophilaRel-likeprotein,is phosphorylated upon activation of the transmembraneprotein Toll[J].Mol Cell Biol,1994,14(6):3559-3568
[5] Hedengren M,-sling B,Dushay M S,et al.Relish,a central factorin the control of humoral but not cellular immunity inDrosophila[J].Mol Cell,1999,4(5):827-837
[6] Ghosh S,May M J,Kopp E B.NF-kappa B and Rel proteins:evolu-tionarily conserved mediators of immune responses[J].Annu RevImmunol,1998,16(1):225-260
[7] Silverman N,Maniatis T.NF-κB signaling pathways in mammalianand insect innate immunity[J].Gene Dev,2001,15(18):2321-2342
[8] Belvin M P,Anderson K V. A Conserved signaling pathway:theDrosophilaToll-Dorsal pathway [ J]. Annu Rev Cell Dev Biol,1996,12(1):393-416
[9] Tanakaa H,Yamamotob M,Moriyamab Y,et al.A novel Rel proteinand shortened isoform that differentially regulate antibacterial pep-tide genes in the silkwormBombyx mori[ J]. BBA-Gene StructExpr,2005,1730(1):10-21
[10] Dushay M S,-sling B,Hultmark D.Origins of immunity:Relish,acompound Rel-like gene in the antibacterial defense ofDrosophila[J].Proc Natl Acad Sci USA,1996,93(19):10343-10347
[11] Tanaka H, Matsuki H, Furukawa S, et al. Identification andfunctional analysis of Relish homologs in the silkworm,Bombyxmori[J].Biochim Biophys Acta,2007,1769(9/10):559-568
[12] Barillas-Mury C, Charlesworth A, Gross I, et al. Immune factorGambifi,a new rel family member from the human malaria vector,Anopheles gambiae[J].EMBO J,1996,15(17):4961-4701
[13] Kawai N,Shimada M,Kawahara H,et al.Regulation of ascidian Relby its alternative splice variant [ J]. Eur J Biochem,2003,270(22):4459-4468
[14] Wu S,Zhang X F,Chen X M,et al.BmToll9,an Arthropod conser-vative Toll,is likely involved in the local gut immune response inthe silkworm,Bombyx mori[J].Dev Comp Immunol,2010,34(2):93-96
[15] Takeda K,Akira S.Toll receptors and pathogen resistance[J].CellMicrobiol,2003,5(3):143-153
[16] Zambon R A, Nandakumar M, Vakharia V N, et al. The Tollpathway is important for an antiviral response inDrosophila[J].Proc Natl Acad Sci USA,2005,102(20):7257-7262
[17] Hirai M,Terenius O,Li W,et al.Baculovirus and dsRNA induceHemolin,but no antibacterial activity, inAntheraea pernyi[ J].Insect Mol Biol,2004,13(4):399-405





