
肠道对于动物来说就像是内在生命线, 而肠道内微生物影响着肠道众多功能的发挥, 因此关于肠道内微生物的研究近几年也越来越被重视。已有研究表明, 鱼类消化道微生物对鱼的免疫、营养等都有重要影响, 消化道内微生物群落的平衡稳定可以促进鱼体健康的生长。鱼类消化道微生物在影响着宿主鱼的同时, 其组成也受着宿主自身与外界因素的影响, Romero 等发现银大麻哈鱼(Oncorhynchus keta)消化道微生物群落在第一投喂阶段后才稳定, 而李学梅等对室内养殖的斑点叉尾 、银鲫和异育银鲫的消化道微生物进行了比较,发现不同种鱼的消化道微生物的种类组成有显着差异, 同时尹军霞等研究发现同种鱼消化道不同区段的微生物组成也存在很大不同, 另外, Margolis早在 1952 年用传统培养法对经过饥饿处理的大头鱼(Ameiurus nebulosus)及 斑点 鳟(Salaeliruts fon-tinali)的消化道细菌进行了研究, 发现饥饿使消化道微生物种类减少。以上研究表明消化道微生物与宿主鱼之间存在密切关系。对于外界条件变化,消化道微生物自身是否存在响应机制呢?本研究选用消化道微生物群落已相对稳定的异育银鲫“中科 3号”成鱼作为研究对象, 并将其消化道作为相对封闭的微型生态系统来研究, 旨在进一步阐述饲料这一鱼类营养源在作为消化道微生态系统外界干扰时对其内部物种组成的影响, 为今后研究消化道微生物功能基因指明了方向, 同时为水产鱼类肠道菌群研究提供一些基础数据。
1 材料与方法
1.1 实验材料与样品采集
实验鱼饲养于中国科学院水生生物研究所鱼类生理生态学学科组循环水系统中, 水温为 24—28℃,期间投喂人工配合饲料, 待性成熟后进行饥饿处理30d, 随机抽取 3 尾同规格的鱼, 在编号 A、B 和 C后解剖取样, 取样时用 75%的酒精擦拭肠外壁, 分前肠、中肠和后肠取样, 取得 9 份样品分别编号H1-H9 (H1、H2、H3 代表 A 的前肠、中肠和后肠,H4-H6 及 H7-H9 对应代表 B 和 C 的前肠、中肠和后肠), 保存用于微生物 DNA 的提取; 再给剩下的鱼投喂相同人工配合饲料, 25d 后再次随机抽取 3 尾同规格的鱼编号 D、E 和 F, 解剖取样得 9 份样品, 分别编号 F1-F9(F1、F2、F3 代表 D 的前肠、中肠和后肠, F4-F6 及 F7-F9 对应代表 E 和 F 的前肠、中肠和后肠), 保存用于微生物 DNA 的提取。
1.2 消化道微生物总 DNA 的提取
实验采用传统的酚-氯仿法提取肠道微生物总DNA, 即: 向每管样品中加入 1.2 mL 裂解液(0.5% SDS; 10 mmol/L Tris-Cl, pH8.0; 10 mmol/LEDTA, pH8.0; 100 mmol/L NaCl; 蛋白酶 K 100 μg/mL;RNase A, 50 μg/mL), 37℃水浴 1h 后, 加入 PK(20 mg/mL) 6 μL, 55℃过夜(12h, 至清亮); 取上清液进行 DNA 抽提, DNA 在 4℃下经 24h 沉淀后, 离心干燥并加入 100 mL 无菌水溶解, –20℃保存备用;总 DNA 用 0.7%的琼脂糖凝胶(含 EB)进行电泳以检测提取效果。
1.3 PCR-DGGE 分析
采用细菌 16S rRNA 基因 V3 区通用引物(F357-GC 和 R518)对所得 18 个样品中的肠道细菌 DNA 进行 PCR 扩增, 将扩增得产物进行 DGGE 分析,变性剂浓度范围为 40%—70%, 凝胶在 110V 下经过12h 的电泳后紫外照相, 由于投喂组 F5 和 F6 未能得到相应的 PCR 扩增产物, 样品 F5 和 F6 不参与数据分析, 使用 Quantity One (Bio-Rad Laboratories, CA,USA)软件对谱带进行分析。
1.4 数据分析
在得到各泳道及谱带亮度等详细信息并转化为0/1 矩阵后, 使用 Canoco 4.5 对数据进行 CA (Cor-respondence Analysis)分析, 通过 R 3.0.0 对各泳道数据进行基于 Jaccard 指数的相似性分析并绘制聚类图, 通过 Microsoft Excel 2010 对谱带数量及亮度值进行分析并绘图, 同时计算谱带亮度值的方差值以比较两组中各物种分布密度的变异程度大小。
2 结果
2.1 消化道微生物群落 PCR-DGGE 指纹分析
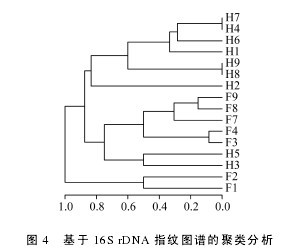
针对细菌 16S rRNA 基因进行的 PCR-DGGE 指纹分析共检测到 23 条不同的谱带(图 1), 其中饥饿组谱带数为18条, 投喂组谱带数为17条, 两组共有谱带 12 条, 由图上可以看出饥饿组特异性谱带稳定且与投喂组存在明显差别, 以实验鱼为操作单元,基于全肠微生物种类分布的相似性聚类分析表明(图 2), 饥饿组 A、B 和 C 聚为一枝, D、F 聚为一枝。【图略】
2.2 消化道微生物群落结构相似性
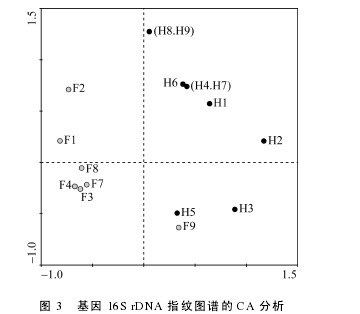
CA 结果显示除样品 F9 外, 投喂组(F1- F4, F7,F8)与饥饿处理组(H1- H9)消化道存在明显差异, 投喂组样品主要存在于第二、三象限, 饥饿组主要存在于第一象限, 且投喂组各样品总体聚集较饥饿组更紧密(图 3), 表明投喂组各样品间消化道微生物群落种类组成相似性高于饥饿组; 为了更直观的显示各消化道微生物群落的差别, 基于 Jaccard 指数相似性聚类结果显示除 F1、F2 样品外, 饥饿组和投喂组大部分分别聚为两大枝(图 4)。【图3-4】
2.3 消化道微生物群落结构比较
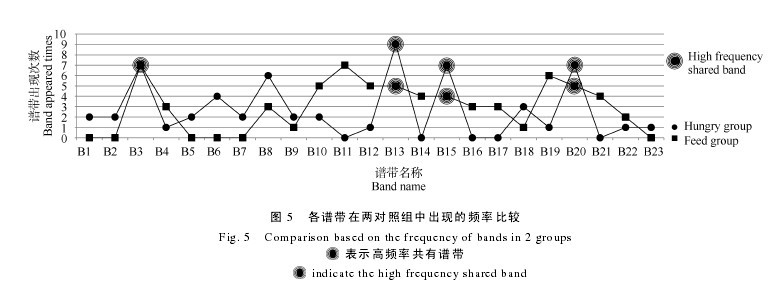
对两组样品中的各个谱带进行比较显示, 饥饿组拥有谱带数为 18, 投喂组拥有谱带数为 17, 两对照组共同拥有谱带 B3、B4、B8、B9、B10、B12、B13、B15、B18、B19、B20 和 B22, 共计 12 条(图 5); 其中B3、B13、B15 和 B20 在饥饿组和投喂组中出现频率较高, 分别为 77.8%与 100%、100%与 71.4%、77.8%与 57.1%、77.8%与 71.4%, 属高频率共有谱带; 结果还显示, 饥饿组中不存在的谱带为 B11、B14、B16、B17 和 B21, 投喂组中不存在的条带为 B1、B2、B5、B6、B7 和 B23, 两者存在明显差异。【图5】
为更清晰的了解两组中各谱带的存在以及分布情况, 我们计算并比较了两对照组中各条带的平均亮度, 结果显示(图 6), 投喂组 56.5%的谱带平均亮度大于饥饿组, 且投喂组中最大亮度与最小亮度之差(2901.99)远大于饥饿组最大亮度与最小亮度之差(1508.55); 对两组方差值进行计算, 结果显示, 饥饿组方差值(365.79)小于投喂组方差值(885.67), 表明饥饿组各样品间各微生物分布密度的变异程度小于投喂组。【图6】

3 讨论
鱼类消化道作为一个微型生态系统, 其内部生活的微生物对营养物质有适应性反应, 同时鱼类肠道的生物性结构差异为生活于其内的微生物造就了不同的生境, 这对其内微生物分布以及扩散有很大的影响。对同一种鱼来说, 成鱼的消化道较幼鱼的消化道内环境稳定, 受到水中微生物以及温度等的影响较幼鱼的小。因此, 本研究选用成鱼消化道作为研究肠道微型生态系统的对象, 以饲料作为这一微型生态系统的“干扰”具有很高的可行性。异育银鲫(Carassius auratus gibelio)自 1985 年由中国科学院水生生物研究所育成以来, 迅速被众多养殖户以及大众接受, 而“中科 3 号 ”品系目前已成为为我国大宗水产养殖品种, 对该鱼的研究具有很好的实际意义。基于前人的探索, 本研究选用了异育银鲫成鱼作为研究对象, 用饲料作为干扰因素以探索消化道这一微型生态系统中微生物群落对恢复饲料投喂的响应机制。本研究发现充分饥饿后恢复投喂导致肠道微生物发生明显变化, 首先是肠道微生物种类数量下降, 并且 CA 分析显示投喂组样品间微生物群落物种组成相似性高于饥饿组, 然而 Manuel 等认为, 在宏观生态系统中, 更多的能量来源可以支持更多的生物种群的存活, 推测本研究这一结果可能与 Bitry研究有关, 饲料等营养物质可在一定程度上影响前、中和后肠的差异, 尽管恢复饲料投喂增加了消化道微型生态系统的能量来源, 但相比于空肠, 恢复投喂后, 同质的饲料充满了投喂组实验鱼的肠道, 在降低了实验鱼前肠、中肠、后肠的“生境”差异并导致微生物种类的下降, 同时还使得使得各肠道样品之间的总差异减少。
在分析比较了两组条带的丰度和亮度后, 发现投喂组样品平均亮度高于饥饿组样品平均亮度, 表明饥饿后恢复投喂使得肠道微生物总体分布密度上升。投喂组中最大亮度(B20)与最小亮度(B18)之差(2901.99)远大于饥饿组最大亮度(B13)与最小亮度(B4)之差(1508.55), 且对比饥饿组方差值(365.79)与投喂组方差值(885.67)表明投喂组肠道样品中微生物的种间密度差异远大于饥饿组, 推测该结果与Kamada 等研究有关。Kamada 等用小鼠研究表明消化道微生物物种间存在生存竞争关系; 本实验饲料的恢复投喂在增加了能量来源并使得微生物数量增加的同时, 还使得微生物种间竞争加剧, 加速形成“优势种”并导致各微生物密度向两极分化, 微生物物种间竞争强度的增加使得有限的生境内能容纳的微生物种类数量减少, 这一结果在宏观生态系统研究中也得到证实。伴随着 B20 密度在投喂后急剧增加以及 B1、B2、B5、B6、B7 和 B23 这五个低亮度条带的消失, 新出现了 B11、B14、B16、B17和 B21 这五个条带平均亮度较高的谱带, 其代表的是肠道内物种的更替, 推测其与饲料中携带的微生物有关。
以上研究结果表明, 充分饥饿后恢复投喂会导致肠道微生物发生明显变化, 本实验以恢复投喂饲料作为这一微型生态系统的“外界干扰”, 在其带入新的微生物同时, 使得微生物密度增加并导致种间竞争加剧, 说明在鱼类消化道中存在一个完整的微型生态系统。本研究为下一步研究这一现象作用机制是否与微生物或鱼肠道本身的功能基因有关指明了方向, 也为研究鱼类肠道内具有特定功能的菌群奠定了基础。
参考文献:
[1] Mueller K, Ash C, Pennisi E, et al. The gut microbiota [J].Science, 2012, 336: 1245
[2] Gómez G D, Balcázar J L. A review on the interactionsbetween gut microbiota and innate immunity of fish [J].FEMS Immunology and Medical Microbiology, 2008, 52:145—154
[3] Lü X R, Xiao K Y. Research of intestinal flora of fish [J].Jiangxi Fishery Sciences, 2008, 2: 12—18 [吕欣荣, 肖克宇.鱼类肠道菌群的研究现状. 江西水产科技, 2008, 2:12—18]
[4] Wang H N, He M Q, Liu P, et al. Study on the intestinalmicroflora of carp in freshwater culture ponds [J]. ActaHydrobiologica Sinica, 1994, 18(4): 354—359 [王红宁, 何明清, 柳苹, 等. 鲤肠道正常菌群的研究. 水生生物学报,1994, 18(4): 354—359]





