放射治疗论文第七篇:治疗放射性核素的应用及其影响因素探究
摘要:放射性核素是核技术在核医学应用的基础, 放射性核素治疗是利用放射性核素衰变释放的各类射线杀伤病变细胞从而达到治疗目的, 是癌症等各类疾病的代表性治疗方法。放射性核素的衰变类型、半衰期、生产方式、供应、性质等决定了其在临床的治疗应用及范围。本文对影响治疗放射性核素应用的主要因素进行分析, 并对部分核素的临床应用前景进行展望, 为治疗用放射性核素的开发及临床应用提供参考。
关键词:治疗; 放射性核素; 应用;
Current Applications and Prospects of Radionuclide for Therapy
HUANG Liqun LI Shufang SUN Ge LIU Huan LI Jianguo AN Quan WANG Zhongwen
Department of Radiation Safety, China Institute of Atomic Energy Department of Radiation Medicine and Environment Medicine, China Institute for Radiation Protection
Abstract:Radionuclide is the basis of nuclear technical application in nuclear medicine.Radionuclide therapy is a representative treatment way for various diseases including cancers, which uses the decay energy of various type of particles released by radionuclide to kill diseased cells and achieve therapeutic purpose.The decay particles have significant differences in range depending on the characteristics, which are suitable for kinds of therapeutic purposes.The emission ofα-particles would be ideal for treatment of single tumour cells or micrometastasis, whereas the emission ofβ-particles would be more suitable for larger metastasis or small solid tumours and Auger emitters could be used for therapy when the carrier molecules carry the radionuclide closely enough to their DNA.The type of decay, half-life, production, supply, and properties of radionuclide determine its clinical application and limits.Radionuclides for routine clinical use should bereadily available and inexpensive, from this point of view, neutron-rich radionuclides produced in reactors are usually cheaper than accelerator-produced radionuclides.This paper analyzes the main factors which determine the therapy application of radionuclide in clinical and prospects for the therapy application of some nuclides, which provide reference for the development and clinical application of radionuclide therapy.
放射性核素在过去的数十年成功应用于临床治疗, 特别是放射性核素靶向治疗得到了市场的认可, 在癌症及其他恶性肿瘤的治疗上显示出巨大的潜力[1]。放射性核素治疗是利用放射性药物在组织的特异性富集、分布 (含植入介入) 或载体 (单克隆抗体、多肽等) 的靶向特异性结合于病变部位, 依靠其携带的放射性核素发射射线粒子 (α、β、二次电子及俄歇电子等) 产生的生物学效应, 达到治疗或破坏病变组织的目的[2]。核反应堆及各类加速器可生产1 000多种放射性核素, 但其中只有少部分核素的物理和化学性质适于医学应用。决定放射性核素在临床应用前景的因素包括:衰变类型及能量、半衰期、毒性、生产方式、供应、价格、化学配位能力、载体特性等。本文主要对治疗用放射性核素的核素特性、生产、供应、性质及临床使用等进行简介, 并分析影响治疗放射性核素应用的主要因素, 对部分核素的临床应用前景进行展望, 以期为肿瘤核素靶向治疗中放射性核素的选择和应用提供参考。
1 核素分类
目前, 具有在临床上治疗各类疾病潜力的放射性核素约有100多种, 包括发射α粒子、β粒子、俄歇电子及X射线等的核素[3]。按照核素衰变方式通常可以分为α、β-、EC衰变及γ衰变, 发生α衰变会从原子核射出一个α粒子, α衰变方式主要限于一些比铅重的核素和一些镧系元素, β衰变是发射β粒子 (β-或β+, β+常用于PET显像) 或俘获轨道电子 (EC衰变) 的过程, γ衰变是核素从激发态以γ光子的形式释放出多余的能量从而回到基态的过程 (IT衰变) 。按照作用方式不同通常分为两类:一类为植入法治疗放射性核素, 将放射性核素包被植入或局部注射到肿瘤组织内, 从而达到治疗或缓解的目的;另一类是通过载体分子 (或核素自身特性) 使放射性核素在体内组织器官中选择性浓集, 利用放射性核素的辐射效应来抑制和破坏病变组织 (如肿瘤) , 从而达到治疗目的[4]。
2 衰变特性
放射性核素治疗是依靠吸收的辐射剂量杀死疾病组织, 快速分裂的细胞对射线极其敏感, 因此一些癌症的生长可以通过射线照射得到控制或消除。体外治疗常使用60Co源发射的γ射线进行照射, 体内介入治疗通过在靶组织摄入或植入电离辐射源 (通常是γ或β释放核素) 进行照射。介入治疗使用过约150种核素[5], 临床上常用的有192Ir (T1/2=73.8d) 、125I (T1/2=60.1d) 、103Pd (T1/2=17.0d) 等核素, 通常是制成籽源或支架等[6], 如192Ir籽源用于治疗脑癌及乳腺癌, 通过导管引入靶区域, 达到适当的剂量后, 再将籽源移出, 这种短距离放射治疗对全身的照射剂量减小, 可以更好的靶向肿瘤区域[7]。
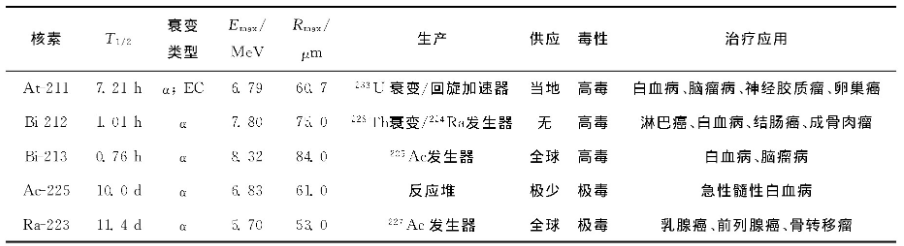
治疗α核素性质及应用列于表1。α粒子释放核素如213Bi、212Bi、211 At、225 Ac、223 Ra一直是肿瘤靶向治疗的研究热点。由于其射程较短, α粒子在衰变处只能穿透数个细胞, α核素是治疗小体积、均质性、转移性癌症的理想之选, α粒子的细胞毒效应不依赖于细胞周期及氧浓度, 可用于治疗乏氧肿瘤[8]。尽管α核素作为放射性药物有放化方面的优势, 但α治疗核素数量远少于β治疗核素。α核素的使用应能使其毒性效应限制在高度特定的区域, 同时应采取措施防止核素在肿瘤之外的组织中累积。α粒子在软组织中的穿透力仅有一个细胞的直径大小, 细胞特定分子的靶向优势结合有效的放射治疗将有很好的效果, 可以达到有效治疗的目的而没有副作用。如211 At释放的α粒子传能线密度 (linear energy transfer, LET) 约为97keV/μm, 是90 Y释放的高能β粒子的400多倍。尽管很早就认识到α核素的基本优势, 但受限于供应等问题, 其在临床靶向治疗中的应用研究近些年受到了持续关注。
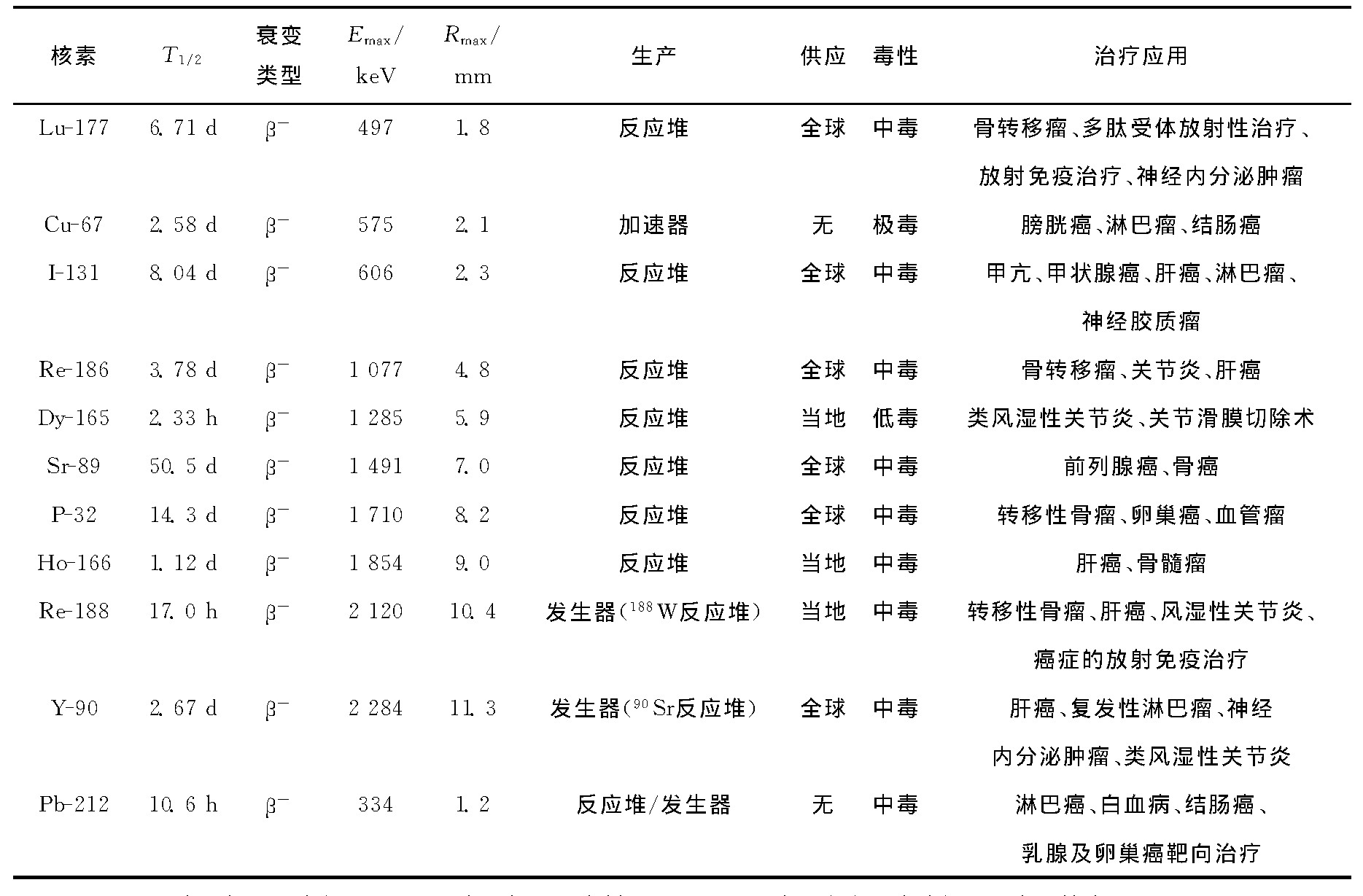
治疗β核素性质及应用列于表2。β-衰变粒子能量分布从零到一个最大值, 形成一个连续能谱, 其电离能力比α粒子弱, 比γ射线强。β衰变核素如32P、165 Dy、67Cu、89Sr、90 Y、212Pb、131I、166 Ho、177Lu、186 Re、188 Re是目前临床试验和使用最广的治疗放射性核素。目前核医学治疗应用最多的是131I和90 Y, 177Lu具有很好的前景, 正逐步替代90 Y标记多肽应用于受体靶向治疗[9]。提供靶向放射性核素的可行性决定了核素的可用性, 目前在用的有90Sr/90 Y和188 W/188 Re核素发生器。
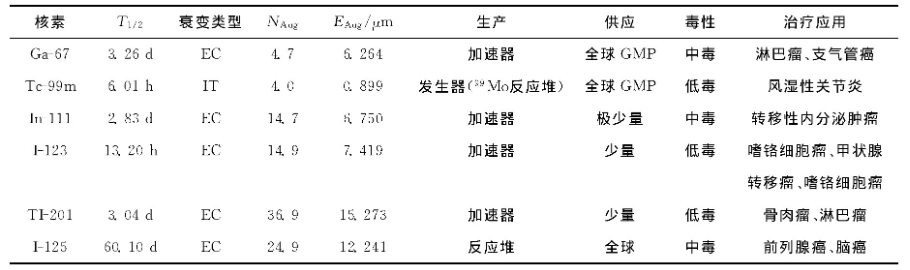
EC衰变是缺中子核素达到稳定状态的另一种方式, 原子核捕获核外电子 (通常是K层轨道) , 外层电子向内层空缺补充, 同时将多余的能量以X射线及俄歇电子的形式释放出去, EC衰变通过不同于β+衰变的方式达到相似的原子核组成改变。俄歇电子释放核素有较高的相对生物效能 (relative biological effectiveness, RBE) , 在细胞内集聚后, 俄歇电子因射程短其俄歇效应多产生于细胞内。俄歇电子只有产生于细胞内 (最好是DNA内或附近) 时才有破坏作用, 因此可以假定放射性核素的衰变中只有一部分产生了损伤细胞的俄歇效应。值得注意的是产生俄歇效应的放射性核素通常用于诊断目的, 这些核素大剂量使用时应考虑其在细胞内的分布及可能的放射毒性。治疗俄歇电子释放核素的性质及应用列于表3。
表1 治疗α核素性质及应用
注:1) Emax为α粒子最大能量;2) Rmax为α粒子最大射程。
表2 治疗β核素性质及应用
注:1) Emax为β粒子最大能量;2) Rmax为β粒子最大射程;3) 212Pb发生β衰变后生成的212Bi为α核素。
表3 治疗俄歇电子释放核素的性质及应用
注:1) NAug为每个衰变释放的俄歇电子数目;2) EAug为俄歇电子的中等射程。
3 能量及核素选择
辐射的生物效应与LET直接相关, 其是单个粒子在单位径迹的平均能量沉积。高LET辐射如α粒子辐射其单击即可杀死细胞, 而β辐射其杀伤效率则较低。α粒子和β粒子之间简单的物理差异是质量比, 大约8 000比1, 电荷比只有2倍, 衰变的能量约相差10倍, 揭示α粒子以非相对论速度行进 (约为光速的1/20) , 而β粒子的速度基本等于光速[10]。α射线穿行速度慢导致其径迹较电子更短, 从而可以产生很高的LET, α射线的LET为80keV/μm, 在其径迹末端甚至可以达到240keV/μm, 是β射线的400~1 200倍[11]。5.9 MeV和8.4MeVα粒子的LET分别为80keV/μm和61keV/μm, 而100keV和500keVβ粒子的LET分别为0.2keV/μm和0.5keV/μm, 电离密度累积的剂量对存活曲线具有重要影响。
理论上俄歇电子、α粒子、β粒子在人体组织内的穿透距离分别为0.001~1μm、40~80μm、0.3~10mm。单个肿瘤细胞的直径为15~30μm, 肿瘤结节直径为2mm~cm级[12]。射程在几个细胞直径范围的α核素是治疗单一肿瘤细胞、残余病灶及微小转移病灶的理想核素, 而β核素 (其射程根据能量不同通常介于0.5毫米至几个毫米间) 更适于大的病灶及小的实体瘤, 根据肿瘤大小, 选择合适的β能量, 使肿瘤的吸收剂量得到优化。β辐射的优点在于治疗渗透性较差的大块肿瘤时, 治疗药物主要位于肿瘤的表面, 此时肿瘤内部的细胞可以被肿瘤表面药物发射的多向β贯穿射线杀死。当然释放俄歇电子核素也可用于治疗, 前提是载体分子必须被靶细胞吸收, 放射性核素可以足够接近靶细胞DNA并使其失活。俄歇电子可以达到α粒子的杀伤效率但仅限于10nm的范围, 因此其必须直接靶向DNA。
4 半衰期
具有临床应用价值的医用同位素其物理半衰期不能太短, 应满足制备、标记及质控等过程的需要, 过长的半衰期会产生不必要的暴露风险, 患者的长期隔离措施会增加治疗成本。另一方面, 生物半衰期由使用的载体决定, 如果设计的载体永久留在患者体内, 其物理半衰期不能太长, 但应确保载体在靶器官有足够的保留时间, 以有效的传递放射剂量[13]。根据核素的来源及制备方式, 最佳的半衰期通常在数小时至数天[14]。对于治疗应用, 其核素理想的半衰期应是放射性药物在靶器官达到最大吸收所需时间的2~3倍, 同时核素半衰期应尽可能短, 以确保靶细胞受到足够高剂量率的照射, 避免靶细胞成功启动修复机制[15]。
如果载体分子在体内的转运时间过长, 分子到达靶器官时放射性核素已经衰变, 会造成健康组织不必要的辐射剂量。如果同样的载体分子标记了更长半衰期的放射性核素, 即使所有的载体分子都将放射性核素转运至靶细胞, 其剂量率仍太低, 难以达到治疗效果。总之, 放射性核素的半衰期应根据其载体分子的性质进行选择, 选择治疗放射性核素的半衰期与生物分子的药代动力学相匹配, 以实现药物的快速扩散, 靶组织浓集和快速的血清除, 达到快速分布, 集中释放的目的, 降低或消除对人体的辐射危害。
5 毒性
从核素毒性来看, α衰变核素多为高毒 (211 At、212Bi、213Bi) 或极毒组 (225 Ac、223 Ra) :225 Ac标记的林妥珠单克隆抗体在治疗急性白血病时会导致肝功能异常及骨髓细胞的显著下降;212Bi-mAb (由212Pb-mAb衰变产生) 靶向治疗乳腺癌时在细胞内溶酶体的作用下, 核素会从螯合剂上脱落产生骨毒性效应。β衰变核素多为中毒组 (177Lu、131I、186 Re、89Sr、32P、166 Ho、188 Re、90 Y、212Pb) :临床上给予90 Y-DOTA-TOC的患者, 当累计活度超过7.4GBq/m2时会出现肾毒性;同90 Y相比, 177Lu对肾脏功能的毒性影响更小。俄歇电子释放核素为中毒 (67 Ga、111In、125I) 或低毒组 (99mTc、123I、201 TI) [16]:99mTc是目前临床使用较为广泛的核素, 主要用于显像, 单次诊断使用量一般在200~700 MBq;111In主要引起肝脏、肾脏及脾脏损伤, 其临床用药剂量安全系数较大, 通常不会对受检者产生危害。因此, α和β核素的标记物应具有较高的靶向特异性, 且载体与核素的标记或络合能力强, 体内稳定不易脱落, 避免对其他组织器官的损伤。如体内游离的钇粒子易沉积于骨内, 对骨髓的毒性较大。
6 生产供应
医用放射性核素的来源包括:核反应堆生产、加速器生产及从核燃料后处理废液中分离纯化[17]。其中核反应堆生产放射性核素是主要途径 (约占医用核素的80%, 其余由粒子加速器生产[7]) , 大部分富中子放射性核素利用多用途研究堆生产, 主要发生β-衰变, 因此特别适于体内放射治疗;而加速器通常生产缺中子放射性核素, 主要发生EC (electron capture) 反应或β+衰变, 因此适于体内诊断研究[6]。两种核素生产方式互为补充共同满足核医学应用。一些短寿命放射性核素, 如99mTc、90 Y等可利用反应堆或加速器产母体核素制成的核素发生器制备。
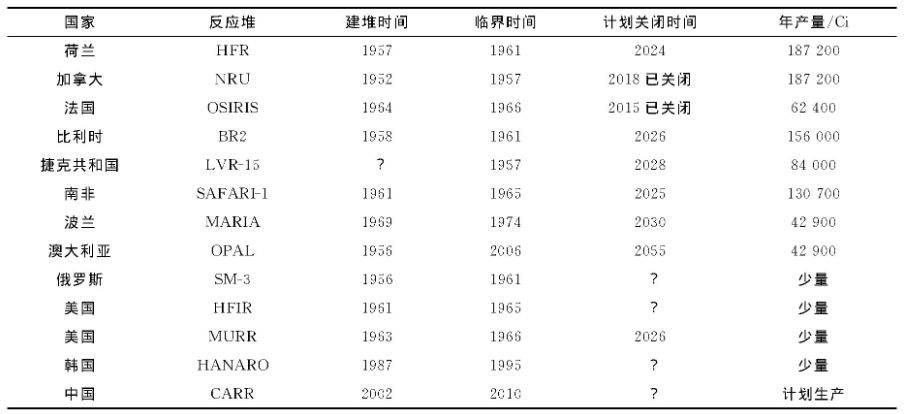
核医学及放射性药物行业面临的放射性核素全球化供应短缺的形势越来越严峻。目前反应堆生产的医用核素全球供应 (主要是99 Mo/99mTc) 依赖于少数几个医用研究堆 (表4) , 多数已超期服役, 且面临着维护成本高、废物处置难、安全风险等一系列问题, 向全球供应核素的几个主要的反应堆将在2025年前后陆续关闭[18]。其中, 法国的OSIRIS堆和加拿大国家通用研究堆 (NRU) 已分别于2015年、2018年末永久性停止生产, 造成2016年末全球供应的99 Mo产量减少了大约30%, 核素的短缺将一直持续到2025年以后, 临床99mTc应用的价格也将持续上涨。
我国常用的放射性同位素18F、60Co、89Sr、99 Mo、131I、125I、192Ir等的年使用额近10亿元, 目前国内可供应放射性核素品种少, 来源单一, 除60Co和131I外, 其他同位素完全依赖进口, 放射性核素供应是其临床应用的基础, 供应的短缺限制了研发和在临床的应用[19]。《中国药典》共收录30余种放射性药品, 用于治疗的药品主要使用131I、32P、67 Ga、125I、201 Tl、89Sr等核素, 目前正在申报的药物还使用了188 Re、223 Ra、90 Y等核素[20]。
临床推广应用的放射性核素应易于制备且价格适中, 如99mTc其价格适中, 制备比较简单。相反, α核素如225 Ac其国际市场的可靠供应来自少数几个国家的钍基发生器系统, 年产量小于2Ci, 其极少的供应及昂贵的价格难以支撑大规模的临床研究和应用[21]。通常富中子核素主要由反应堆通过中子捕获反应或裂变产物制备, 因此价格通常比加速器生产的放射性核素便宜。
表4 生产医用核素的主要研究用反应堆
注:1) 活度产量数据依据OECD-NEA Report 2014计算得出, 非实际产量;2) ?表示未查到相关时间。
为缓解对反应堆生产方式的过度依赖, 人们尝试通过各种加速器 (直线加速器、回旋加速器) 制备99mTc并成功应用于临床, 其成本甚至可以控制在1加拿大元/mCi, 但产量仅限于区域供应[22,23]。同时基于回旋加速器生产99mTc需要高能回旋加速器, 使用生产正电子药物的医用回旋加速器不能制备, 从经济上考虑采用回旋加速器规模化生产99mTc并不可行, 因此加速器制备方式在短期内仍无法完全替代反应堆生产核素供应链, 只能作为反应堆生产核素的补充[24,25]。
核素发生器系统是医院使用放射性核素的理想来源, 通常是通过长半衰期母体核素衰变得到短半衰期的子体核素用于临床, 是一种重要的现场核素制备方法, 具有制备简单、转运方便, 成本低的特点[18]。目前临床应用较多的治疗核素发生器分别是制备β-核素的188 W/188 Re、90Sr/90 Y发生器和制备α核素的225 Ac/213Bi、227 Ac/223 Ra发生器。其他具有开发前景及临床应用潜力的核素发生器系统有166 Dy/166 Ho (β-) 、194 Os/194Ir (β-) 、212Pb/212 Bi (β-) 、226 Ra/222 Rn (α) [26]。
7 临床应用
从全球范围来看, 一款放射性治疗药物的开发成本平均在3~9千万欧元, 开发周期约为7~12年。尽管如此, 放射性核素仍有很好的临床治疗应用前景。客观上不存在各种性能完全理想的放射性核素, 在治疗核素的选取方面, 根据不同治疗目的、肿瘤类型、不同器官与组织, 甚至不同分期的肿瘤选择合适的治疗核素。根据Zimmermann的预测, 未来十年上市的治疗放射性药物将基于131I、90 Y、177Lu、188 Re或212Pb, 开展64Cu、67Cu、177mSn、211 At或166 Ho的治疗应用研究也可行但风险较高[27]。部分核素的临床应用及研究情况如下。
7.1 131I
131I是目前临床上广泛使用的治疗放射性核素之一, 其物理半衰期为8.04d, 释放的β射线能量适中且射程较短, 临床上主要用于甲状腺功能亢进和分化型甲状腺癌术后的治疗[28,29]。同时其标记简单, 标志物稳定性良好, 是比较理想的用于放射免疫治疗的放射性核素, 如131I标记的单克隆抗体介导肝癌的放射免疫治疗[30]。131I治疗应用的最大缺点是辐射诱导的骨髓抑制及较低的肿瘤/非靶器官比率, 而211 At没有这些缺点, 是更好的替代选择[7]。
7.2 90Y
90 Y半衰期为2.7d, 是纯β-射线释放核素, 常制成凝胶或玻璃微球用于关节及管腔的治疗, 还可用于转移性神经内分泌肿瘤基于多肽受体的靶向治疗[31]。与177Lu相比, 90 Y更适合于大体积肿瘤的治疗, 而177Lu适合较小体积肿瘤的治疗, 177Lu的急性旁效应更显著, 90 Y的亚急性及长期毒性效应更显著[32]。90 Y最大的不足是游离的钇粒子易沉积于骨内, 对骨髓的毒性较大。
7.3 177Lu
177Lu释放的中能β-粒子在软组织中的射程为670μm, 是向微小转移病灶递送能量的理想核素, 根据其释放的低能γ光子可以显像放射性标记治疗药物的生物分布和清除动力学, 并在治疗前或治疗过程中进行剂量的估计。177Lu的氧化态只有+3价, 适宜多肽和蛋白质的标记。177Lu半衰期较长, 能满足更复杂的标记、纯化、质控等程序需要, 适合于靶向动力学较慢的抗体药物的放射性标记;同时长半衰期为其转运和异地分发使用提供了可能性, 临床使用的成本-收益较高。目前符合药品生产质量管理规范 (good manufacturing practices, GMP) 级177Lu的供应仅美国、加拿大及德国的几家公司拥有, 活度一般在20~80Ci/mg[33]。
7.4 188 Re
188 Re的半衰期为16.9h, 发射纯β射线。铼的化学性质与锝相似, 可以与很多配体络合制成治疗药物, 高纯度的188 Re通过188 W-188 Re发生器制备, 其来源方便, 是临床上治疗骨转移瘤的理想核素。
7.5 211At
依据核素衰变特性在所有释放α粒子的放射性核素中, 211 At是最有希望用于肿瘤靶向治疗的核素之一。其半衰期为7.2h, 衰变释放的α粒子在水及软组织中的射程小于70μm, LET为100~130keV/μm, 是重离子的最大RBE。影响其在临床应用的主要因素是供应不足, 目前只有少数几个拥有高能回旋加速器的研究机构可以生产[34]。
7.6 67Cu
67Cu是低能β及γ射线释放核素, 半衰期为2.58d, 适合于单克隆抗体等药代动力学缓慢的分子标记, 是理想的诊断治疗双功能核素。应用反应堆及加速器都可以生产67Cu, 目前的供应短缺主要是因为缺乏生产高能质子的回旋加速器, 在临床的应用还存在比活度低和价格昂贵等问题。67Cu核素可以与各种大环化合物 (DOTA、TETA、CPTA等) 及笼形螯合剂螯合, 但其肿瘤背景率较低, 铜离子转螯合后易在肝脏中积累[35]。
7.7 166 Ho
166 Ho是高能β-释放核素, 同时释放可用于SPECT显像的γ射线。天然Ho通常合成微球后用中子激活, 从而生成166 Ho标记的微球, 166 Ho标记的微球被认为优于90 Y标记的玻璃或树脂微球, 因为166 Ho的生产成本更低, SPECT显像可以监测病程, 而且Ho是高度顺磁性物质可用于MRI显像。
8 展望
理论上具有潜在治疗价值的放射性核素种类比较丰富, 尤其镧系元素。目前体内放射性核素治疗的重点已经转向低射程高电离的放射性核素衰变, 包括低能β-、α、俄歇电子及转换电子释放核素。部分核素的应用已经考虑了很长时间, 但直到近几年核素的生产方法才获得一些进展, 使其在临床的应用得到不断关注[6]。
加拿大原子能公司 (CNL) 在停止NRU的核素生产后, 已将研究方向转向α核素的生产和靶向治疗应用, 并致力于建成α核素治疗与应用的全球性研究中心。α核素有高LET的优势, 可以在靶细胞局部集中释放能量从而达到治疗目的, 但是具有临床应用价值的α核素半衰期都非常短, 因此提出了体内发生器的概念, 即使用长半衰期α核素如225 Ac (T1/2=10d) 或227 Th (T1/2=18.7h) 衰变成一系列短半衰期α子体核素。该方法的关键取决于能否找到稳定结合核素的螯合基团并一步步地控制其子体位置, 因为载体的反冲效应可能使核素从螯合剂上丢失[36]。所有α粒子释放的时间间隔越短, 核素实现位置可控的可能性越高, 显然这样的目标只有226 Th (T1/2=30.6min) 能实现[15]。
放射性核素治疗的理想情况是利用同一放射性核素 (或核素对) 对患者既进行诊断又进行治疗, 在得到药物分布、剂量信息的同时进行治疗, 并对治疗剂量进行评估。目前可供选择的诊断治疗双功能放射性核素有47Sc、67Cu、67 Ga、117mSn、123I、131I、153Sm、177Lu、211 At、213Bi, 核素对有47Sc/44Sc、67Cu/64Cu、67 Ga/68 Ga、89Sr/83Sr、131I/124I、161 Tb/152 Tb, 这是核素治疗发展的一个新动向[37]。
随着核医学的大力发展, 放射性核素的生产将越来越依赖于研究堆及能量达到30 MeV的小型和中型回旋加速器, 要生产一些新型放射性核素还需要建立中等能量 (约100 MeV) 、高通量的质子加速器[6]。核医学的未来在于个性化医疗, 依据每个患者的病情选择合适的放射性核素和载体[38]。在当下及可预见的未来, 利用放射性核素释放的电离辐射杀死肿瘤细胞都将是最有希望治疗癌症的方法之一。
参考文献
[1] Sabet A, Biersack H J, Ezziddin S.Advances in peptide receptor radionuclide therapy[C]∥Seminars in nuclear medicine.WB Saunders:Elsevier, 2016, 46 (1) :40-46.
[2] 刘建庭.纳米铁核素靶向内照射治疗肿瘤的剂量学研究[D].长沙:中南大学,2007.
[3] Das T, Pillai M R A.Options to meet the future global demand of radionuclides for radionuclide therapy[J].Nuclear Medicine and Biology, 2013, 40 (1) :23-32.
[4] 贾红梅,刘伯里.中国放射性药物的现状与展望[J].同位素,2011, 24 (3) :129-139.Jia Hongmei, Liu Boli.Current status and prospects of radiopharmaceuticals in China[J].Journal of Isotopes, 2011, 24 (3) :129-139 (in Chinese).
[5] Chernyaev A P, Borshchegovskaya P Y, Nikolaeva A A, et al.Radiation technology in medicine:Part 2.Using isotopes in nuclear medicine[J].Moscow University Physics Bulletin, 2016, 71 (4) :339-348.
[6] Qaim S M.The present and future of medical radionuclide production[J].Radiochimica Acta, 2012, 100:635-651.
[7] Keresztes A, Borics A, Tomboly C.Therapeutic and diagnostic radiopharmaceuticals[J].Journal of Hungarian Academy of Sciences, 2015:225-247.
[8] Cives M, Strosberg J.Radionuclide therapy for neuroendocrine tumors[J].Current Oncology Reports, 2017, 19:1-9.
[9] International Atomic Energy Agency.Yttrium-90and Rhenium-188Radiopharmaceuticals for Radionuclide Therapy[R].IAEA Radioisotopes and Radiopharmaceuticals Series No.5.Vienna:IAEA, 2015.
[10] Mango L, Pacilio M.Therapy with Alpha Rays[J].ARC Journal of Radiology and Medical Imaging, 2016, 1:1-3.
[11] Kojima S, Cuttler J M, Shimura N, et al.Present and future prospects of radiation therapy usingα-emitting nuclides[J].Dose-Response An International Journal, 2018, 16:1-8.
[12] 张华明,罗顺忠,魏洪源.纳米核药的研究进展[J].同位素,2018, 31 (5) :326-334.Zhang Huaming, Luo Shunzhong, Wei Hongyuan.The progress of nuclear nanomedicines[J].Journal of Isotopes, 2018, 31 (5) :326-334 (in Chinese).
[13] Yeong C H, Cheng M H, Ng K H.Therapeutic radionuclides in nuclear medicine:current and future prospects[J].Journal of Zhejiang University-Science B, 2014, 15 (10) :845-863.
[14] Troyer G, Schenter R.Medical isotope development and supply opportunities in the 21st century[J].Journal of Radioanalytical and Nuclear Chemistry, 2009, 282 (1) :243-246.
[15] Holzwarth U.Radiopharmaceutical production[M].Berlin, Heidelberg:Springer, 2011:71-103.
[16] 中华人民共和国国家质量监督检验检疫总局.GB 18871-2002电离辐射防护与辐射源安全基本标准[S].北京:中国标准出版社,2002.
[17] 李明起,邓启民,程作用,等.医用放射性核素生产现状和主要问题[J].同位素,2013, 26 (3) :186-192.Li Mingqi, Deng Qimen, Cheng Zuoyong, et al.Production and application of medical radionuclide:status and urgent problems to be resolved in China[J].Journal of Isotopes, 2013, 26 (3) :186-192 (in Chinese).
[18] Krijger G C, Ponsard B, Harfensteller M, et al.The necessity of nuclear reactors for targeted radionuclide therapies[J].Trends in Biotechnology, 2013, 31 (7) :390-396.
[19] 黄伟,梁积新,吴宇轩,等.我国放射性同位素制备技术的发展[J].同位素,2019, 32 (3) :208-217.Huang Wei, Liang Jixin, Wu Yuxuan, et al.Development of radioisotopes preparation technology in China[J].Journal of Isotopes, 2019, 32 (3) :208-217 (in Chinese).
[20] 张锦明,杜进.中国放射性药物制备的现状及展望[J].同位素,2019, 32 (3) :178-185.Zhang Jinming, Du Jin.Preparation of radiopharmaceuticals in China:current status and prospects[J].Journal of Isotopes, 2019, 32 (3) :178-185 (in Chinese).
[21] Engle J W.The production of Ac-225[J].Current Radiopharmaceuticals, 2018, 11 (3) :173-179.
[22] Neilly B, Allen S, Ballinger J, et al.Future supply of medical radioisotopes for the UK report2014[R].New York:Cornell University, 2015:03071.
[23] Boschi A, Martini P, Pasquali M, et al.Recent achievements in Tc-99m radiopharmaceutical direct production by medical cyclotrons[J].Drug Development and Industrial Pharmacy, 2017, 43 (9) :1 402-1 412.
[24] Martini P, Boschi A, Cicoria G, et al.In-house cyclotron production of high-purity Tc-99m and Tc-99mradiopharmaceuticals[J].Applied Radiation and Isotopes, 2018, 139:325-331.
[25] Guerin B, Tremblay S, Rodrigue S, et al.Cyclotron production of 99mTc:an approach to the medical isotope crisis[J].The Journal of Nuclear Medicine, 2010, 51 (4) :13N-16N.
[26] Knapp F F R, Dash A.Radionuclide generator systems represent convenient production systems to provide therapeutic radionuclides[M].Radiopharmaceuticals for Therapy.New Delhi:Springer, 2016:131-157.
[27] Zimmermann R G.Why are investors not interested in my radiotracer?The industrial and regulatory constraints in the development of radiopharmaceuticals[J].Nuclear Medicine and Biology, 2013, 40 (2) :155-166.
[28] 何平,杜明华.放射性核素标记的纳米载体治疗恶性肿瘤的研究进展[J].医学综述,2017, 23 (20) :4 012-4 017.He Ping, Du Minghua.Research progress of the radionuclide labeling nano carrier treatment for malignant tumor[J].Medical Recapitulate, 2017, 23 (20) :4 012-4 017 (in Chinese).
[29] 王荣福,吴彩霞.放射性核素及其标记物的临床应用价值[J].同位素,2019, 32 (3) :195-203.Wang Rongfu, Wu Caixia.The clinical application value of radionuclides and radiolabeled compounds[J].Journal of Isotopes, 2019, 32 (3) :195-203 (in Chinese).
[30] 李佳.131I标记单克隆抗体介导的肝癌放射免疫治疗进展[J].癌症进展,2018, 16 (9) :1 080-1 083.Li Jia.Advances in 131I-labled monoclonal antibody-mediated radioimmunotherapy for liver cancer[J].Oncology Progress, 2018, 16 (9) :1 080-1 083 (in Chinese).
[31] Vinjamuri S, Gilbert T M, Banks M, et al.Peptide receptor radionuclide therapy with 90 Y-DOTATATE/90 Y-DOTATOC in patients with progressive metastatic neuroendocrine tumours:assessment of response, survival and toxicity[J].British Journal of Cancer, 2013, 108 (7) :1 440-1 448.
[32] Yusuf S, Alsadik S, Nahhas A A.Peptide receptor radionuclide therapy for neuroendocrine tumours[J].Clinical and Translational Imaging, 2018, 6 (2) :101-111.
[33] Dash A, Pillai M R A, Knapp F F.Production of 177 Lu for targeted radionuclide therapy:available options[J].Nuclear Medicine and Molecular Imaging, 2015, 49 (2) :85-107.
[34] Kim G, Chun K, Park S H, et al.Production ofα-particle emitting 211 At using 45 MeVα-beam[J].Physics in Medicine and Biology, 2014, 59 (11) :2 849-2 860.
[35] Muller C, Meulen N P, Benesova M, et al.Therapeutic radiometals beyond 177 Lu and 90 Y:Production and application of promisingα-particle,β-particle, and auger electron emitters[J].Journal of Nuclear Medicine, 2017, 58:91S-96S.
[36] Miederer M, Scheinberg D A, McDevitt M R.Realizing the potential of the Actinium-225radionuclide generator in targeted alpha particle therapy applications[J].Advanced Drug Delivery Reviews, 2008, 60 (12) :1 371-1 382.
[37] Qaim S M.Nuclear data for production and medical application of radionuclides:present status and future needs[J].Nuclear Medicine and Biology, 2017, 44:31-49.
[38] Hofman M S, Hicks R J.Peptide receptor radionuclide therapy for neuroendocrine tumours:standardized and randomized, or personalized?[J].European Journal of Nuclear Medicine and Molecular Imaging, 2014, 41 (2) :211-213.
点击查看>>放射治疗论文(最新范文8篇)其他文章