摘 要: 本研究旨在了解重庆地区羊口疮病毒(orf virus,ORFV)流行情况。从重庆大足等地区羊场采集18份临床疑似羊口疮病料,提取病料DNA,经PCR鉴定为ORFV阳性;将阳性病料做常规处理,接种羔羊睾丸细胞(LT),并盲传至5代,观察接毒LT细胞病变,将F5代细胞培养物进行间接免疫荧光试验(IFA)、PCR扩增、测序、同源性比对、遗传进化分析和TCID50测定。结果显示,经PCR检测,18份疑似羊口疮病料ORFV核酸阳性率为61.1%(11/18);大足株病料接种LT细胞36 h后,长梭型细胞变圆、融合、呈拉网状、皱缩,72 h后大部分细胞脱落;间接免疫荧光试验在显微镜下观察到细胞浆中出现特异性绿色荧光,且荧光绕核分布;F1至F5代细胞培养物经PCR扩增出特异性目的条带,大小为1 137 bp;将测序结果与GenBank中19株ORFV B2L基因进行同源性比对,其核苷酸同源性在97.9%~100%之间,与美国SA00分离株同源性达100%,且遗传进化分析显示处于同一进化分支,亲缘关系较近;测定F5代细胞培养物TCID50值为10-5.68/0.1 mL,在细胞中能稳定增殖。综上所述,本研究成功分离并获得1株ORFV,为后续ORFV研究提供了生物材料,同时为防控重庆地区的羊口疮奠定基础。
关键词: 羊口疮病毒(ORFV); 分离鉴定; 遗传进化分析;
Abstract: This study was aimed to understand the prevalence of orf virus(ORFV) in Chongqing.18 samples of clinical suspected orf disease materials were collected from sheep farms in Dazu,Chongqing,etc,and DNA of the samples was extracted,which was identified as positive by PCR.Positive disease materials were routinely treated,inoculated with lamb testicular cells(LT),and blind transmitted to the F5 generation.Toxic LT cell lesion CPE was observed,and F5 generation cell cultures were systematically identified by indirect immunofluorescence test(IFA),PCR amplification,sequencing,homology alignment,genetic evolution analysis and TCID50 determination.The results showed that the nucleic acid positive rate of ORFV detected by PCR was 61.1%(11/18).After LT cells were inoculated with Dazu strain for 36 h,the long-spindle cells became round,fused,reticulated and shriveled,and most of the cells fell off after 72 h.IFA observed the specific green fluorescence in cytoplasm,and the fluorescence was distributed around the nucleus.Specific target bands of F1 to F5 cell cultures were amplified by PCR with a size of 1 137 bp.The sequencing results were compared with 19 strains of ORFV B2L genes in GenBank,and the nucleotide homologies were 97.9% to 100%,which was up to 100% of the homology with the SA00 isolates from the United States,and the genetic evolution analysis showed that they were in the same evolutionary branch,with close relationship.The TCID50 value of F5 generation cell culture was 10-5.68/0.1 mL,which could be stable proliferation in cells.In conclusion,this study successfully isolated and obtained an ORFV strain,provided biological materials for the follow-up ORFV research,and laid a foundation for the prevention and control of stomatitis in Chongqing.
Keyword: orf virus(ORFV); isolation and identification; genetic evolution analysis;
羊传染性脓疱口炎,俗称“羊口疮(orf)”,是主要由羊口疮病毒(orf virus,ORFV)感染绵羊和山羊的一种接触性、嗜上皮性人畜共患传染病[1,2,3],该病毒主要感染3~6月龄的羔羊,以羊的口唇、蹄部和外阴等部位形成丘疹、水疱、脓疱为特征,严重影响羔羊的采食和吸乳[4,5]。成年羊感染ORFV后,发病率可达50%~100%[6],病死率较低,当继发感染其他病原时,死亡率可高达90%以上[7]。研究发现,ORFV感染宿主范围在不断扩大[8,9]。羊口疮的发生和流行给养羊业造成了巨大的经济损失,且对公共卫生安全带来威胁。

ORFV为有囊膜的双链DNA分子,全基因组长135.0~148.1 kb,不同分离毒株基因组长度有10~25 kb的差异[10,11]。ORFV的B2L基因位于病毒基因组末端,编码一种囊膜蛋白,且在不同毒株之间具有很高的同源性,因此B2L基因常用作ORFV PCR检测的靶标基因[12,13]。目前,许多国家及养羊地区均有羊口疮发生的报道,该病成为严重影响养羊业发展的重要疫病之一,引起了国内外研究人员的广泛关注。研究表明,ORFV变异性较强,不同地区分离毒株在致病性上存在差异[14]。因此,本研究采集重庆不同养殖场疑似发病羊的痂皮样本进行ORFV的分离鉴定,以期为重庆地区羊口疮的防控及疫苗研究提供生物材料。
1、 材料与方法
1.1 、临床病料
分别采自重庆大足、荣昌、永川等地区7个养殖场疑似发病羊的痂皮,共计18 份。
1.2、 主要试剂与仪器
兔抗ORFV高免血清由贵州省动物疫病研究室制备;DMEM 培养基购自HyClone公司;胰蛋白酶、胎牛血清均购自Gibco公司;病毒基因组提取试剂盒购自QIAGEN 公司;2×Easy Mix、DL2000 DNA Marker均购自TaKaRa公司;50×TAE Buffer购自天根生化科技(北京)有限公司。荧光电子显微镜(型号:IX73)购自OLYMPUS公司。
1.3、 病料采集与处理
取患病羊口唇部痂皮,将病料剪碎并充分研磨,按照1∶5的比例加入DMEM培养液(1%双抗)中,反复冻融3次,4 ℃过夜,4 000 r/min离心30 min,取上清用0.45 μm滤器过滤后,-80 ℃保存备用。
1.4、 引物设计与合成
根据NCBI已发表的ORFV全基因序列(登录号:HM133903.1),采用Primer Premier 6.0软件设计1对针对ORFV B2L基因序列的特异性引物。引物序列:上游引物F:5′-ATGTGGCCGTTCTCCTCCATC-3′;下游引物R:5′-TTAATTTATTGGCTTGCAGAACT-3′。预期扩增片段大小为1 137 bp。引物由生工生物工程(上海)股份有限公司合成。
1.5 、病料PCR扩增
根据病毒基因组RNA/DNA提取试剂盒说明书提取病毒DNA。以提取的病毒DNA为模板进行PCR扩增。PCR反应体系25 μL:2×Easy Mix 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA模板5 μL,ddH2O补足体系。PCR反应条件:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min;4 ℃保存。取6 μL扩增产物进行1.0%琼脂糖凝胶电泳检测,并将阳性产物送至生工生物工程(上海)股份有限公司进行测序。
1.6 、病毒分离培养
将冻存的羔羊睾丸细胞(LT)复苏并进行传代培养。取阳性病料1 mL接种于生长良好且铺满细胞瓶底80%左右的LT细胞,37 ℃吸附2 h,每间隔30 min 轻微摇动,吸附结束后弃上清,分别加入5 mL含2% FBS的DMEM维持液,置于37 ℃、5% CO2培养箱中培养,盲传5代,观察不同代细胞CPE。
1.7、 间接免疫荧光鉴定
将LT细胞在12孔细胞板中培养,待细胞长满单层,接种200 μL病毒液,置于37 ℃、5% CO2培养箱中孵育2 h使病毒充分吸附,吸附后加入2%胎牛血清维持液,继续培养48 h,后用预冷的 80%丙酮固定10 min,PBS洗涤3次,自然干燥,加入阳性兔血清(1∶50稀释)100 μL,37 ℃作用30 min,PBS洗涤3次,自然干燥,后加入兔抗羊IgG-FITC(1∶500稀释)100 μL,37 ℃作用30 min,PBS洗涤3次,自然干燥,荧光显微镜下观察结果。
1.8 、细胞培养物PCR鉴定
以提取的细胞培养物DNA为模板进行PCR扩增,取扩增产物6 μL进行1.0%琼脂糖凝胶电泳检测,凝胶成像仪观察结果。将阳性产物送至生工生物工程(上海)股份有限公司进行测序。将测序结果在NCBI上进行核苷酸BLAST比对分析,并绘制遗传进化树。
1.9 、细胞培养物F5代TCID50值测定
将反复冻融的细胞培养物按照10-1至10-9进行连续稀释后,接种至长满单层LT细胞的96孔板,每个稀释度接种8个孔,每个孔接种100 μL,最后2排加入100 μL维持液作为对照孔,置于37 ℃、5% CO2培养箱中培养,每隔12 h观察细胞病变,连续观察5~7 d,采用Reed-Muench法计算TCID50值(lgTCID50=距离比例稀释度对数之间的差+高于50%病变率的稀释度的对数)。
2 、结 果
2.1 、临床病料PCR扩增结果
从重庆大足、荣昌、永川等地区的羊场共采集18份临床样品,提取病料DNA进行PCR检测,共有11份样品扩增出大小约1 137 bp的目的条带(图1),阳性率为61.1%(11/18)。
图1 临床病料PCR扩增结果
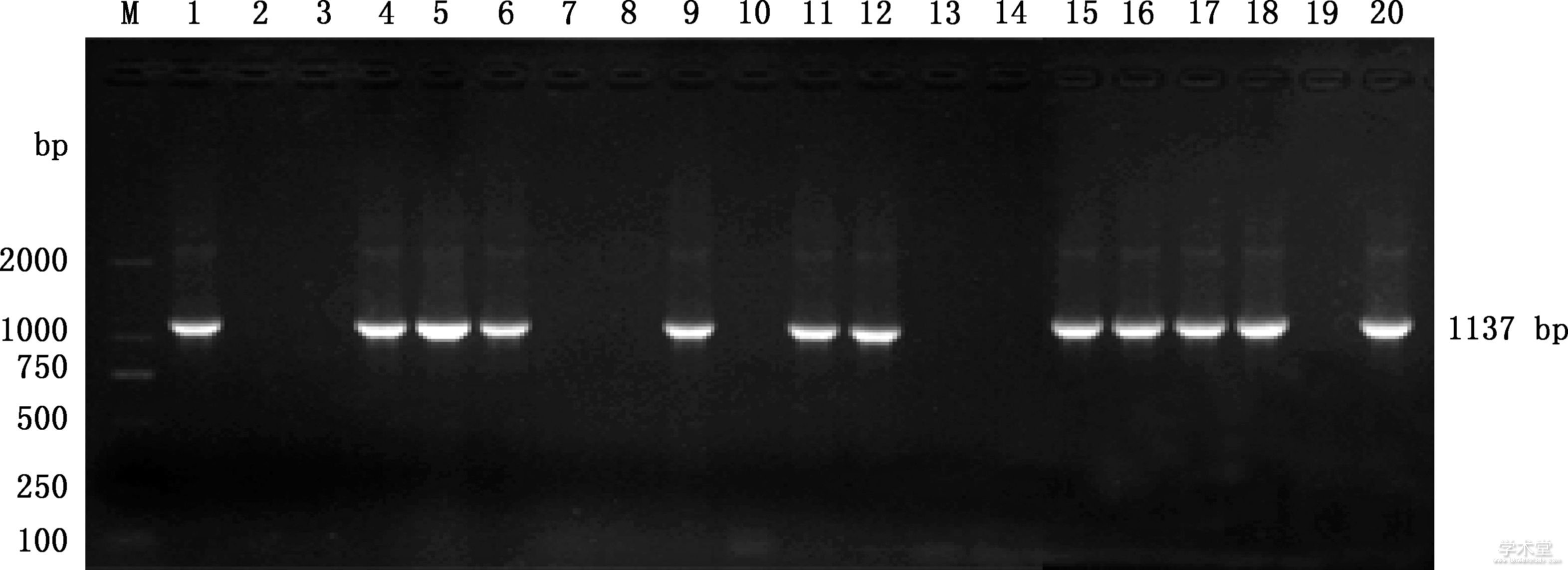
Fig.1 PCR amplification results of clinical materials
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~20,18份临床病料
M,DL2000 DNA Marker;1,Positive control;2,Negative control;3-20,18 clinical materials
2.2、 病毒的分离与培养
接种病料的LT细胞在接种3~4 d产生典型的细胞病变(CPE),11份阳性病料中有1份连续盲传至第5代仍具有典型CPE,表现为36 h左右长梭型细胞变圆、融合、皱缩,72 h左右大部分细胞脱落,对照组细胞生长良好(图2)。
2.3、 间接免疫荧光试验
将F5代细胞培养物接种LT细胞,48 h后,进行间接免疫荧光试验。结果显示,F5代细胞培养物接种细胞,胞浆中见特异性绿色荧光,且荧光呈绕核分布,对照细胞无荧光显示(图3)。
图2 细胞病变观察结果(100×)

Fig.2 Observation of CPE (100×)
A,对照细胞;B,感染阳性病料细胞培养物36 h的细胞;C,感染阳性病料细胞培养物72 h的细胞
A,Control cells;B,Cells infected with the positive material cell cultures for 36 h;C,Cells infected with the positive material cell cultures for 72 h
图3 间接免疫荧光结果(100×)
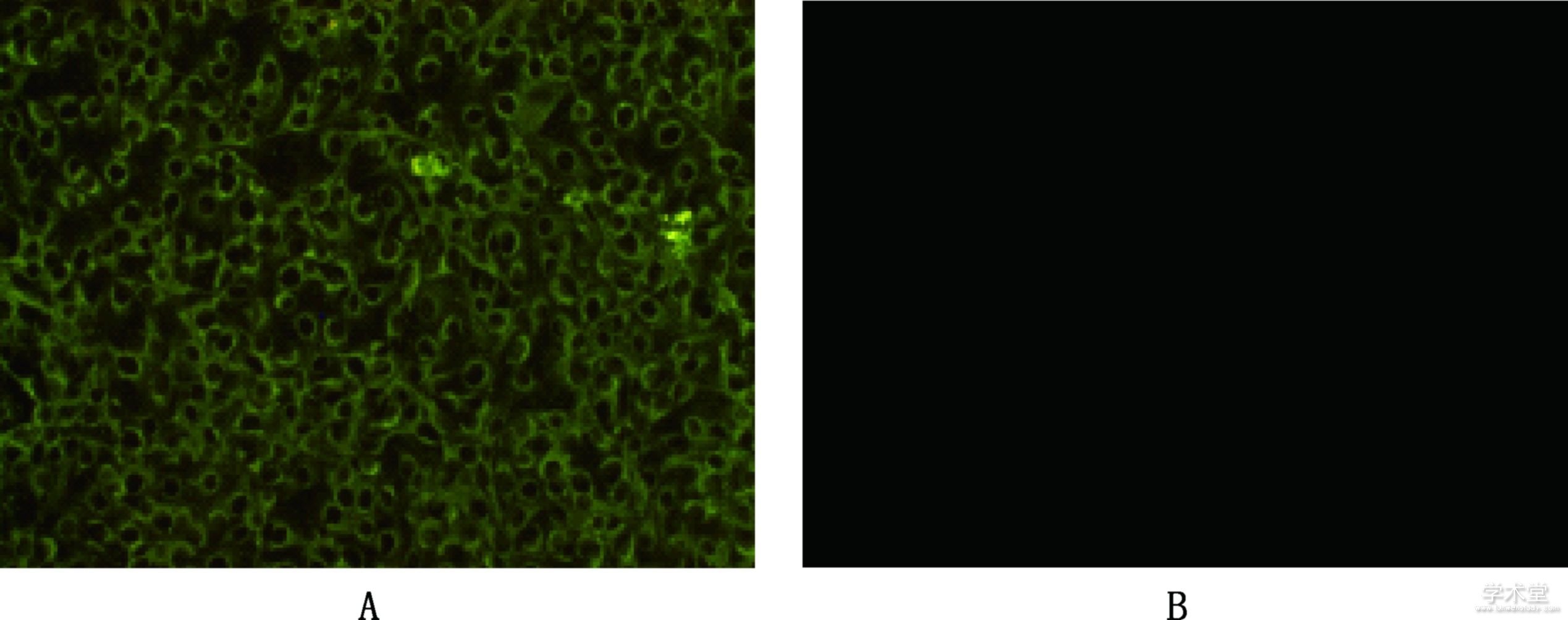
Fig.3 Results of IFA (100×)
A,感染阳性病料细胞培养物的LT细胞;B,对照细胞
A,LT cells infected with the positive material cell cultures;B,Control cells
2.4 、细胞培养物PCR鉴定及同源性分析
2.4.1 、细胞培养物PCR鉴定
提取细胞培养物DNA,采用设计的B2L基因特异性引物对F1~F5代细胞培养物基因组进行PCR扩增,经琼脂糖凝胶电泳显示接毒细胞基因组扩增出大小约1 137 bp的条带(图4),与预期目的片段大小一致。将PCR扩增产物回收后送至生工生物工程(上海)股份有限公司进行测序,采用DNAStar软件拼接获得序列长度为1 137 bp的核酸序列。
2.4.2 、细胞培养物PCR扩增产物核苷酸同源性比对
将分离株(ORFV-DZ)测序所获序列与GenBank中19株序列进行比对,由图5可知,同源性在97.9%~100%之间,与NZ2株、Shanxi株、Gansu株的同源性最低,为97.9%,与CQWZ株、Guizhou株和SCJY株同源性分别为98.5%、98.0%和98.1%,与SA00株同源性为100%。
图4 细胞培养物PCR鉴定结果
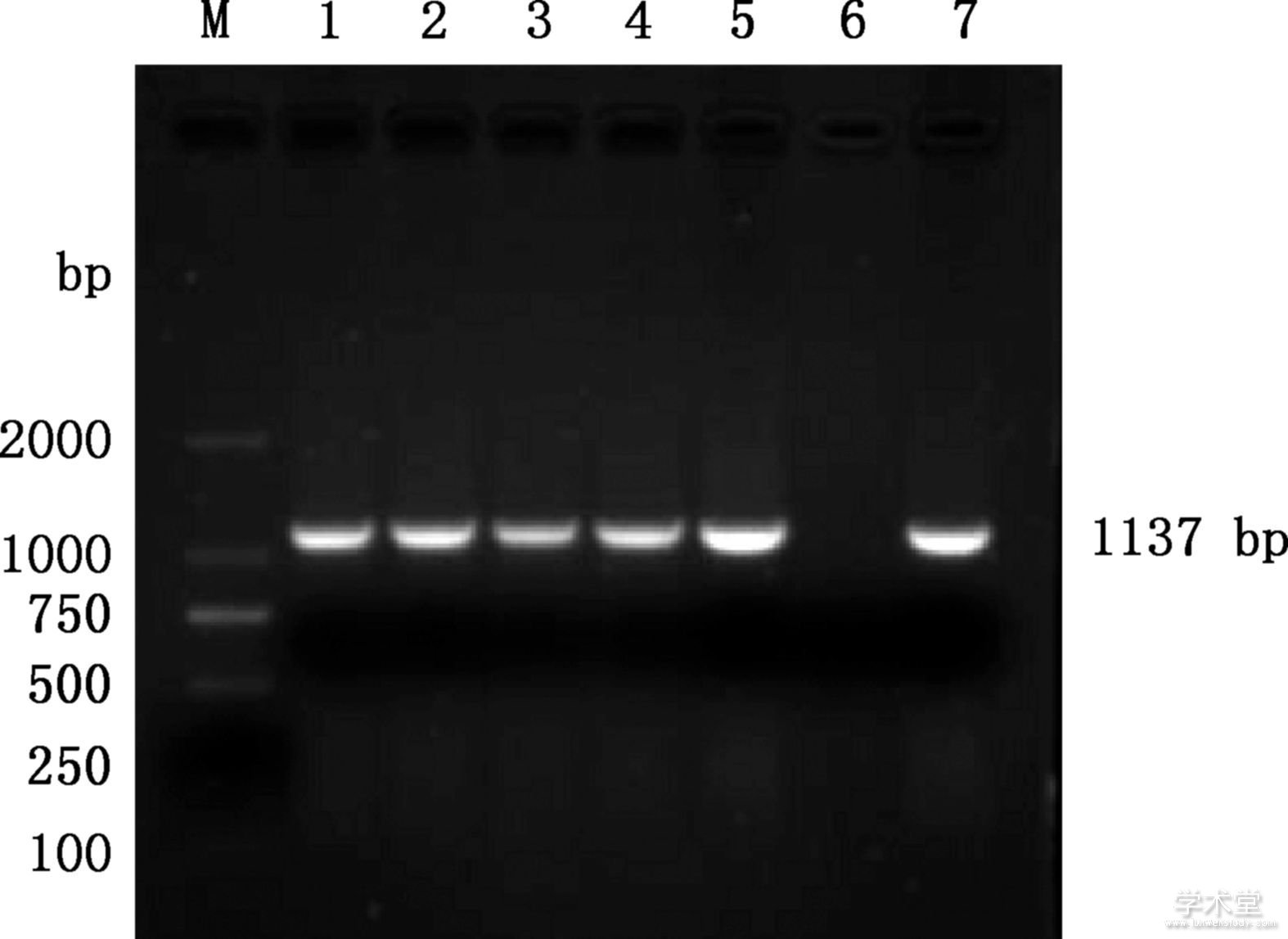
Fig.4 PCR identification of cell cultures
M,DL2000 DNA Marker;1~5,F1~F5代细胞;6,阴性对照;7,阳性对照
M,DL2000 DNA Marker;1-5,F1 to F5 generation cells;6,Negative control;7,Positive control
图5 ORFV-DZ株B2L基因核苷酸序列同源性分析
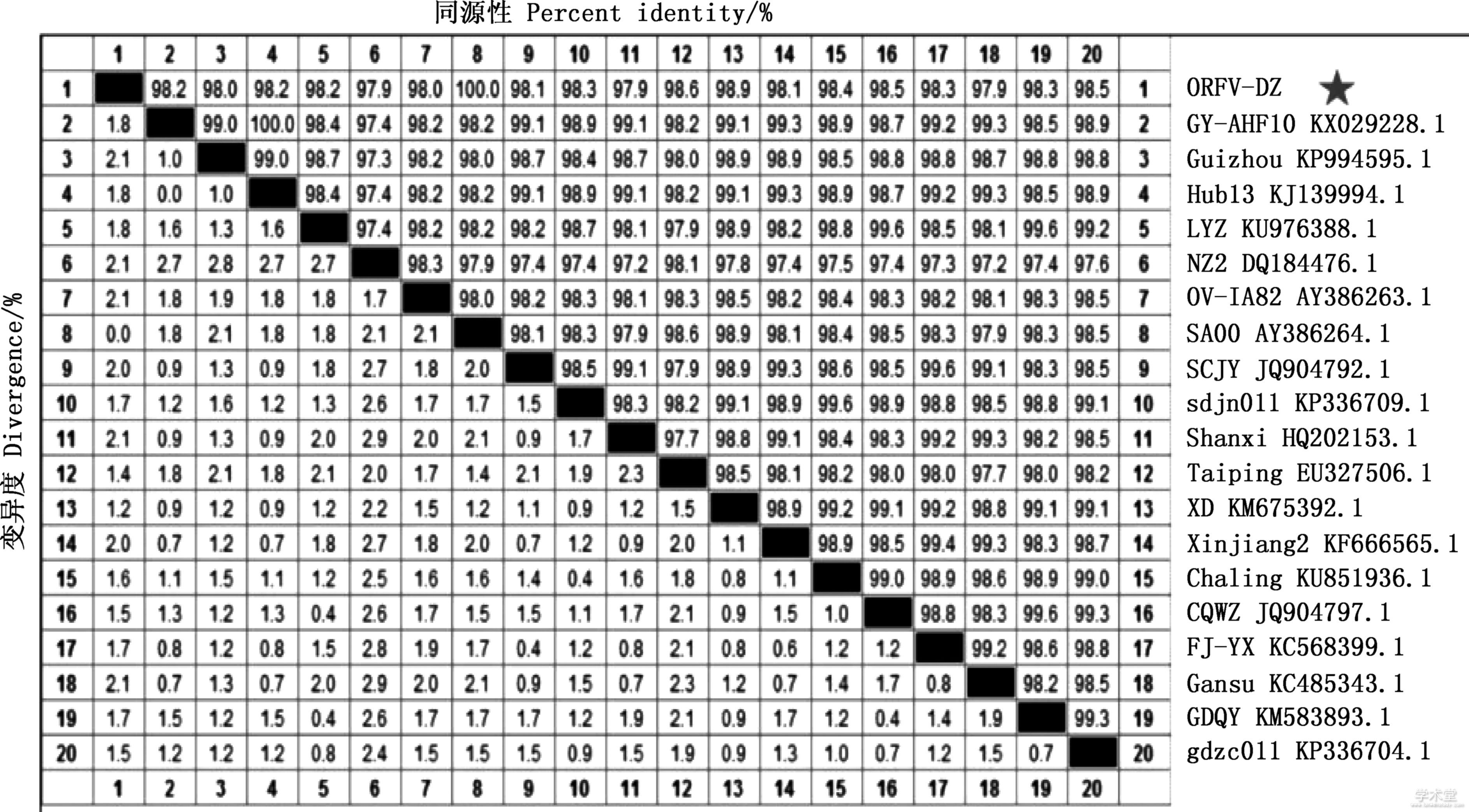
Fig.5 Nucleotide sequence homology analysis of B2L gene of ORFV-DZ strain
2.4.3 、遗传进化树构建
从GenBank下载的19株不同地区ORFV分离株,将所有的序列采用DNAStar 6.0软件中Editseq进行处理后,再用MegAlign绘制遗传进化树。结果显示,分离得到的毒株B2L基因与SA00株亲缘关系最近,并处于同一进化分支(图6)。
图6 ORFV-DZ株B2L基因核苷酸序列遗传进化分析
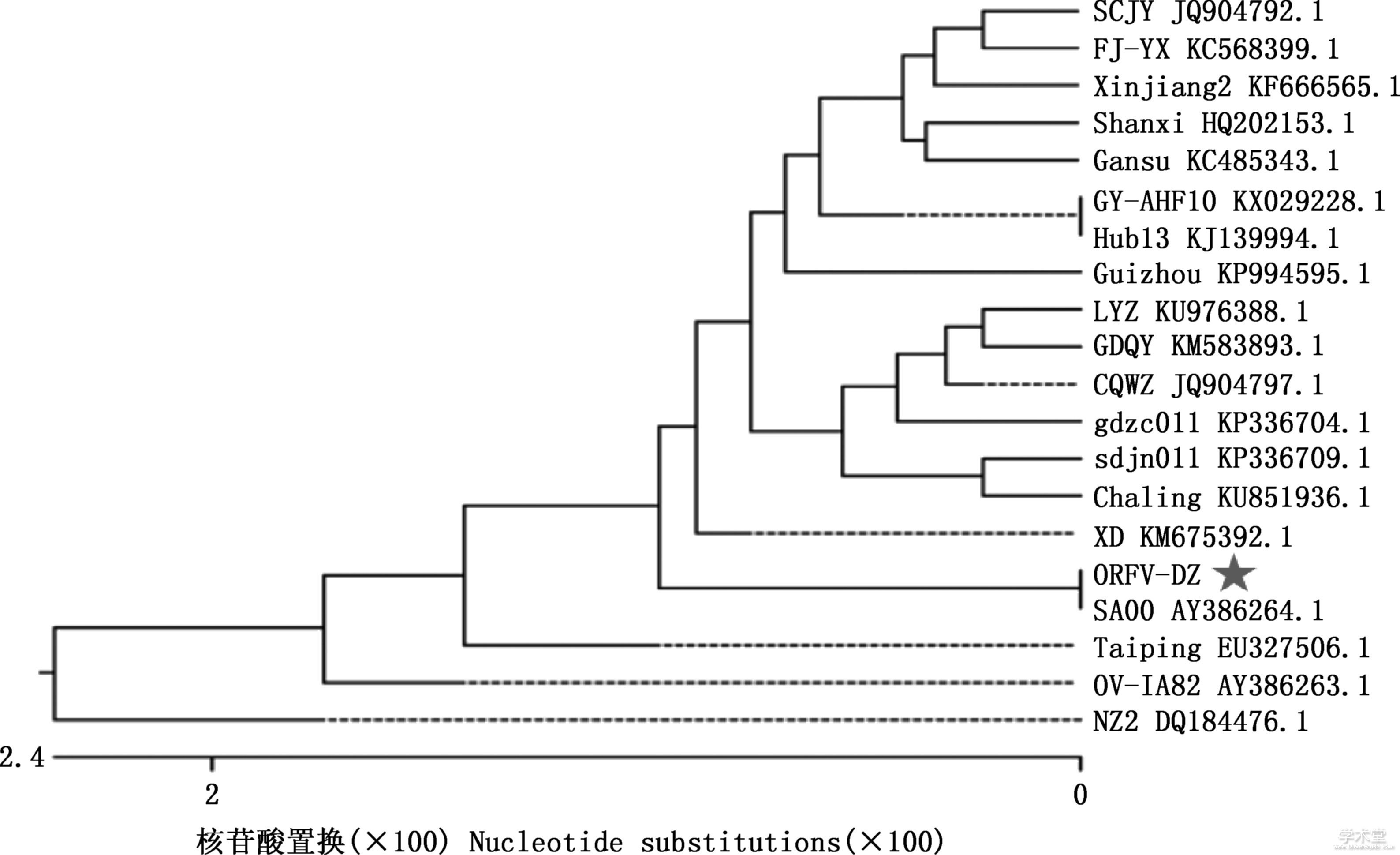
Fig.6 Phylogenetic analysis of B2L gene of ORFV-DZ strain
2.5 、细胞培养物F5代TCID50值测定结果
取F5代病毒液100 μL,按照 10-1至10-9 进行连续稀释,接种到LT细胞上,采用Reed-Muench法计算出F5代细胞毒液的TCID50值为10-5.68/0.1 mL。
3 、讨 论
ORFV属于痘病毒科副痘病毒属成员中的一员[15],呈世界性分布,在养羊国家和地区均有该病的发生与流行,严重影响中国畜牧养殖业的健康发展。由于ORFV变异性较强,病毒分离是诊断ORFV感染的最佳方式之一[16]。国内外许多学者对ORFV体外培养进行研究,ORFV可在多种原代细胞和传代细胞中增殖[17,18]。目前,常用的原代细胞系有羔羊睾丸细胞(LT)、犊牛睾丸细胞(BT)和鼻甲骨细胞(OFTu)等,常用的传代细胞系有MDBK、Vero和Hela细胞等。由于传代细胞对部份分离毒株不敏感,不易产生细胞病变(CPE),或连续传代后CPE逐渐消失的现象[19],因此BT和LT细胞常用于病毒的初次分离[20]。本研究采用LT细胞将11份阳性病料进行病毒分离培养,11份阳性病料中有1份连续盲传至F5代仍具有典型的CPE,36 h表现为细胞变圆、皱缩、聚堆融合,72 h后大部分细胞脱落,出现空洞现象,其他株接毒细胞未发生CPE,其原因可能与毒株的毒力大小和敏感性有关。随后,将F5代细胞培养物接种LT细胞,48 h后进行间接免疫荧光试验(IFA),同时将F1至F5代细胞培养物经PCR扩增等多种试验技术进行系统性鉴定,接种LT细胞,在胞浆中可清晰看见特异性绿色荧光,且荧光绕核均匀分布,并测定该分离毒株的TCID50,表明该毒株能在LT细胞中稳定增殖。该研究证实了重庆等地区存在羊口疮病的流行,这一结果不仅丰富了该地方的流行病学,同时也为ORFV免疫防控提供理论依据。
B2L蛋白是ORFV保护性抗原之一,可刺激机体产生大量的中和抗体和细胞免疫,主要引起机体IgG抗体水平升高,具有高度的免疫原性[21],因而该免疫保护基因备受国内外研究者关注。B2L基因位于ORFV基因组末端,具有高度保守性,因此常用于ORFV分子生物学诊断和遗传进化分析[22],但同时也给该病的防制带来极大的困难。本研究采用PCR扩增B2L基因并与国内外分离毒株进行同源性比对及遗传变异分析,遗传进化树显示重庆大足株(ORFV-DZ株)与美国分离株SA00亲缘关系最近,并处于同一进化分支,且核苷酸同源性达到100%,而与同一地区CQWZ株同源性为98.5%,与毗邻地区的Guizhou株和SCJY株同源性分别为98.0%和98.1%;与GenBank上其他毒株同源性均达97%以上,这一结果与沙娜瓦尔·塔希等[23]分离的2株ORFV有一定的相似性,均与国外的流行毒株亲缘关系较近,这表明ORFV在遗传上具有一定的差异性,导致这种差异性的原因可能是随着空间距离的扩大,ORFV在一定的环境进化过程中变异所致[24]。由此可见,ORFV在国内养羊地区流行较复杂,因此,对病毒的变异情况需持续监视。
近年来,羊口疮在中国养羊场的发生率持续增加,目前还没有治疗该病的特效药物,疫苗接种是防制该病的重要手段[25,26]。国内市场上已有弱毒细胞冻干活疫苗出售,但由于人们对羊口疮的危害认识淡薄,导致该疫苗未能大量生产[27],因此,疫苗研制仍需努力。
4、 结 论
本试验从重庆不同地区养羊场采集疑似羊口疮病料,将阳性病料接种LT细胞,经间接免疫荧光试验、PCR扩增、测序和TCID50测定,并与GenBank上19株不同分离株ORFV B2L基因进行同源性比对分析,成功分离出1株ORFV,命名为ORFV-DZ株。今后将通过对重庆等地区进行ORFV流行病学调查,为制定ORFV防制措施提供理论依据。
参考文献
[1] 陈晓.上海株ORFV双基因重组腺病毒的构建及免疫原性研究[D].锦州:锦州医科大学,2018.CHEN X.Construction and immunogenicity of recombinant adenovirus containing double genes of ORFV Shanghai strain[D].Jinzhou:Jinzhou Medical University,2018.(in Chinese)
[2] YU Y,TAN Q,ZHAO W,et al.Characterization of an orf virus isolate from an outbreak in Heilongjiang province,China[J].Archives of Virology,2017,162(10):3143-3149.
[3] KUMAR N,WADHWA A,CHAUBEY K K,et al.Isolation and phylogenetic analysis of an orf virus from sheep in Makhdoom,India[J].Virus Genes,2014,48(2):312-319.
[4] 孙正楠,毛从剑,张焕容.山羊口疮病毒四川分离株F1L基因分子特征分析及抗原表位预测[J].中国畜牧兽医,2018,45(7):1942-1948.SUN Z N,MAO C J,ZHANG H R.Molecular characteristics analysis and antigen epitope prediction of F1L gene of orf virus isolate from Sichuan[J].China Animal Husbandry & Veterinary Medicine,2018,45(7):1942-1948.(in Chinese)
[5] 尚辰,黄勇,张秀娟,等.陕西关中某羊场羊口疮病毒的分离鉴定与基因序列分析[J].西北农业学报,2014,23(12):25-32.SHANG C,HUANG Y,ZHANG X J,et al.Isolation and identification of orf virus Shaanxi Guanzhong and sequence analysis of B2L,F1L and VIR genes[J].Acta Agriculturae Boreali-occidentalis Sinica,2014,23(12):25-32.(in Chinese)
[6] YANG Y,QIN X D,WANG G X,et al.Development of an isothermoal amplification-based assay for rapid visual detection of an orf virus[J].Virology Journal,2016,13(1):46.
[7] ZHAO K,SONG D G,HE W Q,et al.Identification and phylogenetic analysis of an orf virus isolated from an outbreak in sheep in the Jilin province of China[J].Veterinary Microbiology,2010,142(3-4):408-415.
[8] 何建斌.羊口疮病毒陕西株B2L基因的克隆表达及间接ELISA检测方法的建立[D].杨凌:西北农林科技大学,2017.HE J B.Cloning expression of B2L gene of ORFV Shanxi strain and establishment of indirect ELISA for detection of seral antibodies[D].Yangling:Northwest A & F University,2017.(in Chinese)
[9] MURAT ?.Orf virus circulation in cattle in Turkey[J].Comparative Immunology,Microbiology and Infectious Diseases,2019,65:1-6.
[10] AHANGER S A,PARVEEN R,NAZKI S,et al.Detection and phylogenetic analysis of orf virus in Kashmir Himalayas[J].Virus Disease,2018,29(3):405-410.
[11] MARTINS M,JOSHI L R,RODRIGUES F S,et al.Immunogenicity of ORFV-based vectors expressing the rabies virus glycoprotein in livestock species[J].Virology,2017,511:229-239.
[12] 石正旺,刘华南,胡永浩,等.羊口疮病毒B2L基因的原核表达、纯化及反应原性分析[J].甘肃农业大学学报,2016,51(6):1-5.SHI Z W,LIU H N,HU Y H,et al.Prokaryotic expression,purification and reactogenicity of ORFV B2L gene[J].Journal of Gansu Agricultural University,2016,51(6):1-5.(in Chinese)
[13] CHI X L,ZENG X C,LUO S H.Diagnosis and phylogenetic analysis of a multifocal cutaneous orf virus with mixed bacterial infection outbreak in goats in Fujian province,China[J].Archives of Virology,2017,162(10):2997-3006.
[14] 葛士坤,张凯照,鲁荣,等.2006-2016年中国羊口疮病毒的遗传演化分析[J].中国畜牧兽医,2018,45(2):439-447.GE S K,ZHANG K Z,LU R,et al.Genetic and phylogenetic analysis of orf virus isolated in China from 2006 to 2016[J].China Animal Husbandry & Veterinary Medicine,2018,45(2):439-447.(in Chinese)
[15] BALA J A,KRISHNAN N B,ASHWAQ A A,et al.The re-emerging of orf virus infection:A call for surveillance,vaccination and effective control measures[J].Microbial Pathogenesis,2018,120:55-63.
[16] 曾显成,陈珍珍,林心宇,等.羊口疮病毒的分离鉴定及F1L基因的遗传变异分析[J].中国兽医学报,2019,39(5):860-866.ZENG X C,CHEN Z Z,LIN X Y,et al.Isolation and identification of an ORFV strain and genetic variation analysis of F1L gene[J].Chinese Journal of Veterinary Science,2019,39(5):860-866.(in Chinese)
[17] TIAN H,CHEN Y,WU J Y,et al.Identification and function analysis of the host cell protein that interacted with orf virus Bcl-2-like protein ORFV125[J].Research in Veterinary Science,2016,108:93-97.
[18] ANDREA P,ROBLES C A,MICHELUOD J F,et al.Phylogenetic analysis of ORF viruses from five contagious ecthyma outbreaks in Argentinian goats[J].Frontiers in Veterinary Science,2018,5:134.
[19] 周祺,顾香雪,许泽军,等.抗羊口疮病毒囊膜蛋白B2L小鼠多克隆抗体的制备和应用[J].细胞与分子免疫学杂志,2018,34(11):1036-1040.ZHOU Q,GU X X,XU Z J,et al.Preparation and application of anti-envelope protein B2L mouse polyclonal antibody of ORF virus[J].Chinese Journal of Cellular and Molecular Immunology,2018,34(11):1036-1040.(in Chinese)
[20] 郭锐,田永祥,周丹娜,等.羊口疮病毒湖北株B2L基因的克隆与遗传进化分析[J].中国兽医杂志,2017,53(2):37-39.GUO R,TIAN Y X,ZHOU D N,et al.Cloning and phylogenetic analysis of B2L gene of orf virus isolated in Hubei[J].Chinese Journal of Veterinary Medicine,2017,53(2):37-39.(in Chinese)
[21] 向蓉,翟少伦,王晓虎,等.羊口疮病毒ORFV/GD-QY/01株的分离鉴定[J].广东农业科学,2018,45(9):116-120.XIANG R,ZHAI S L,WANG X H,et al.Isolation and identification of orf virus ORFV/GD-QY/01 strain[J].Guangdong Agricultural Sciences,2018,45(9):116-120.(in Chinese)
[22] 王秋霞,朱相儒,易成功,等.江苏省羊口疮病毒的分离鉴定及B2L基因的遗传进化分析[J].中国畜牧兽医,2017,44(4):950-958.WANG Q X,ZHU X R,YI C G,et al.Isolation and identification of orf virus from Jiangsu province and phylogenetic analysis of their B2L gene[J].China Animal Husbandry & Veterinary Medicine,2017,44(4):950-958.(in Chinese)
[23] 沙娜瓦尔·塔希,买买提艾力·斯迪克,比力克孜·阿不都热依木,等.新疆南疆地区羊口疮病毒的分离鉴定及其遗传进化分析[J].草食家畜,2018,1:26-32.SHANAWAER·T,MAIMAITIAILI·S,BILIKEZI·A,et al.Isolation and identification of ORF Virus strain and phylogenetic analysis[J].Grass-Feeding Livestock.2018,1:26-32.(in Chinese)
[24] 于永忠,段旭阳,刘圆圆,等.羊口疮病毒OV-HLJ05株及其VEGF毒力因子的遗传特征[J].病毒学报,2019,35(4):622-632.YU Y Z,DUAN X Y,LIU Y Y,et al.An OV-HLJ05 isolate of the ORFV and genetic characteristics of VEGF[J].Chinese Journal of Virology,2019,35(4):622-632.(in Chinese)
[25] 张高峰,杨侃侃,张谦,等.羊口疮病毒安徽株023基因的原核表达与生物信息学分析[J].浙江农业学报,2019,31(1):30-38.ZHANG G F,YANG K K,ZHANG Q,et al.Prokaryotic expression and bioinformatics analysis of orf virus Anhui strain 023 gene[J].Acta Agriculturae Zhejiangensis,2019,31(1):30-38.(in Chinese)
[26] ZHONG J W,GUAN J Y,ZHOU Y L,et al.Genomic characterization of two orf virus isolates from Jilin province in China[J].Virus Genes,2019,55(4):490-501.
[27] 李婷,包细明,鲜思美,等.羊IL-2和OrfV-F1L基因疫苗联合免疫小鼠的免疫应答研究[J].中国兽医科学,2019,49(7):924-931.LI T,BAO X M,XIAN S M,et al.Study on immune response in mice inoculated jointly with IL-2 gene vaccine and OrfV-F1L gene vaccine[J].Chinese Veterinary Science,2019,49(7):924-931.(in Chinese)





