
水貂阿留申病 (Aleutian disease of mink,ADM)又称浆细胞增多症(Plasmacytosis),是由阿留申病毒(Aleutian mink disease parvovirus,AM-DV)感染引起的水貂自身免疫系统功能紊乱,并发自身免疫的慢性、传染性疾病。该病目前在加拿大、美国、俄罗斯及中国等水貂饲养国家广泛流行,给水貂养殖业造成严重的经济损失。AMDV为细小病毒科(Parvovirinae)成员,与该科其他病毒一样具有较高的遗传多样性,这导致病毒的感染谱不断增加:从最初的仅阿留申型水貂易感到几乎所有水貂都易感,再到最近乌苏里貉,甚至人类也可感染AMDV,使人们对本病的发病机理及其具体机制再度关注。
1 AMDV感染的ADE现象
ADM发病机制复杂,病毒主要侵害机体的单核-巨噬细胞系统。病毒在机体的免疫器官与免疫细胞中增殖,多分布于脾脏、肠系膜淋巴结、单核细胞及骨髓细胞中,引起体内CD8+T淋巴细胞增多、单核细胞浸润、浆细胞弥漫性增生,机体体液免疫反应强烈,感染动物体内产生大量抗病毒抗体及自身抗体,然而,病毒再次感染时,体内存在的抗体无法中和病毒,而是产生严重的免疫复合物疾病和高γ球蛋白血症,造成血管炎及肝、肾损伤,使感染进一步加重,该现象称为病毒的抗体依赖性感染增强作用(Antibody-dependent en-hancement,ADE),即特异性抗体的存在可增强病毒的感染,这也是AMDV致宿主免疫功能紊乱及疫苗免疫失败的主要原因。
2、 ADE作用机制
正常情况下,病毒感染细胞后,机体通过病原相关分子模式 (Pathogen-associated molecular pat-terns,PAMPs)识别病原体,促进下游干扰素和细胞因子的分泌,激活抗病毒因子的表达,启动先天性免疫应答。随后,获得性免疫可使机体产生能够识别和中和病毒的抗体,清除病原,抑制感染。然而,在ADE感染中,病毒却可逃避或克服先天性免疫应答,并通过与抗病毒抗体结合,形成病毒-抗体复合物,该复合物结合在免疫细胞(如单核/巨噬细胞)表面,通过特定的机制促进病毒的增殖,此外,机体内循环的免疫复合物还可造成慢性病变及器官损伤,使感染加剧。因此,ADE感染作用的形成及调控机制一直是研究人员所关注的重要科学问题。
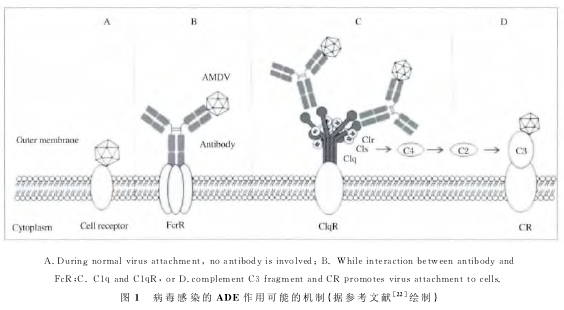
研究表明AMDV的衣壳蛋白VP2与Fc受体蛋白FcγR II结合介导ADE途径:Dworak等仅在阳性表达FcR的K562细胞发现ADE现象,鼠FcR特异性单克隆抗体可阻断约90%的病毒对FcR阳性细胞上的感染,该感染过程经在猫肾细胞CrFK上实验证实为AMDV衣壳蛋白VP2激活Caspase信号途径,且激活的Caspase7在D420位点切割VP2蛋白,而切割后的一小段短肽VP2:428~446介导了ADE、细胞内化过程及免疫复合物的形成。此外,针对VP2:487-501的抗体也具有有限的凝集病毒粒子,形成复合物,介导ADE的 能力。
2.1受体介导的吸附促进机制
在ADE研究初期,人们曾一度认为病毒滴度的增加(有时可达到102到103倍)是免疫复合物结合FcγI和FcγIIa受体导致的,例如,西尼罗河病毒 (West nile virus,WNV)—抗体复合物在鼠巨噬细胞样细胞上的吸附较裸病毒有较显著性地增加。在这一作用机制中,抗体Fc片断与免疫系统的细胞(包括巨噬细胞、单核细胞、B细胞、嗜中性白细胞和粒细胞)表面FcR相互作用,使病毒—抗体复合物黏附于细胞表面,细胞对病毒的摄入和内在化增强,随后,由于病毒不能被立即灭活,导致病毒在细胞内的复制并随之扩散 (图1)。包括AMDV在内的多种病毒如WNV、猪繁殖与呼吸障碍综合症病毒(Porcine re-productive and respiratory syndrome virus,PRRSV)、登革热病毒(Dengue virus,DENV)、呼吸道合胞病毒(Respiratory syncytial virus,RSV)、人免疫缺陷病毒(Human immunodeficiency virus,HIV)等多种病毒感染引起的ADE皆依赖于FcR途径。
此外,研 究者还在埃博拉病毒 (Ebola virus,EBOV)、黄病毒属病毒WNV和日本脑炎病毒(Japanese encephalitis virus,JEV)中鉴定了另两种介导ADE作用的免疫分子:补体C1q和C3。这两种蛋白与其细胞表面受体结合同样促进了复合物与细胞的结合与内化过程(图1)。在此机制与Fc受体介导ADE相似:病毒激活补体经典途径,产生C3分子片段,病毒表面受体、C3及补体受体三者形成复合物促进病毒的内化过程,或者病毒与补体成分C1q结合形成复合物,促进感染。
与AMDV情况不同,多数具有ADE现象的病毒中,被动免疫产生的高浓度抗病毒抗体能很好地中和并清除病毒,而亚中和浓度的抗体则介导ADE,针对这种现象的一种解释是亚中和浓度抗体未完全封闭病毒表面结合细胞受体的表位,抗原—抗体复合物结合在细胞表面,促进病毒与细胞表面受体结合的机会,促进了病毒的更有效地吸附和内化。
2.2模式识别受体负调控因子上调机制
当免疫复合物与FcγR(FcγRI、FcγRIIa或FcγRIIb)结合后,使病原模式识别(Pathogen pattern recognition)信号途径的负调控因子上调,这些因子包括脱氧腺苷激酶(deoxyadenosine kinase,DAK)、抗原5(an-tigen 5,自噬相关基因 [Atg5-Atg12]复 合 物)、SARM(Sterile alpha-and armadillo-motif-contai-ning protein)、TRAF家族成员相关NF-κB激活蛋白(the TRAF family member-associated NF-κB ac-tivator,TANK)。这些因子的上调使RIG-I样受体(RIG-I-like receptors,RLR)途径及其信号通路媒介物维甲酸诱导基因I/黑色素瘤分化相关基因5(Retinoid acid-inducible gene I/melanoma differen-tiation-associated gene 5,RIG-I/MDA5)表达受抑制,减弱RIG-I/MDA5信号通路,同时Toll样受体3(Toll like receptor3,TLR3)、TLR4及TLR7表达受阻,导致I类干扰素(IFNα/β)产生及其介导的促炎症相关细胞因子表达下降,促进了病毒在细胞中的快速复制和增殖。
2.3 IL-10早期活化机制
IL-10是一个具有重要免疫调节功能的抗炎细胞因子,可下调或抑制包括炎症反应因子等在内的多种细胞因子的表达。其对免疫系统的调节作用包括:抑制先天性免疫反应,抑制Th1型淋巴细胞应答,促进Th2型细胞因子表达,使机体体液免疫反应占主导地位。
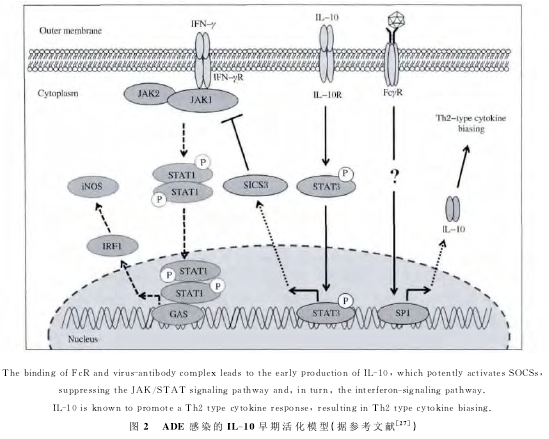
IL-10在病毒ADE感染中发挥至关重要的调节作用,其调节机制可能为病毒-抗体复合物与细胞表面受体结合后激活IL10的早期表达,高水平的IL-10激活细胞因子信号抑制因子(Suppressor ofcytokine signaling,SOCS)系 统,SOCS3和/或SOCS1抑制干扰素信号通路 (JAK/STAT信号途径),抑制先天性抗病毒免疫反应,实现感染增强作用。在该感染增强作用过程中,IL-10通过以下两个机制发挥调控作用:通过抑制干扰素介导的抗病毒因子的分泌,抑制先天性免疫抗病毒效应,促进病毒增殖;IL-10通过促进Th2型细胞因子表达,增强体液免疫反应,产生的抗体却不能中和病毒,进一步介导ADE作用,整个过程可总结如下图2所示。
2.4 IL-6与AMDV的ADE作用
水貂AMDV急性感染和ADE感染可引起强烈的免疫病理变化,这点与人类的Castleman病(Castleman’s dis-ease,CD)类似,这两种疾病都有相似的浆细胞增多症、多克隆高γ-球蛋白血症、脾肿大、淋巴结病、膜性增生性肾小球肾炎等临床症状。IL-6在CD中发挥重要作用,而ADM与CD又如此的相似,那么,IL-6是否参与了AMDV的ADE作用?抑或是ADE的一个效应因子,参与了AMD的发病过程?
Bloom等首先在非组成型表达IL-6的巨噬细胞系U937细胞中研究发现,ADE感染可刺激细胞表达IL-6mRNA。体内实验证实,AMDV感染水貂10d和60d后,IL-6的浓度随着疾病的发展而升高。我们推测,IL-6参与ADM的具体机制可能与其生物学特性有关,IL-6具有多效性,可刺激B细胞末端分化为分泌球蛋白的浆细胞。从这个角度考虑,就解释了IL-10与IL-6在ADM中的作用,在ADE感染中,早期的IL-10分泌促进了Th2型细胞因子表达,Th1/Th2免疫失衡,IL-6分泌升高,导致高γ-球蛋白血症及浆细胞增多症。同时,有研究表明,IL-6在多发性骨髓瘤、细膜增生性肾小球肾炎中也发挥着重要作用,具体机制尚待探讨。
3、 ADE对疫苗研制的参考
ADM多年来一直是威胁养貂业的三大疫病之一,原因是缺乏有效的疫苗,其根源在于ADE,多个研究表明,灭活的全病毒抗原或亚单位蛋白抗原被动免疫后,水貂不能抵抗病毒的攻击,反而会导致病情加重。因此,在疫苗设计上必须根据相应机制,避开ADE作用,应用反向遗传操作构建基因缺疫苗,缺失或修饰病毒上的ADE表位将是AMD疫苗研究的新方向。另一方面,为避免Th1/Th2免疫失衡造成的病理损伤,在疫苗设计时,可以人为引入相应的调节因子,调节免疫平衡,减少ADE造成的免疫损伤和病理变化。无论应用哪种方法,在疫苗的研制、免疫保护性及安全性评价时都应建立相应的模型,考虑ADE因素对疫苗效果的影响。
4、结语
AMDV ADE感染的宿主机制一直没有很好地阐明,主要是由于缺乏较理想的细胞适应毒和细胞感染模型,特别是病毒对单核-巨噬细胞的感染模型,虽然已有相关探索研究,但在巨噬细胞系U937上建立了相关感染模型,却未成功。因此,在缺乏合适病毒和细胞系的前提下,ADE机制的研究还需要更多的数据和线索。
到目前为止,参与ADE过程的水貂FcR家族蛋白以及表达该受体的细胞还未完全研究清楚。有研究表明,ADE感染可导致多种细胞外抗病毒介质如肿瘤坏死因子 (Tumor necrosis factor alpha,TNF-α)、一氧化氮合酶2(Nitric oxide synthase 2,NOS2)及干扰素调节因子 (Interferon-regulatoryfactor 1,IRF-1)多种细胞因子上调或受抑制。宿主遗传多样性、宿主细胞类型特异性及免疫应答反应对AMDV感染的ADE作用有一定的影响,包括DC细胞的成熟度、促炎细胞因子和抗炎细胞因子的上调和(或)下调、趋化因子及相关信号途径分子的表达变化在病毒致病过程中发挥着 一定作用。哪些宿主基因,特别是先天性免疫应答基因的差异表达参与调控AMDV的ADE感染过程是将来研究要揭示的重要问题。借助现代技术差异表达技术如转录组学、蛋白差异组学,细胞因子组学等技术可揭示参与该过程宿主的先天性免疫应答基因及信号途径蛋白。该方面的研究对揭示该病毒ADE感染的宿主因素、明确其感染机制有重要的科学意义。





