
前言
肝星状细胞(hepatic stellate cell,HSC)活化及向肌成纤维母细胞(myofibroblast,MFB)转化是肝纤维化形成的中心环节,但机制复杂。既往对HSC基因表达及其调控的研究,主要集中于mRNA的编码区;然而,非编码小分子RNA在基因表达调控中的关键作用突破了传统的观点。微小RNA(microR-NA,miRNA)是一种长度约为22核苷酸(nucleotide,nt)内源性的非编码RNA,它们通过种子序列端"碱基互补"导致靶mRNA降解及抑制蛋白质的合成,在转录后水平调控靶基因的表达。miRNA在生物的生理调控和疾病的发生过程中具有非常重要的作用,通过高度时序性、组织特异性的表达,精细调节机体内30%~40%基因编码蛋白,尤其是绝大多数信号通路下游分子的水平,并参与几乎所有生命活动及疾病过程,包括细胞增殖和凋亡、生长发育、脂肪代谢及肿瘤发生等,处于基因调控网络的核心位置。本实验将模拟内源性miRNA体内生成的生物过程,以RNA聚合酶‖启动子的质粒作为载体,在该启动子的下游插入miR-126编码序列,构建慢病毒miR-126表达载体,通过过表达技术体外转染肝星状细胞后可望获得稳定而持久的目的基因表达,从而为miR-126在肝纤维化发病过程中靶点验证和功能研究奠定实验基础。
1、材料与方法
1.1材料
慢病毒表达系统(system biosciences,SBI,Cat.#Lv500A):包括慢病毒包装质粒如pPACK包装质粒混合物lentivirus package plasmid mix(system biosciences,Cat.#Lv500A-1)、慢病毒表达载体pCDH-CMV-MCS-EF1-copGFPTM;大肠杆菌DH5α:上海生工生物工程有限公司产品;293TN细胞株:Sys-tem Biosciences美国公司产品;质粒DNA抽提试剂盒:德国Qiagen公司;UNIQ-10柱式动物基因组DNA提取试剂盒:辽宁大连宝生物公司产品;DNA凝胶回收试剂盒:大连宝生物(TaKaRa)工程有限公司;Trizol Lipofectmaine2000:美国In-vitrogen公司产品;葡萄糖,蛋白胨,酵母提取物,琼脂粉:英国Oxoid公司产品;PCR试剂、T4连接酶、2000bpDNA分子量marker:日本TaKaRa公司产品;Dulbecco Modified Eagle Medi-um(DMEM):美国Gibco公司产品;逆转录试剂盒:美国Promega公司。
1.2方法
1.2.1引物的设计与合成根据mir-126序列信息(Sangermi RBase数据库收录)设计引物如下:上游引物5'-GC-GAATTCCAGAGGGCAGCTAGCCCT-3',下游引物5'-GCG-GATCCAAGCCTCACCTGTTCT-3',下划线为酶切位点,上游引物的酶切位点为EcoRI,下游为BamHI,引物由上海英骏生物技术有限公司合成。
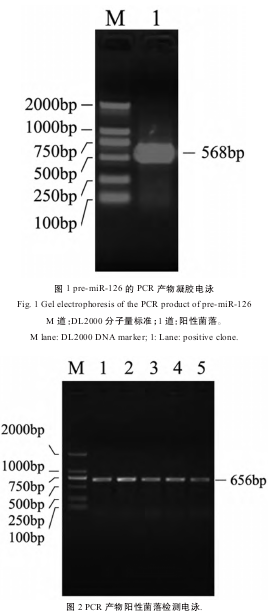
1.2.2PCR扩增按照试剂盒说明书操作,以大鼠基因组DNA为模板,PCR扩增得到约568bp的片段,PCR反应条件如下:94℃2min;94℃30s,55℃30s,72℃40s,30个循环。PCR产物取5μL进行2%琼脂糖凝胶电泳,检测扩增条带大小,按琼脂糖凝胶回收试剂盒说明书回收目的片段,回收产物使用紫外分光光度计测定浓度,-20℃保存待用(图1)。
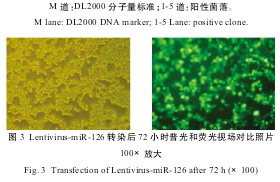
1.2.3重组慢病毒表达载体miR-126的连接、序列鉴定及其病毒滴度测定对质粒表达载体(pcDNA-copGFP vector)以及回收的PCR片段进行酶切线性化处理,将退火后稀释产物和经过线性化处理的载体连接于22℃连接2小时,转化E.coliDH5α感受态细胞,使用无菌牙签挑取5个单菌落,使用载体多克隆位点两端的引物进行PCR扩增检测阳性菌落,PCR产物5μL进行2%琼脂糖凝胶电泳,检测扩增条带大小(图2)。
DNA序列鉴定由上海英骏生物技术有限公司进行。复苏293TN细胞,培养24h后进行慢病毒miR-126转染。使用病毒梯度稀释法进行病毒滴度测定,倒置荧光显微镜下观察GFP的表达(图3),比较GFP阳性率。
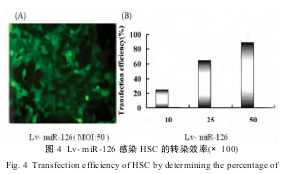
1.2.4体外转染慢病毒miR-126细胞分组如下:HSC组(blank组);HSC+慢病毒载体(Lv-GFP组);HSC+重组慢病毒载体(Lv-miR-16,MOI:10组);HSC+重组慢病毒载体(Lv-miR-16,MOI:25组);HSC+重组慢病毒载体(Lv-miR-16,MOI:50组)。以上3-6组分别组按感染复数(MOI)值感染HSC,步骤如下:复苏HSC-T6到6孔培养板;24h后换液,更换培养液为不同MOI的转染液,对照组中则添加新鲜的DMEM过夜培养;转染24h后,追加5mL培养液(DMEM+10%FBS);72h后全部换成基础培养液培养;荧光显微镜下进行观察,比较感染效率;取最佳MOI值得细胞组进行后续实验(图4)。
1.2.5实时荧光定量PCR(RealtimePCR)方法检测各组感染后HSC细胞中miR-126的表达各组细胞转染后3d行Real-timePCR检测miR-126基因的表达,取1μg总RNA按逆转录试剂盒说明书操作合成cDNA第一链,取2μL逆转录产物为模板进行PCR扩增。预扩增基因名称、引物序列、退火温度、产物长度如表1。(图5)。

1.3统计学分析。
所有实验数据均采用SPSS11.0统计软件和SAM(version2.1)软件包处理,各组数值均以均数±标准差表示,t检验比较两样本的均数,方差分析进行组件比较,P<0.05具有统计学意义。
2、结果。
2.1pre-miR-126的PCR扩增
2%琼脂样凝胶电泳,110V恒压15分钟,PCR(mir126)=568bp,检测值与理论值完全相符。
2.2PCR鉴定阳性克隆及测序鉴定
2%琼脂糖凝胶电泳,被检测的5个菌落均为阳性菌落。阳性菌落对应的PCR产物长度=PCR(mir126)=656bp=568bp(PCR产物)-4bp(保护碱基)+92bp(载体多克隆位点两端部分)。紫外分光光度检测纯度OD260/OD280:1.89和浓度为1.20μg/μl。测序鉴定图谱结果与设计序列一致,未发现点突变。
2.3慢病毒的包装及滴度测定
慢病毒颗粒体外293TN细胞后,倒置荧光显微镜下可见GFP的表达(图3),荧光细胞数随稀释倍数的增加而减少,通过病毒的滴度计算公式计算:病毒滴度=(10/10)×105=1×105i-fu/μL=1×108ifu/mL。
2.4不同MOI值Lv-126感染HSC的转染效率的观察
Lv-miR-126慢病毒载体体外转染HSC-T6后,荧光显微镜下比较各组转染率(图4)分别为:20.6±2.5%(MOI=10);69.7±3.6%(MOI:25);86.1±1.4%(MOI:15);98.3±2.7%(MOI:50)。结果显示,随着MOI值的增加,转染率随之增高。当MOI为50时,细胞生长状态佳,阳性率在95%以上。说明慢病毒Lv-miR-126体外转染最佳量效比为MOI:50,因此,我们选择MOI值50作为后续实验的MOI值。
2.5Realtime、PCR检测miR-126的表达
图5显示miR-126转染后miR-126表达分析结果。MOI为50时重组慢病毒体外转染效率高,miR-126转染后获得了较高的表达。

3、讨论
miRNAs是一类在进化上高度保守、长度约22nt的非编码RNA,位于基因表达上游的调控元素。成熟的miRNA能通过完全互补或不完全互补方式与mRNA3'非编码区结合,特异性抑制靶基因的翻译活性,在转录后水平调节靶基因的表达。miRNA表达异常会导致生理的异常及疾病的发生与进展,研究表明,非编码小分子RNA在基因表达调控中发挥关键的作用,参与并调控细胞的生长、增殖、凋亡等生物学行为。miR-126及其互补相似物miR-126*是目前最受关注与血管生成有关的基因表达调控因子,定位于表皮生长因子样结构域7(epidermal growth factor-1ike domain7,EGFL7)基因7号内含子内。在结直肠癌、胃癌、前列腺癌、肝癌中miR-126表达较正常组织为低。
研究表明,在许多病变的细胞或组织中,miR-126直接与VEGF的3'UTRs序列相互作用调控VEGF蛋白的表达,并与之成负相关。体外实验还证明:miR-126通过靶向作用于表皮生长因子域7(EGFL7)、VCAM-l、同源框A9(HOXA9)、胰岛素受体底物-1(IlLS-1)、p85-B等与肿瘤生长、转移密切相关的蛋白分子,在转录后水平调控靶基因表达,在肿瘤形成中起重要作用。前期实验中,我们已经通过芯片扫描技术发现miR-126在HSC活化过程中表达差异明显,提示miR-126可能在一定程度上参与了HSC生物学行为的调控。
因此我们通过期待通过过表达技术,使miR-126在HSC达到最高的转染效率和稳定持久的表达,对基因治疗慢性肝病提供实验基础。
外源基因进入细胞通常需要"载体",提供高效的基因转移、长期稳定的基因表达及具有生物安全性的病毒载体是所有基因治疗必须解决的问题。目前所用的载体按来源,可分为病毒载体和非病毒载体。与非病毒载体相比,病毒载体具有转染效率高、可在体内稳定表达等优点。本实验采用的是第三代慢病毒载体,是在HIV-1病毒基础上改造而成的病毒载体系统,具有同时感染分裂和非分裂细胞、整合性和免疫原性低等优点,它能高效的将目的基因(或RNAi)导入动物和人的原代细胞或细胞系。因此,本实验采用慢病毒进行miRNA的转染,能够在体内外进行高效整合、高效表达。体外转染HSC细胞后,可见细胞内绿色荧光蛋白广泛表达,达到最高的转染效率,且细胞生长情况良好,为miR126在HSC调控机制的研究奠定了实验基础。





