摘要:传染性法氏囊病 (Infectious bursal disease, IBD) 是由传染性法氏囊病病毒 (Infectious bursal disease virus, IBDV) 引起的鸡和火鸡的一种急性、高度接触性传染病。本实验从山西省不同地区疑似法氏囊病鸡中分离到法氏囊病毒, 经鸡胚培养繁殖、电镜观察、提取RNA、设计引物、c DNA的PCR扩增、电泳、测序。通过序列分析比对, 最后鉴定其为传染性法氏囊病毒株。
关键词:法氏囊病毒; 分子鉴定; VP2基因;
鸡传染性法氏囊病 (IBD) 于1957年首次在美国东海岸特拉华州南部冈博罗城的肉鸡群中发现, 因此也称“冈博罗”病, Wintorfield于1962年从患病的小鸡鸡胚中分离出病毒, 1972年定名为鸡传染性法氏囊病。80年代以后至90年代以来欧洲国家出现了致死率很高的超强毒传染性法氏囊病病毒株 (very virulent IBDV, vv IBDV) .vv IBDV的流行特点及病原特性:对鸡具有很强的致病性, 鸡对IBD最易感阶段为3~6周龄, vv IBDV不仅能感染有较高母源抗体的3周龄以内的雏鸡, 而且也能引起大周龄鸡发病;死亡率高;引起严重的法氏囊损伤是vv IBDV的又一显着特点:病死鸡的法氏囊显着肿大, 严重出血, 有的外观呈“紫葡萄”样。几十年来, 已遍及几乎所有养鸡国家, 给各国养鸡业带来巨大经济损失。[1]传染性法氏囊病超强毒 (IBDV) 引起鸡的免疫抑制, 导致新城疫、马立克氏、禽流感、传染性支气管炎和球虫等病免疫失败。近年来, 山西省及全国一些地方由于超强毒株的流行, 导致常用的传统IBD弱毒疫苗和灭活疫苗不能提供足够的保护, 而造成免疫失败, 也使本病的流行出现了新的特点, 从而更加重了对养禽业的危害。超强毒株能够冲破高水平母源抗体, 破坏常规疫苗的保护作用, 不仅能造成体液免疫抑制, 而且对细胞免疫也有一定影响。本实验从山西省不同地区采集疑似法氏囊病鸡病料, 主要采集的法氏囊特征是肿大、表面充血、出血, 呈“紫葡萄样”;切开可见黏膜弥漫性出血, 并有黏稠的奶酪样物质覆盖。经病料采集处理、病毒纯化繁殖、电镜观察、提取RNA、设计引物、c DNA的PCR扩增、电泳、测序。通过序列分析比对, 最后鉴定其为传染性法氏囊病毒株。
1 材料
1.1 鸡胚及雏鸡
SPF蛋购自山东省家禽研究所, 由本实验室孵化室孵化至所需日龄鸡胚。试验鸡购自山西某鸡场;
1.2 病料采集处理及病毒纯化繁殖
1.2.1 病料的采集处理
从山西省不同地区疑似法氏囊病鸡中采集法氏囊病料, 用PBS缓冲液无菌研磨, 反复离心3次, 取上清液。保存备用。
1.2.2 病毒纯化
繁殖SPF鸡蛋60枚, 分三批入孵, 每批20枚。用常规的绒毛尿囊膜接种法, 接种法氏囊病毒乳液, 盲传几次, 收获绒毛尿囊膜和尿囊液备用。
1.3 试剂及诊断液
主要试剂:DNA marker 2000为TIANGEN公司产品;Axy Prep DNA凝胶回收试剂盒为美国AXYGEN公司产品;Plasmid Mini kit I (100) 为OMEGA BIO-TEK公司产品;碱法质粒提取溶液Solution I、Solution II、Solution III参照分子克隆实验指南配制;IBDV阳性血清和抗原购自中国哈尔滨兽医研究所。
1.4 菌株及载体
大肠杆菌DH5α由本实验室保存;Pfast Bac HTA表达载体及相关产品购自Invitrogen;PMD18-T载体为宝生物工程 (大连) 有限公司产品;限制性内切酶Eco RI、Xho I购自NEB.
2 方法
2.1 病料采集处理及病毒纯化繁殖
2.1.1 病料的采集处理
从山西省不同地区疑似法氏囊病鸡中采集法氏囊病料。主要选择法氏囊外观水肿呈胶冻样、出血呈紫葡萄状。将病料反复冻融三次, 充分释放病毒粒子, 增加病毒粒子含量, 1:5生理盐水无菌研磨, 再等体积加入4, 000IU/m L青霉素和2, 000IU/m L链霉素的双抗, 放入-20℃保存, 备用。用琼脂扩散试验检测病毒效价, 被检病毒与标准法氏囊阳性血清出现明显的沉淀线。
2.1.2 病毒纯化
繁殖取60枚SPF鸡蛋, 分三批入孵, 每批20枚。将第一批20枚鸡胚放入温箱中, 每日翻蛋2~3次, 注意保持湿度。4日后入孵第二批蛋, 再4日后入孵第三批蛋。当第一批鸡胚10日龄时, 法氏囊病毒乳液加等体积双抗30min;用常规的绒毛尿囊膜接种法, 接种法氏囊病毒乳液;然后用熔化石蜡封口, 放入温箱继续孵育, 逐日观察。24h内无死亡的弃掉, 48h以后死亡的鸡胚放入4℃保存, 120h收集死活胚放入4℃。收获鸡胚绒毛尿囊膜和尿囊液, 将绒毛尿囊膜加PBS缓冲液无菌研磨, 研磨后4℃放置1h, 加等体积氯仿充分混匀至乳悬液, 摇床过夜, 反复冻融3次后, 进行第二次接毒。同上述过程进行第三次接毒。第三次接毒收获的绒毛尿囊膜研磨后, 用琼脂扩散试验检测病毒效价, 被检病毒与标准法氏囊阳性血清出现明显的沉淀线。
2.2 引物的设计与合成
根据genbank登录IBDVVP2基因参考序列和表达载质粒p Fast Bac HTA表达阅读框设计VP2基因扩增引物:P1:5′-C G G A A T T C A T G A CA A A C C T G C A A G A T C AA A C C-3′;P 2:5′-C CC T C G A G C A C C G G C A C AG C T A T C C T C C T T A T-3′;两头分别引入Eco RI和Xho I酶切位点。引物由生工生物工程 (上海) 股份有限公司合成。
2.3 病毒RNA的提取
用Trizol法提取RNA, 具体步骤为:取250?L病毒液于一普通的1.5m L EP管中, 加入750u L Trizol, 震荡混匀, 静置5min.加入150?L氯仿, 震荡混匀, 4℃离心, 12, 000r/min, 5min.取上清加入450?L异丙醇, 颠倒混匀, 4℃离心, 12, 000r/min, 12min.弃液体, 加1m L75%DEPC乙醇洗涤, 4℃离心, 12, 000r/min, 5min.弃液体, 虹吸, 干燥沉淀。加9?L DEPC水, 50℃水浴10min, 开始反转录。
反转录步骤为:10?L RNA、1?L随机引物和4?L d NTP混匀, 65℃水浴8min后迅速冰浴5min.再加入4?L Buffer、1?L反转录酶和1?L RNase inhibitor, 37℃水浴2~3h.以反转录产物为模板, P1和P2为引物进行PCR反应。
PCR反应体系:5×Star Buffer 5?L, d NTP 2?L, 4?L模板, P1和P2各0.5?L, P r i m e s t a r 0.2 5?L, d d H2O12.75?L.PCR反应条件:98℃预变性10s;98℃变性10s, 55℃退火15s, 72℃延伸100s, 共30个循环, 72℃终延伸10min.[1]凝胶电泳以鉴定分子量大小。将PCR产物按照Axy Prep DNA凝胶回收试剂盒说明书进行回收。取4.5?L回收产物加入5?LSollution I和0.5?L Venter, 混匀, 4℃过夜。将连接产物转化入E.coli DH5α感受态细菌, 涂布在用LB配制的1.5%的琼脂平皿上 (含氨苄青霉素100mg/L) , 37℃培养14h.挑单菌落接种入LB (含氨苄青霉素100mg/L) , 振摇培养12h.按Plasmid Mini kit I (100) 说明书提取质粒。质粒用Eco RI和Xho I双酶切鉴定, 阳性重组质粒命名为T-VP2.送上海生工测序。
2.4 分离株VP2序列分析及推导氨基酸序列分析
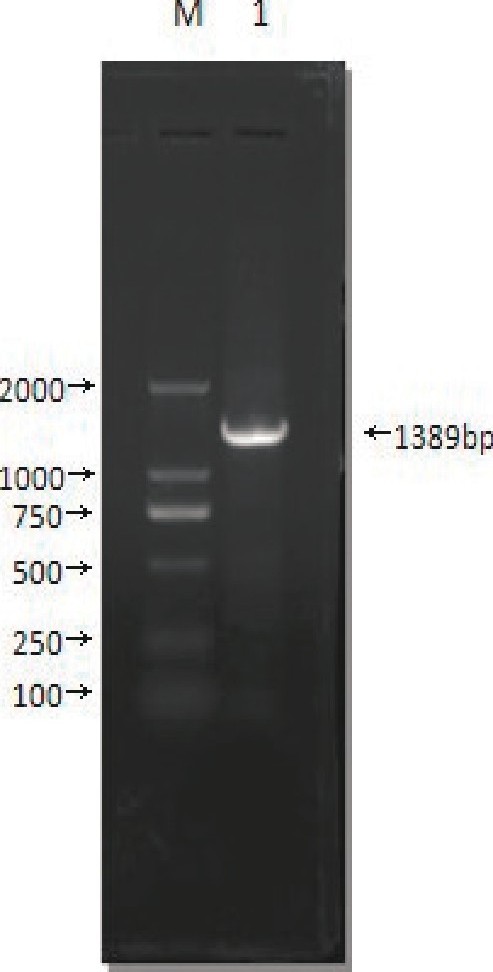
测序结果表明, 分离株VP2基因核苷酸长度为1389bp, 推导氨基酸序列含有347个氨基酸, 采用DNAstar软件对测序结果进行分析, 对照IBDV经典强、弱毒株及超强毒株高变区氨基酸序列分析分离株VP2分子特征。
2.5 数据分析
分离株VP2高变区遗传进化树分析应用生物软件DNASTAR, 对分离株和其他40株登录在Gen Bank中的参考毒株的VP2基因高变区 (435bp) 进行进化树分析, 参考毒株及登录号为:JF907703.1.
3 结果与分析
3.1 病毒纯化繁殖结果
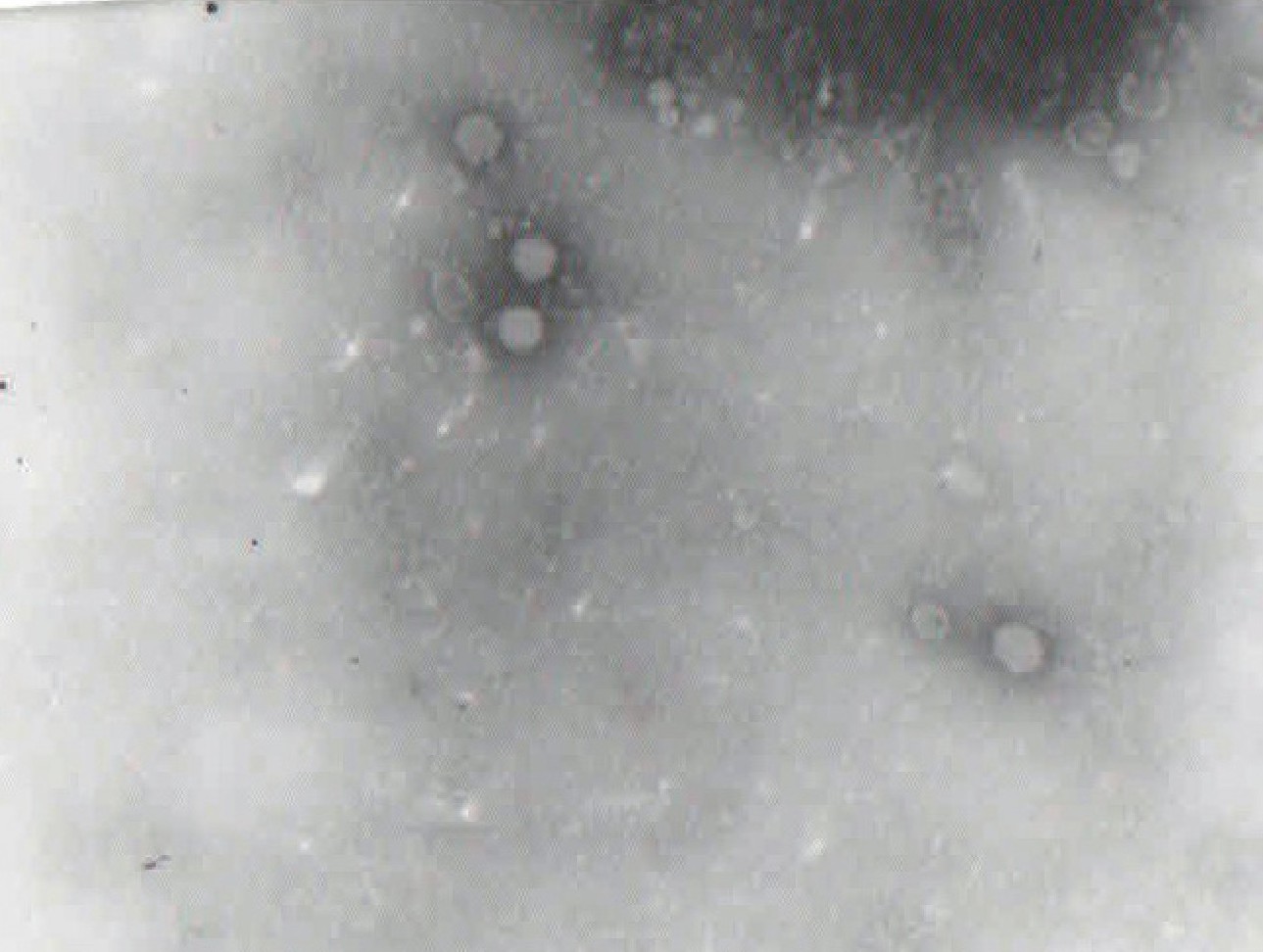
病料经无菌处理及鸡胚繁殖、通过差速离心和密度梯度超速离心后负染、电镜观察表明:病毒的三维立体结构表明, IBDV病毒颗粒并非球形, 呈T=13对称, 五倍轴延伸直径为72nm, 而三倍轴延伸直径为66nm (见图1) .
3.2 VP2基因扩增结果
VP2基因扩增图谱 (见图2) .
3.3 T-VP2酶切鉴定结果
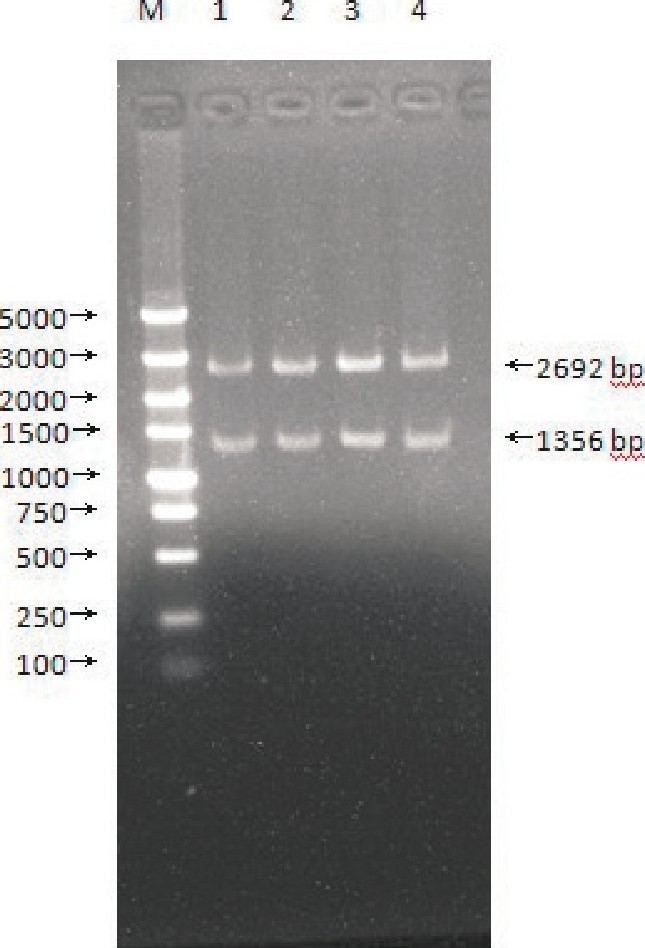
T-VP2酶切鉴定结果 (见图3) .
3.4 IBDV同源性分析结果
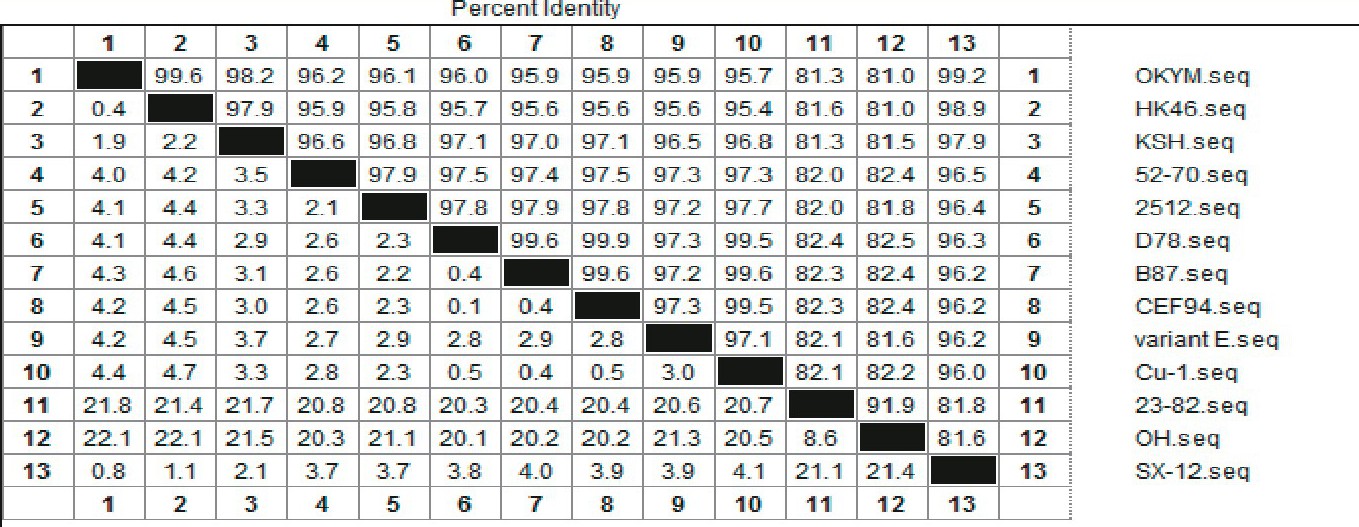
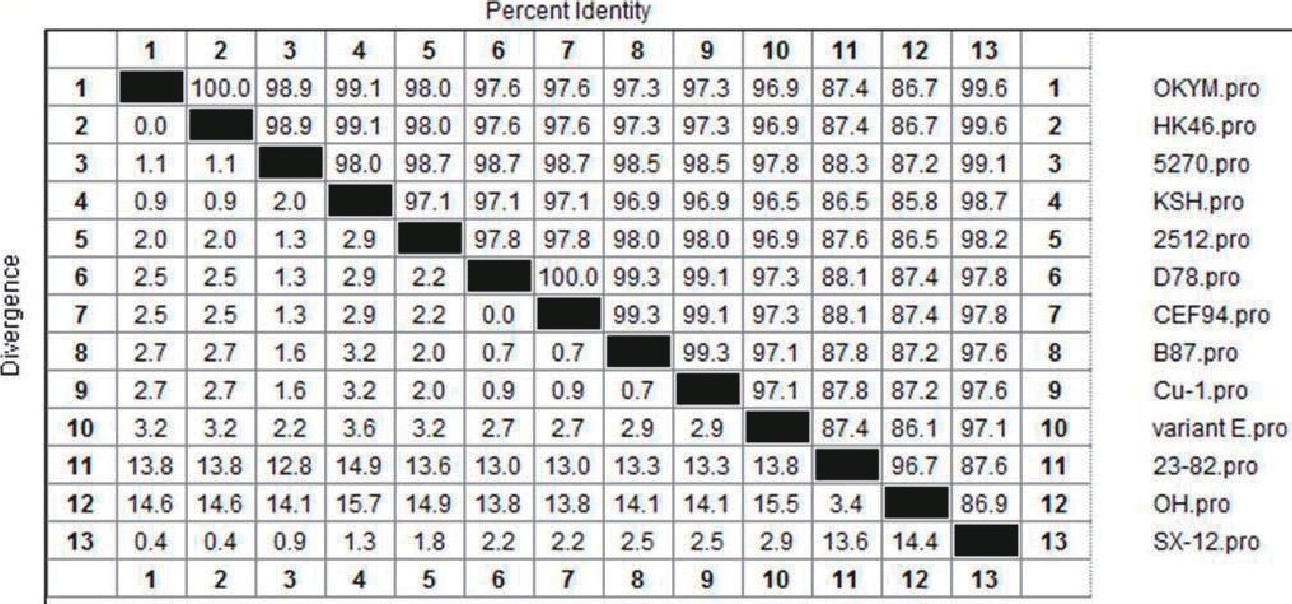
测序结果表明, VP2基因核苷酸长度为1356bp, 推导编码452个氨基酸。采用DNAstar软件将IBDV株VP2基因与国内外已报道的VP2基因核苷酸序列进行同源性比对。结果表明, IBDV株VP2核苷酸序列与日本超强毒株OKYM同源性最高为99.2%, 与其他两株超强毒株同源性高达98.9%、97.9%, 而与强毒株52/70株和变异株variant E同源性较低分别为96.5%与96.2%, 与中等毒力致弱株B87和2512、经典弱毒株D78和Cu-1以及疫苗株CEF94同源性在96.0%~96.4%之间, 与II型毒株同源性最低分别为81.6%、81.8%[2] (见图4) .
同时, 对VP2氨基酸序列进行同源性分析, 结果表明[2]IBDV VP2氨基酸序列与超强毒株OKYM、HK46同源性最高均为99.6%, 与强毒株52/70同源性次之为99.1%, 与弱毒株及变异株同源性相对较低, 从氨基酸水平表明IBDV分离株与强毒株关系密切 (见图5) .
3.5 IBDV VP2高变区氨基酸序列分析结果
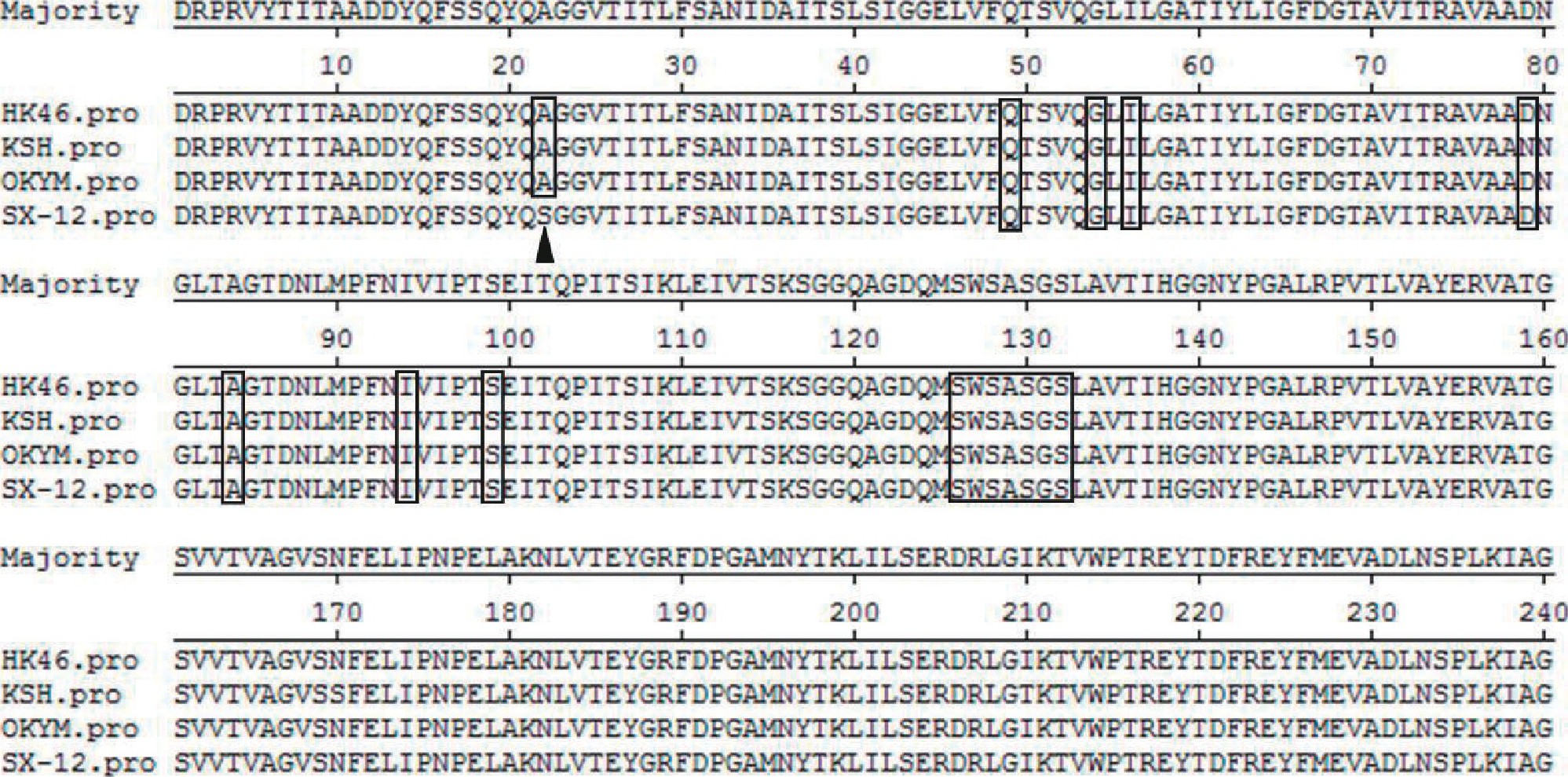
IBDV分离株VP2同源性与超强毒株最高, 而IBDV病毒毒力相关分子和致病性分子标志主要分布在高变区, 因此采用DNAstar软件对IBDV VP2高变区与强毒参考毒株进行比对分析, 结果表明, 除222位点外, IBDV VP2高变区具备与超强毒株高变区一致的特征性氨基酸, 即第249位和第254位氨基酸为Q和G, SWSASGS七肽区不变, 第279和第284位氨基酸分别为D和A, 第294和第299位分别是特征性氨基酸I和S, 尽管该分离株第222位是S而不是典型超强毒株的A, 但其余关键位点均与强毒株相符[2] (如图6) .
3.6 IBDV VP2遗传进化分析
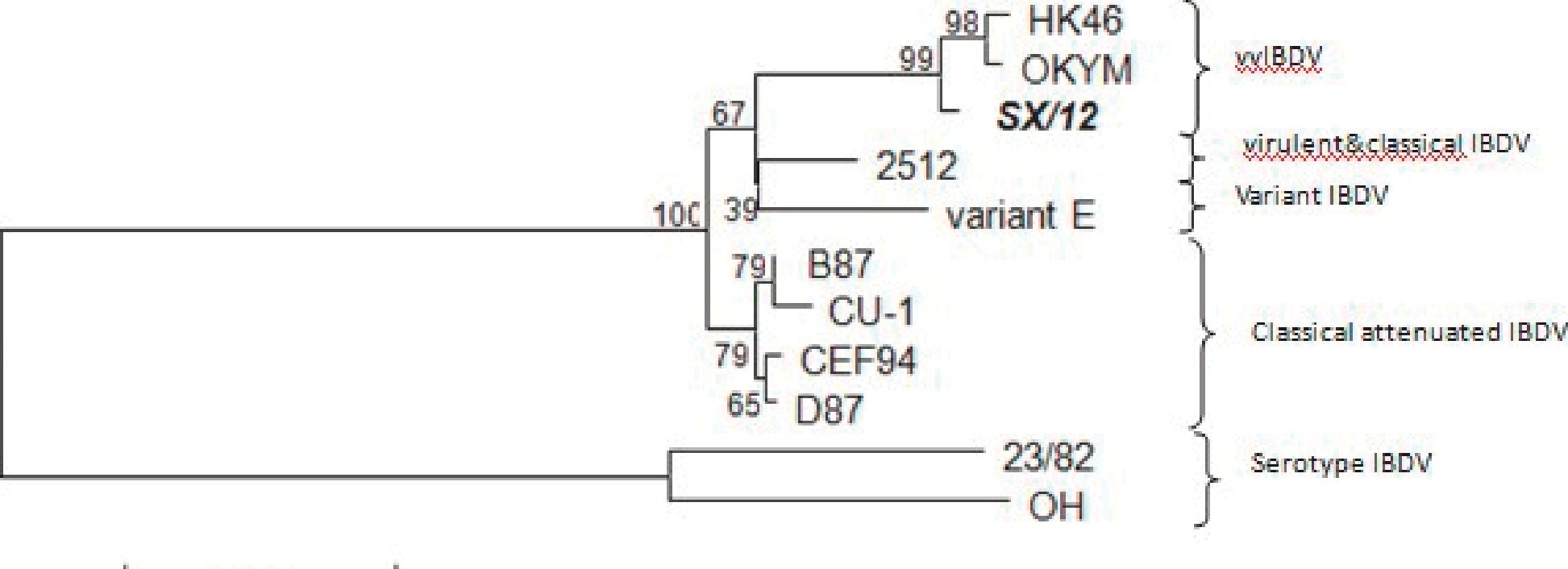
根据IBDV VP2高变区核苷酸序列与参考毒株相应序列, 采用软件MEGA 5.1构建基因进化树进行分析。结果表明, 这些毒株共形成2个大的分支:血清I型和血清II型, 其中血清I型毒株又分为超强毒株、强毒株、变异株和弱毒疫苗株4个小的分支, IBDV与强毒株HK46、OKYM、KSH属同一进化分支, 亲缘关系最近, 与变异株、强毒株次之, 与弱毒疫苗株亲缘关系最远, 说明与强毒株具有更密切的亲缘关系[2] (图7) .
4 讨论
IBD是危害我国养鸡业的重要传染性疾病, 在我国不同地区都有发生的报道, 自上世纪80年代以来, 欧洲及我国相继出现IBDV强毒株 (very virulent IBDV, vv IBDV) 的流行[3], 尤其是从21世纪初变异株和强毒的流行, 已严重威胁着包括我国在内的世界养鸡业的发展[4].在我国相继报道了HZ株、GZ株、安徽地区分离株等, 但在山西地区还未见有报道, 本实验是首次在山西地区分离到超强毒株。
本病通常用疫苗预防即能取得较好的效果, 但近几年不断的有养鸡场发生大量的鸡感染死亡。大多是由于IBDV变异株的抗原性和经典疫苗株间有差异, 引起免疫抑制[5].或是vv IBDV的出现不仅能产生免疫抑制, 其超强的致病力能导致鸡群的高死亡率[6,7].本实验采样鸡场同样具有较高的死亡率, 其特征与国内外鸡感染超强毒株后临床特征一致。
已有报道VP2携带宿主保护性抗原决定簇, 具有至少2~3个中和性抗原位点, 可诱导产生保护性中和抗体, 并且有血清型特异性[8].另外VP2的七肽区决定其致病性和毒力。经过对多株vv IBDV VP2的研究对比, 分析出其具备3个重要特征[9]: (1) 在249和254位上的氨基酸分别为Q和G, 而非K和S, 从而保证其抗原性不发生变异; (2) 七肽区保持SWSASGS不变, 且279和284位分别为D和A, 而非N和T, 这是IBDV毒株具有致病力的必要条件; (3) 在222、294和299位上具有3个特征氨基酸, 分别为A、I和S, 这3个氨基酸使超强毒的亲水性发生变化, 从而使毒力增强。本实验从山西地区分离到的IBDV分离株完全符合以上VP2基因的重要特征, 由此可证明其为vv IBDV.
参考文献
[1]陆冰洋;刘华栋;王彩先, 等。传染性法氏囊病毒超强毒株高免蛋黄抗体的研制及应用[C].中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集, 2013 (10) .
[2]詹丽娥;陆冰洋;刘华栋, 等。鸡传染性法氏囊病超强毒株的分子鉴定[J].华北农学报, 2013 (06) .
[3]Wang X, Fu C, Gao H.Molecular and antigenic characterization of very virulent infectious bursal disease virus strain Gx isolated in China[J].Agricultural Sciences in China, 2003, 2 (5) :566-572.
[4]许信刚, 李健强, 王笑梅, 等。IBDV超强毒HZ株VP2基因的克隆和真核表达质粒的构建[J].中国预防兽医学报, 2000, 22:32-36.
[5]王桂军, 魏建忠, 吴忆春, 等。安徽地区IBDV超强毒株的分离鉴定和VP2基因序列分析[J].畜牧与兽医, 2006, 38 (8) :4-7.
[6]张存, 范坤晓, 陈如玉, 等。鸡传染性法氏囊病超强毒的感染与防制[J].畜牧与兽医, 1996, 28 (3) :130-132.
[7]韦平, 龙进学, 阳秀英, 等。传染性法氏囊病病毒快速检测与分型技术的研究[J].中国兽医学报, 2004, 24 (4) :313-316.
[8]王笑梅, 许信刚, 宋秀龙, 等。传染性法氏囊病病毒超强毒GZ株VP2基因的克隆和序列分析[J].中国预防兽医学报, 2001, 21 (5) :421-424.
[9]曹永长, 毕英佐, 梁志清, 等。超强IBDV毒株宿主保护抗原的分子特征[J].中国兽医学报, 1998, 18 (6) :521-526.