定量检测白色念珠菌Eno的免疫磁珠方法及应用
时间:2014-08-14 来源:未知 作者:傻傻地鱼 本文字数:4040字
0 引 言
侵袭性念珠菌病( invasive candidiasis,IC) 在免疫抑制患者及 ICU 患者中的发病率逐年升高,尽管临床医师对 IC 的诊治越来越重视,但其致死率仍可高达 40%~ 55%,其中白色念珠菌仍是最常见的致病菌,约占50%。血培养是目前 IC 诊断的实验室金标准和传统的检测方法,由于敏感性低( 约 50%) 、结果回报时间长,往往延误了 IC 的诊断和治疗,是造成 IC 高病死率的部分原因。寻找可靠有效的 IC 诊断抗原标志物,并建立定量检测方法,可以弥补血培养的不足,提高 IC 的实验室诊断水平并用于疗效监测。烯醇化酶( enolase,Eno) 存在于念珠菌细胞壁与细胞质内,由 440 个氨基酸组成,相对分子质量在45000~48000。Eno 在白色念珠菌中是含量最丰富的可溶性蛋白、重要的菌丝相蛋白和免疫优势抗原,在念珠菌能量代谢中起重要作用,是一个潜在的 IC 诊断标志物。
本研究建立了定量检测白色念珠菌 Eno 的免疫磁珠方法,并应用于念珠菌培养上清检测,为深入了解Eno 对 IC 的诊断价值奠定研究基础。
1、 材料与方法
1. 1 菌株及来源 本研究所用白色念珠菌、热带念珠菌、光滑念珠菌、近平滑念珠菌、季也蒙念珠菌、新型隐球菌和酿酒酵母均为本科微生物室临床分离菌株,经科玛嘉显色培养基和 VITEK2-compact 全自动细菌鉴定仪( 法国梅里埃公司) 鉴定。
1. 2 主要试剂及仪器 氨基化磁性微珠( Merck 公司) 由南方医科大学吴英松教授惠赠。N-羟基丁二酰亚胺( NHS) 、4-吗啉乙磺酸( MES) 、1-( 3-二甲氨基丙基) -3-乙基碳二亚胺盐酸盐( EDC) 购自 Sigma公司。白色念珠菌 Eno 重组蛋白、抗 Eno 单克隆抗体及羊抗 Eno 多克隆抗体为本室制备及纯化;HRP 购自上海国源生物技术有限公司; RPMI 1640为 Gibco 公司产品,小牛血清购自浙江杭州四季青生物工程材料有限公司,BCA 蛋白定量试剂盒购自Thermo 公司,其他试剂均为分析纯。12 孔磁分离架和 96 孔板磁分离架购自天津市倍思乐色谱技术开发中心。Model 680 型酶联仪为美国 Bio-Rad 公司产品,QB-128 型旋转混匀器购于江苏海门市其林贝尔仪器制造有限公司。75-2A 微量振荡器购于上海医用分析仪器厂。
1. 3 免疫磁珠制备 参照文献,取 100μL( 100 mg/mL) 磁珠悬液,加入 1 mL 结合缓冲液( 0. 1 mol/L MES,pH5. 0) ; 涡旋混匀后将离心管置于 12 孔磁分离架上 60 s,吸去上清,重复上述操作 1次。加入 1 mL 结合缓冲液,混悬磁珠,依次加入40 μL EDC 和 25 μL NHS ( 现用现配,浓度均为10 mg / mL) ,室温旋转混匀 30 min,置于 12 孔磁分离架上 60 s,吸去上清。加入 1 mL 结合缓冲液稀释的Eno 单克隆抗体( 500 μg) ,4 ℃ 旋转( 30 r / min) 混匀过夜,于12 孔磁分离架上分离结合 Eno 单克隆抗体的免疫磁珠 60 s,吸取全部上清; 加入 1 mL TBST( 25mmol/L Tris-HCl,0. 15 mol/L NaCl,0.05% Tween,pH7. 2) 混悬、洗涤免疫磁珠 1 次,置于磁性分离架上60 s,弃去上清后加入 0. 01 mol / L PBST ( 含 0. 05%Tween20 的 PBS,pH7. 2 ) 将免疫磁珠稀释至 500μg/mL,4℃保存。
1. 4 培养上清制备 参照文献进行
1. 5 HRP 标记的羊抗 Eno 制备 按改良过碘酸钠法标记
1. 6 免疫磁珠法检测 Eno 在 96 孔空白酶联反应板中每孔加入免疫磁珠和 100 μL 待检标本室温振荡混匀; 将反应板置于 96 孔板磁分离架上 30 s,吸弃上清,加入100μL PBST 振荡洗涤1min,磁性分离30 s,吸弃上清; 重复洗涤 5 次。加入 HRP-羊抗 Eno100 μL,室温振荡混匀; 磁性分离、PBST 洗涤 5 次;加入底物液 TMB- H2O2100 μL,室 温振荡混匀 10min; 加入 50 μL 0. 5 mol / L H2SO4终止反应,于酶联仪上用测试波长 450 nm、参比波长 630 nm 读取吸光度( A) 值。
2、 结 果
2. 1 磁珠耦联率测定 磁珠过夜耦联抗原后,经磁性分离的上清液蛋白质定量为 72. 8 μg,耦联率为85. 44% 。
2. 2 免疫磁珠法反应条件优化 方阵滴定法选定免疫磁珠反应量为20μL,与重组 Eno 或待检样品结合时间为 45 min,与 HRP-羊抗 Eno 结合时间为45 min,HRP-抗人 IgG 最适浓度为 1∶ 3000。
2. 3 免疫磁珠法定量检测 Eno 主要性能指标。
2. 3. 1 精密度 将 Eno 重组蛋白用 0. 01 mol /L PBS稀释为 25 ng/mL( 高浓度) 和 5 ng/mL( 低浓度) ,同一批次检测 20 份,计算批内精密度; 连续检测 20批次,计算批间精密度。Eno 浓度为 25 ng/mL 和 5ng / mL 时,批内和 批间精密度分别为 4. 54% 、5. 87% 和 5. 26% 、8. 82% 。
2. 3. 2 最低检出下限 测定培养基质( 含 20% 小牛血清的 RPMI-1640 培养液) A 值( x ± s) 为 0. 011 ±0. 004( n = 20) ,以 0. 023( x + 3s) 为 cut-off 值。将重组蛋白用培养基质稀释为 2. 00、1. 00、0. 50、和 0. 25ng / mL,每个浓度重复检测 10 次,分别计算不同浓度重组 Eno 蛋白 A 值的 x 和 s。见表1。以重组 Eno 蛋白 A 值( x -2s) >0. 023( cut-off) 为标准,最低检出下限为0.5ng/mL。
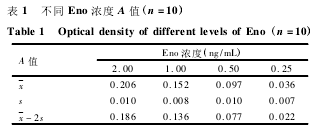
2. 3. 3 线性范围 将重组蛋白用培养基质稀释为50. 0、25. 0、10. 0、5. 0、2. 5、1. 0 和 0. 5 ng / mL,培养基质作为空白对照,用 A 值和浓度进行回归分析,相关系数 R2= 0. 992 3,线性范围为 0. 5 ~ 50 ng / mL,标准曲线见图 1。
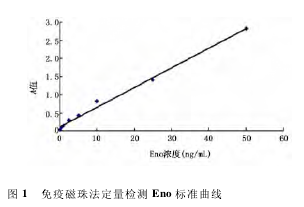
2. 3. 4 阻断试验 将羊抗 Eno 加入 50 ng /mL 的抗原溶液,使羊抗 Eno 终浓度分别为 1、2、4 和 8μg/mL,置 37 ℃温育 1 h 后,检测混合液中 Eno 的 A值。可见随抗体浓度增加,测得的 Eno A 值不断下降,见图 2。当加入的羊抗 Eno 浓度为 8 μg/mL 时,阻断率为 95. 46%。
2. 4 培养上清 Eno 检测结果
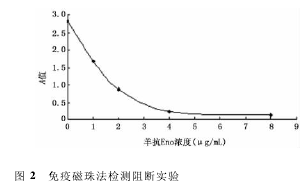
2. 4. 1 不同温度下白色念珠菌培养上清中 Eno 检测结果 37 ℃培养 4 h 后,涂片可见白色念珠菌形成假菌丝,培养 24 h,上清中 Eno 浓度为 3. 89ng / mL。由于 1640 完全培养基中含有 20% 小牛血清,因此 25 ℃培养 24 h 后,涂片也可看见假菌丝的形成,但与同期的 37 ℃培养物相比,假菌丝的比例较低,上清中 Eno 浓度为 0. 74 ng/mL。25 ℃ 培养48 h,上清中 Eno 浓度为 3. 05 ng / mL,此时 37 ℃ 培养上清中 Eno 浓度为 7. 77 ng/mL。不同培养温度下Eno 浓度均随时间延长而增加。在整个观察期间,25 ℃ 培养液中白色念珠菌菌丝的生长弱于 37 ℃ 培养液,培养上清中 Eno 含量始终低于 37 ℃ 培养上清。见图 3。
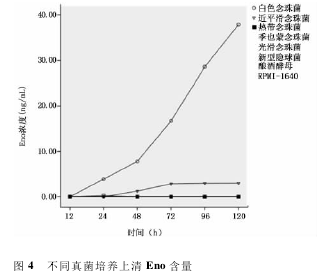
2. 4. 2 不同真菌培养上清中 Eno 检测结果 涂片结果显示,培养4h 时白色念珠菌和热带念珠菌出现菌丝生长,培养 48 h 近平滑念珠菌出现明显的菌丝生长。37℃培养24h 后,白色念珠菌培养上清中可检出 Eno,浓度为 3. 89 ng/mL,随培养时间延长上清中Eno 逐渐增多,培养至 120 h,Eno 浓度达 37. 89ng / mL。近平滑念珠菌 37 ℃ 培养 48 h,上清可检测出少量 Eno( 1.26 ng/mL) ,但随后一直保持低水平,培养至120h,Eno 浓度为2.98ng/mL。在整个培养过程中,热带念珠菌、光滑念珠菌、季也蒙念珠菌和新型隐球菌、酿酒酵母培养上清内未检测出 Eno。见图4。
3、 讨 论
基于抗原诊断的非培养方法如 1,3-β-D 葡聚糖( 1,3-β-glucan,BG) 、甘露聚糖的检测可为 IC 诊断提供直接依据,虽然敏感性适中,但弥补了血培养的不足,近年来在临床得到了广泛的应用。欧洲癌症-侵袭性真菌感染治疗研究协作组和美国国立变态反应和感染病研究院真菌病研究组( EORTC/MSG) 将BG 纳入侵袭性真菌感染临床诊断( probable) 和拟诊( possible) 的微生物学标准。在 BG 检测中有些容易造成假阳性的因素,如透析、输注白蛋白注射液、静脉导管置入、抗肿瘤药物中的类似成分、手术纱布污染、某些细菌感染等,限制了 BG 在侵袭性念珠菌感染中的诊断作用,研究者致力于寻找新的用于 IC 诊断抗原标志物。
Walsh 等和 Mitsutake 等报道在 IC 患者外周血中会出现 Eno 抗原血症,Eno 检测 IC 的敏感性和特异性为 71. 8%~75% 和 96%~100%。他们认为 Eno 抗原检测是对血培养方法的有益补充,如果和甘露聚糖、BG 联合检测可以提高 IC 检测的准确性。
Mitsutake 等用于检测的多克隆抗体是采用白色念珠菌菌体纯化 Eno 蛋白免疫家兔后获得,不能区分不同念珠菌所致感染,检测灵敏度为5ng/mL。Walsh等使用的检测模式和本研究类似,也采用了单抗和多抗的检测组合,Eno 的检出下限为0.5~1ng/mL,但未对不同念珠菌感染的特异性进行评价。
我们前期已成功建立双抗体夹心 ELISA 定性检测 Eno,证实所采用的单抗和多抗组合可以特异性识别白色念珠菌增殖过程中产生的天然抗原,除与近平滑念珠菌有微弱交叉反应外,与其他念珠菌和新型隐球菌、酿酒酵母无交叉反应。我们的前期研究发现,Eno 水平与白色念珠菌菌丝生长呈正相关,检测 Eno 水平可以反映白色念珠菌侵袭性生长的发生,我们认为实现 Eno 的定量检测有助于评估 IC 的发生和监测治疗效果。
念珠菌抗原检测受到在血清中清除快,循环血中含量低的局限,新免疫技术和平台的出现,将为提高 IC 患者实验室诊断水平创造条件。免疫磁珠分离技术是将免疫学反应的高度特异性与磁珠特有的磁响应性相结合的一种新兴免疫学技术,具有分离快速、简单和灵敏的优势,已广泛应用于免疫细胞分离、病原微生物学和免疫学检测。本研究将白色念珠菌 Eno 单克隆抗体耦联至磁性微球上,制备免疫磁珠,建立定量检测 Eno 方法,其方法学性能指标如精密度、特异性、线性范围符合临床实验要求,最低检测下限与文献报道一致。免疫磁珠法对常见真菌培养上清中 Eno 含量和白色念珠菌不同培养温度下培养上清中 Eno 含量的定量检测结果,支持了我们前期研究的定性结果。免疫磁珠法检测的特异性与 ELISA 法一致,均可特异识别白色念珠菌 Eno 蛋白,与近平滑念珠菌有弱交叉反应性,提示该法有望用于特异诊断白色念珠菌引发的侵袭性念珠菌感染,为临床正确选择抗真菌药物提供依据。免疫磁珠具有较大的比表面积,其结合效率类似于液相-液相反应,高于 ELISA 的固相-液相反应。利用免疫磁珠的磁响应性,抗原抗体结合物的分离更为快速简便。与我们前期建立的双抗体夹心 ELISA 定性检测方法相比,免疫磁珠法实现了 Eno 的定量检测,温育时间缩短了 30 min、孵育温度从 37 ℃ 简化为室温,最低检测下限从 1. 25 ng/mL 降低至 0. 5 ng/mL,此外还具有节约检测试剂用量的优点。
综上所述,本研究成功建立定量检测 Eno 的免疫磁珠法,对念珠菌培养上清中天然 Eno 抗原的检测结果与前期研究相符。今后,我们将用该方法进一步评估 Eno 在 IC 的早期诊断、疗效监测和预后预测中的价值。
- 相关内容推荐
- 检测宫颈高度病变的临床特征2014-08-27
- 单纯疱疹病毒感染中血清学指标检测的意义2015-10-27
- 卵巢癌患者的MRI和US的检测结果对比分析2015-03-30
- 彩色多普勒超声检测心血管疾病的可行性2014-09-02
- EUS在胰腺囊性病变的鉴别诊断及检测的作用2014-07-11
- 运用彩色多普勒超声检测皮瓣穿支血管的数量并定位2014-09-02
- 甲状腺结节性病变的B超检测研究2015-10-27
- 检测分析血栓前分子标记物与OSAHS的相关性2014-08-28





