摘 要: 以江门大顶苦瓜自交系干种子为材料, 设置EMS溶液不同浓度 (0、0.3%、0.6%、0.9%、1.2%、1.5%) 和不同诱变时间 (2、4、6 h) 处理组合, 通过统计苦瓜种子发芽势和发芽率指标以及M0植株表型观察来确定苦瓜种子EMS诱变的适宜条件。结果表明, EMS溶液浓度、诱变时间以及两者的互作均对苦瓜种子发芽势和发芽率具有显着的影响;根据半致死条件原则, 初步认为清水浸种8 h, 然后利用1.5%或1.2%EMS溶液处理2 h是苦瓜种子EMS诱变的适宜条件;将1.2%或1.5%EMS溶液处理2 h所获得的共129株M0苦瓜幼苗进行田间定植和表型观察, 发现苦瓜植株表型突变频率分别为5.12%和7.85%, 且表型变异多发生于叶片和果实, 表明所筛选的诱变条件可以用于苦瓜种子EMS诱变研究。试验结果为下一步利用EMS诱变技术开展苦瓜突变体库构建以及创制苦瓜新材料奠定了基础。
关键词: 苦瓜; 种子; EMS诱变; 发芽势; 发芽率;
Abstract: Taking dry seeds of bitter gourd inbred line ‘Jiangmendading' as materials, setting up combinations of treatments with different EMS concentrations (0, 0.3%, 0.6%, 0.9%, 1.2% and 1.5%) and different mutagenesis times (2, 4, 6 hours) , this study determined the suitable conditions for EMS mutagenesis of bitter gourd seed through statistical data of seed germination vigor and rate and observation on M0 plant phenotypes. Results showed that EMS concentration, mutagenesis time and their interaction had significant impact on germination vigor and rate of bitter gourd seed.According to the principles of semi-lethal condition, 8 hours of soaking with water followed by 2 hours with 1.5% or 1.2% EMS treatment were the suitable conditions for EMS mutagenesis of bitter gourd seed.Field planting and phenotype observation of 129 M0 plants after 2 hours with 1.2% or 1.5% EMS treatment revealed that the mutation frequency of bitter gourd plant phenotypes were 5.12% and 7.85%, respectively, and the phenotypic variations often occurred in leaf and fruit, indicating that the selected conditions were suitable for studying EMS mutagenesis of bitter gourd seed.These results have laid a foundation for further using EMS mutagenesis technology to construct mutant library and create new bitter gourd materials.
Keyword: Bitter gourd; Seed; EMS mutagenesis; Germination vigor; Germination rate;
苦瓜 (Momordica charantia L.) 属于葫芦科苦瓜属一年生攀援草本作物, 广泛分布于非洲和亚洲的热带、亚热带地区 (Schaefer&Renner, 2010;Cui et al., 2017) 。苦瓜因其果实含有葫芦烷型三萜苦味化合物而得名 (崔竣杰等, 2015) 。苦瓜果实不仅营养丰富, 而且具有降糖、降脂和抗病毒等多种生物药理活性 (Fang&Ng, 2013;van Wyk, 2015;Yang et al., 2016) 。近年来, 苦瓜消费需求和种植面积日益增加, 已成为我国重要的瓜类蔬菜作物之一。近30 a来, 许多育种工作者经过不断努力, 使苦瓜品种实现了2~3次更新换代, 为苦瓜生产做出了重要贡献。然而, 由于苦瓜并非我国原产, 国内遗传资源相对匮乏, 遗传背景较为狭窄;而且, 长期以来育种工作者主要采用传统有性杂交选育手段, 缺乏新技术的应用, 使苦瓜育种正面临如何拓宽遗传背景、深度挖掘重要功能基因资源以提高苦瓜育种效率的瓶颈问题 (Dhillon et al., 2016;Cui et al., 2018) 。
诱变育种是20世纪发现和使用的一种育种新途径。其中, 化学诱变育种技术具有使用方便、特异性较强和诱变后代较易稳定遗传等特点, 已广泛应用于拟南芥 (Kim et al., 2006) 、水稻 (王峰等, 2011;程欣等, 2013;王平荣等, 2013) 、玉米 (Lu et al., 2018) 、大豆 (谢圣男等, 2013) 、油菜 (李浩杰等, 2012) 、辣椒 (赵会芳, 2005;周书栋等, 2017) 和黄瓜 (张兵, 2012;薛存宝, 2016) 等各类植物, 并且取得了巨大的经济效益和社会效益。EMS (甲基磺酸乙酯) 是一种高效、安全的化学诱变剂, 其在生物体内可以转变成缺电子的活泼中间产物, 容易与碱基上的N原子和磷酸基团发生亲核取代反应, 最终通过碱基或磷酸基团的烷基化而使DNA发生突变, 对于突变体库的构建、新种质的创制以及基因功能分析具有重要作用 (崔霞等, 2013;黄冬福等, 2015) 。
EMS诱变效率的高低主要和使用浓度、处理时间、处理时的温度以及处理材料的组织结构特性等因素密切相关 (刘忠松和罗赫荣, 2010) 。种子是EMS诱变处理最常用的对象, 其优点在于操作简单, 便于大量处理, 而且无需耗时的转基因和复杂的组织培养, 便可以在短时间内构建大量的突变群体。前人对许多作物的种子EMS诱变条件进行了探索分析, 结果表明多数作物种子的EMS诱变适宜浓度在0.3%~1.5%之间, 诱变时间0.5~24.0h不等 (刘忠松和罗赫荣, 2010) 。瓜类蔬菜作物中, 黄瓜种子的适宜EMS诱变条件为1%浓度处理10 h或1.5%浓度处理8 h (王晶等, 2015) , 西瓜种子的适宜条件为1%浓度处理9 h (王学征等, 2015) , 瓠瓜种子的适宜条件为开壳浸种4 h, 然后1.5%浓度处理8 h (康保珊等, 2017) 。

本试验以苦瓜干种子为材料, 通过设置EMS溶液不同浓度和不同诱变时间处理, 对处理后的苦瓜种子发芽势和发芽率分别进行统计和分析, 同时对部分处理获得的苦瓜幼苗进行田间定植和表型观察, 确定苦瓜种子EMS诱变的适宜条件, 旨在为下一步构建苦瓜突变体库以及创制苦瓜新材料奠定基础。
1 材料与方法
1.1 材料与试剂
供试材料为广东省江门市农家品种江门大顶经8代自交获得的稳定自交系苦瓜干种子, 由华南农业大学园艺学院苦瓜育种课题组提供。EMS原液购自Sigma-Aldrich公司 (货号:M0880) 。
1.2 EMS溶液配制
首先用0.2 mol·L-1 Na2HPO4和0.2 mol·L-1Na H2PO4按61∶39的比例 (V∶V) 混合, 再稀释20倍, 获得0.01 mol·L-1磷酸氢二钠-磷酸二氢钠缓冲液 (pH=7.0) ;然后按体积百分比配制浓度分别为0 (即缓冲液) 、0.3%、0.6%、0.9%、1.2%和1.5%的EMS溶液。
1.3 诱变处理
考虑到苦瓜种子的适宜浸种时间一般为10~12 h, 因此将不同浓度EMS溶液诱变处理苦瓜种子时间设置为2、4 h和6 h。具体诱变程序如下:2018年3月31日, 首先选取颗粒饱满的苦瓜种子分为3份, 分别进行30℃清水浸种4、6 h和8 h处理, 然后用吸水纸吸干种子表面水分, 用不同浓度EMS溶液相应地分别浸种6、4 h和2 h, 即清水和不同浓度EMS溶液累计浸种10 h。共计18个处理, 每个处理重复3次, 每个重复50粒种子。以30℃清水浸种10 h作为对照 (CK) 。
1.4 育苗试验
处理完成后将种子取出, 用自来水流动冲洗1h, 轻微甩干, 然后将各处理种子播种到5×10穴装有育苗基质的穴盘进行发芽试验。从播种第2天开始, 连续21 d每天上午8:00~10:00记录种子萌发情况, 统计发芽相关指标:

1.5 数据分析
采用Microsoft Excel和SPSS 22.0软件对试验数据进行方差分析和统计作图。
2 结果与分析
2.1 不同浓度EMS溶液和不同诱变时间处理苦瓜种子的萌发动态
通过每天观察记录穴盘中苦瓜种子破土萌发情况, 发现从播种后第11天各处理苦瓜种子陆续开始破土萌发, 最早 (即第11天) 萌发的有0浓度处理2 h、0.9%浓度处理6 h和对照 (图1) 。至播种后第15天, 所有处理苦瓜种子都已开始萌发。播种后第16和17天是各处理苦瓜种子的萌发高峰期, 之后趋于平稳 (图1) 。方差分析结果表明, 不同浓度EMS溶液和不同诱变处理时间对苦瓜种子无论是起始萌发时间还是萌发高峰期影响都不显着 (P>0.05) 。
2.2 不同浓度EMS溶液和不同诱变时间处理苦瓜种子的发芽势和发芽率
由于大部分经处理的苦瓜种子萌发高峰期都集中在播种后第16天, 所以选择第16天的萌发数据计算苦瓜种子的发芽势。结果发现, 对照组发芽势最高, 平均为52.7%。除0浓度2 h、0.6%浓度2 h和0.9%浓度6 h 3个处理以外, 其他处理的苦瓜种子发芽势与对照组相比都显着下降 (P<0.05, 图2-a) 。1.5%浓度4 h、1.5%浓度6 h和1.2%浓度4h 3个处理的相对发芽势分别为5.1%、7.6%和7.6% (图2-b) , 表明高浓度EMS处理可显着抑制苦瓜种子的发芽势。在相同浓度EMS溶液处理条件下, 除0.9%浓度以外, 其他浓度2 h处理的发芽势和相对发芽势均高于4 h或6 h处理。0浓度和0.6%浓度处理条件下, 4 h处理的发芽势和相对发芽势均高于6 h处理, 0.3%、0.9%、1.2%、1.5%浓度处理则相反 (图2-a、2-b) , 表明EMS溶液浓度和诱变处理时间可能存在互作。
图1 不同浓度EMS溶液和不同诱变时间处理苦瓜种子的萌发动态
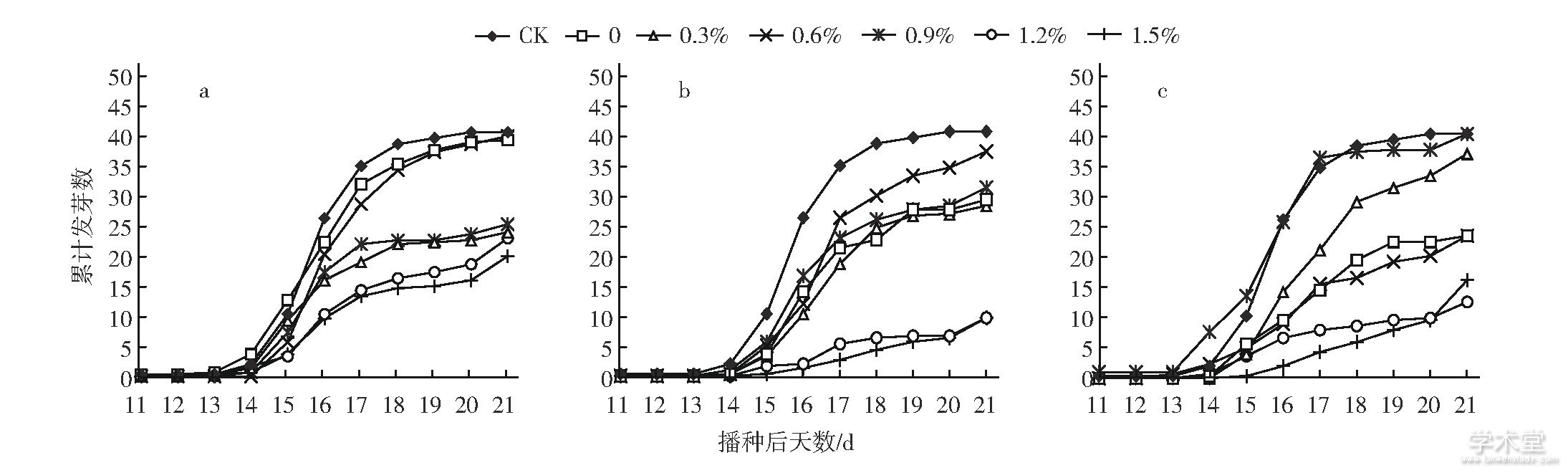
a, 诱变2 h;b, 诱变4 h;c, 诱变6 h。
统计播种后第21天种子发芽情况, 发现对照组苦瓜种子发芽率最高, 平均为81.3%。0浓度2 h、0.3%浓度6 h、0.6%浓度2 h和4 h、0.9%浓度6h共5个处理的发芽率与对照组差异不显着 (P>0.05) 。使用高浓度 (1.2%和1.5%) EMS处理时, 诱变时间无论是2、4 h还是6 h, 发芽率都显着下降 (图2-c) 。其中, 经EMS 1.5%浓度4 h和1.2%浓度4 h处理后的苦瓜种子发芽率下降最多, 相对发芽率都仅为23.8% (图2-d) 。使用0浓度和0.6%浓度处理时, 苦瓜种子的发芽率和相对发芽率随诱变时间增加而降低;使用0.3%浓度和0.9%浓度处理时, 其发芽率和相对发芽率随诱变时间增加而升高;使用高浓度 (1.2%和1.5%) 处理时, 其发芽率和相对发芽率由高到低的顺序都是2 h>6 h>4 h。经EMS处理后的苦瓜种子发芽率与其发芽势基本类似, 与诱变时间并非完全呈线性相关, 再次说明EMS溶液浓度和诱变处理时间可能存在互作。
图2 不同浓度EMS溶液和诱变时间处理苦瓜种子的发芽势和发芽率
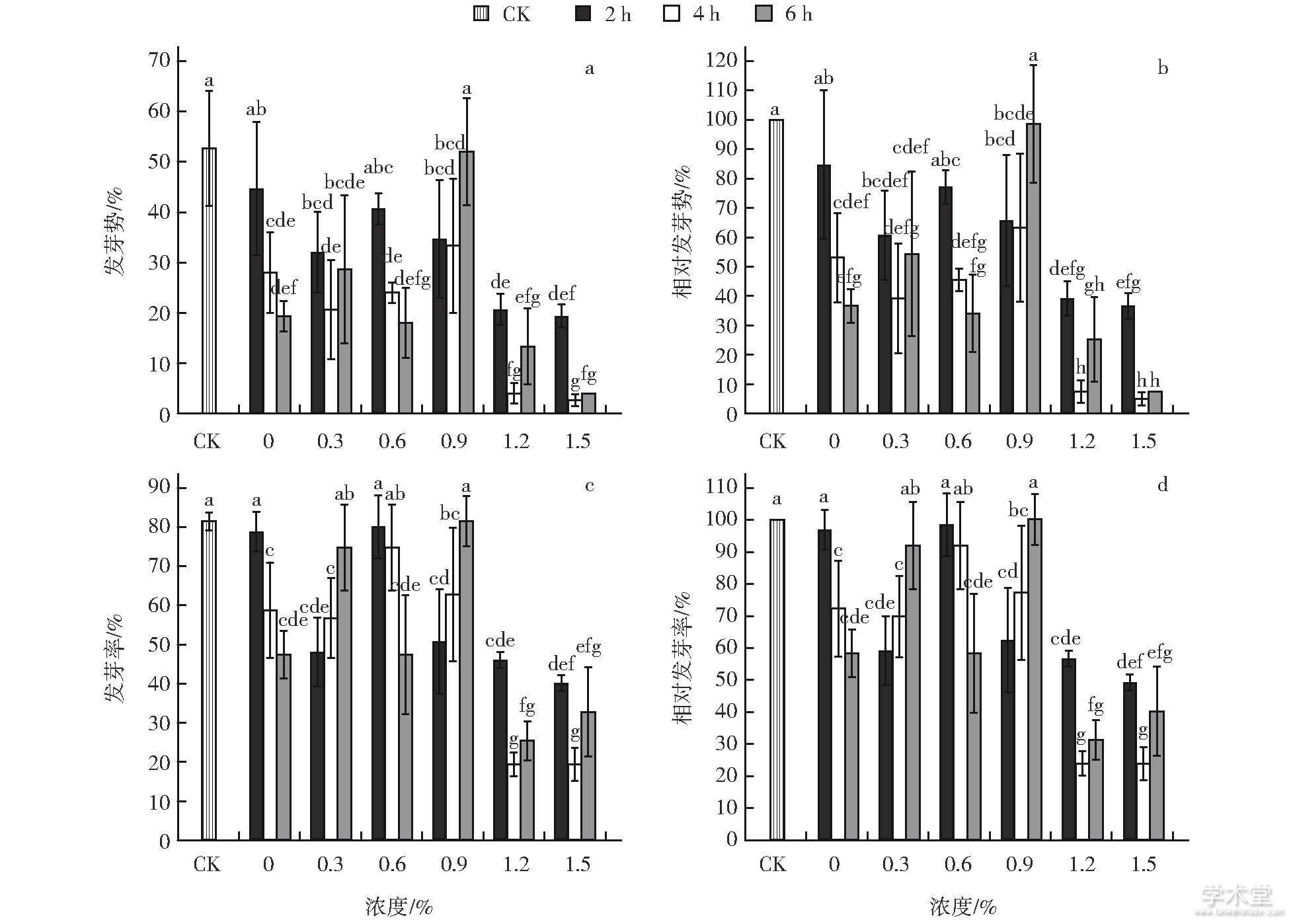
a, 发芽势;b, 相对发芽势;c, 发芽率;d, 相对发芽率;图柱上不同小写字母表示差异显着 (P<0.05) 。
2.3 苦瓜种子EMS诱变适宜浓度和诱变时间条件分析
对不同浓度EMS溶液和不同诱变时间处理的苦瓜种子发芽势和发芽率进行双因素方差分析。结果表明, EMS浓度、诱变时间以及两者之间的互作对苦瓜种子发芽势和发芽率的影响均达到显着水平 (P<0.05, 表1) , 因此在开展苦瓜种子EMS诱变时, 必须综合考虑EMS浓度和诱变时间对诱变效果的影响。由于苦瓜种子相对发芽率最接近50%的处理为EMS 1.5%浓度处理2 h (图2-d) , 按照半致死条件即为适宜诱变条件的原则, 认为先用清水浸种8 h, 然后用1.5%浓度EMS溶液处理2 h是苦瓜种子EMS诱变的适宜条件。此外, 1.2%浓度EMS溶液处理2 h的相对发芽率 (56.6%) 也比较接近50% (图2-d) , 亦可认为是苦瓜种子EMS诱变的比较适宜的条件。
表1 不同浓度EMS溶液和诱变时间处理的苦瓜种子发芽势和发芽率方差分析结果
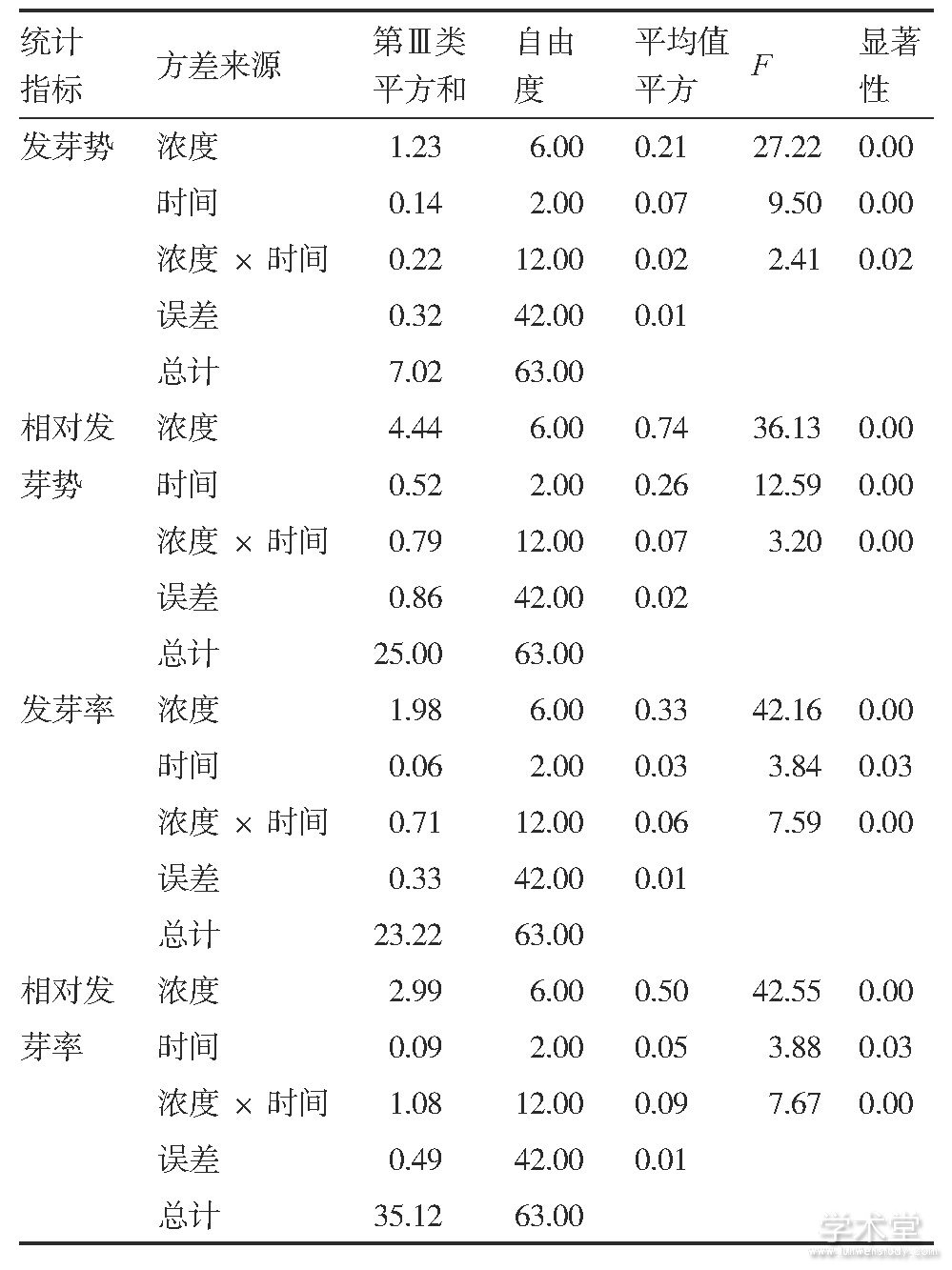
图3 苦瓜M0部分突变体幼苗和果实表型变异

a和m为野生型对照;b~f为叶片表型变异, 包括畸形、皱缩、斑点白化等;g~l为果实表型变异, 包括果形变化、子房叶化、果瘤消失等。彩色图版见《中国蔬菜》网站:www.cnveg.org。
为了验证所筛选处理条件的诱变效果, 将1.2%和1.5%浓度EMS溶液处理2 h所获得的苦瓜幼苗 (M0, 共129株) 定植到大田, 于苗期至开花结果期进行观察, 结果发现1.2%浓度和1.5%浓度EMS处理2 h的表型突变频率分别为5.12%和7.85%, 且表型变异主要集中在苦瓜叶片和果实 (图3) , 表明本试验所筛选的诱变条件可以用于苦瓜种子EMS诱变研究。
3 结论与讨论
EMS诱变是突变效率较高且比较主流的一种化学诱变方法, 对于突变体库的构建以及新种质的创制具有重要的作用, 但其在苦瓜上的应用未见报道。明确EMS诱变适宜的条件是开展EMS诱变育种研究的前提。本试验首次以苦瓜干种子为材料, 通过不同浓度EMS溶液和不同诱变时间处理组合对苦瓜种子发芽势和发芽率影响的试验以及M0表型鉴定观察, 明确了先用清水浸种8 h, 然后用1.5%或者1.2%浓度EMS溶液处理2 h是苦瓜种子EMS诱变的适宜条件。与其他已经报道的黄瓜和西瓜等瓜类作物的诱变条件相比, 苦瓜种子对EMS溶液响应的起始浓度偏高, 这可能与苦瓜种子较大且种皮结构较厚有关;另外, 苦瓜种子EMS溶液处理所需时间比前人报道的其他瓜类作物都要短 (王晶等, 2015;王学征等, 2015;康保珊等, 2017) , 这可能与EMS处理前利用清水提前浸种8 h而使苦瓜种皮通透性发生改变有关。苦瓜种子EMS诱变适宜条件的确定, 为下一步利用EMS诱变技术开展苦瓜诱变育种相关研究提供了重要参考。
苦瓜作为华南特色瓜类蔬菜作物之一, 其基础研究和应用研究越来越受到重视。种质资源是开展各类研究的首要前提, 前人已经通过调查引种、有性杂交和物理诱变等各种途径 (陈小凤等, 2011;黄亚杰等, 2012;黄如葵等, 2015) , 一定程度上丰富了苦瓜资源的遗传背景。然而, 由于苦瓜并非我国原产, 国内遗传资源相对匮乏, 使苦瓜育种仍面临如何拓宽遗传背景的实际问题。近年来, 随着测序技术的飞速发展, 苦瓜全基因组序列已经相继被日本和中国研究者破解 (Urasaki et al., 2017;Cui et al., 2018) , 标志着苦瓜基因组学研究也已经迈向功能/后基因组学时代。利用EMS诱变技术构建苦瓜突变体库结合全基因组重测序或简化基因组测序等手段 (Abe et al., 2012) , 可以快速确定苦瓜突变基因以及明确其功能, 对于苦瓜分子育种以及深入阐释控制苦瓜重要农艺性状基因的分子机理具有重要意义。
参考文献:
[]陈小凤, 黄如葵, 黄玉辉, 罗海玲, 陈振东.2011.苦瓜育种及相关基础研究进展.南方农业学报, 42 (3) :246-249.
[]程欣, 任德勇, 马娇, 朱晓燕, 桑贤春, 凌英华, 赵芳明, 何光华.2013.水稻叶片灰白转黄突变体pyr1的鉴定与基因定位.作物学报, 39 (6) :992-998.
[]崔竣杰, 李波, 程蛟文, 胡开林.2015.苦瓜苦味物质及其生物合成研究进展.园艺学报, 42 (9) :1707-1718.
[]崔霞, 梁燕, 李翠, 秦蕾, 李云洲.2013.化学诱变及其在蔬菜育种中的应用.西北农林科技大学学报:自然科学版, 41 (3) :205-212.
[]黄冬福, 付文婷, 韩世玉, 何建文.2015.农作物EMS诱变研究进展.北方园艺, (24) :188-194.
[]黄如葵, 黄熊娟, 梁家作, 黄玉辉, 琚茜茜, 陈小凤, 冯诚诚, 陈振东, 刘杏连.2015.利用辐射诱变及分子标记辅助筛选进行苦瓜种质创新.南方农业学报, 46 (3) :376-380
[]黄亚杰, 运广荣, 李梅, 李长增, 肖瑜, 张斌.2012.苦瓜遗传育种研究进展.中国蔬菜, (8) :11-19.
[]康保珊, 李俊香, 刘丽锋, 古勤生.2017.甲基磺酸乙酯诱变瓠瓜种子的条件筛选.中国瓜菜, 30 (2) :7-10.
[]李浩杰, 蒲晓斌, 张锦芳, 黄驰, 宋克先, 蒋俊, 何平, 李平, 蒋梁材.2012.甘蓝型油菜EMS诱变后代农艺性状观察及分子检测.核农学报, 26 (2) :245-249.
[]刘忠松, 罗赫荣.2010.现代植物育种学.北京:科学出版社.
[]王峰, 徐飚, 杨正林, 凌英华, 何光华, 陈胜, 卿明敬, 桑贤春.2011.EMS诱变水稻矮生资源的鉴定评价.核农学报, 25 (2) :197-201.
[]王晶, 娄群峰, 魏庆镇, 李子昂, 付文苑, 陈劲枫.2015.长春密刺黄瓜突变体库的构建和部分性状分析.核农学报, 29 (8) :1479-1486.
[]王平荣, 王兵, 孙小秋, 孙昌辉, 万春美, 马晓智, 邓晓建.2013.水稻白化转绿基因gra75的精细定位和生理特性分析.中国农业科学, 46 (2) :225-232.
[]王学征, 朱娜娜, 高清宇, 刘璐, 张雅楠, 栾非时.2015.EMS诱变西瓜种子条件分析.东北农业大学学报, 46 (7) :35-39.
[]谢圣男, 王宏光, 杨振, 刘春燕, 蒋洪蔚, 辛大伟, 胡国华, 陈庆山.2013.大豆绥农14突变体库构建及株高性状分析.核农学报, 27 (3) :307-313.
[]薛存宝.2016.黄瓜EMS诱变突变体库及TILLING平台的初步构建[硕士论文].哈尔滨:东北农业大学.
[]张兵.2012.EMS诱导黄瓜突变体的初步研究[硕士论文].泰安:山东农业大学,
[]赵会芳.2005.辣椒诱变及其诱变机理的研究[硕士论文].杨凌:西北农林科技大学.
[]周书栋, 杨博智, 欧立军, 刘周斌, 吕俊恒, 马艳青, 邹学校.2017.辣椒突变体库的构建及突变群体表型变异分析.湖南农业大学学报:自然科学版, 43 (1) :31-36.
[]Abe A, Kosugi S, Yoshida K, Natsume S, Takagi H, Kanzaki H, Matsumura H, Yoshida K, Mitsuoka C, Tamiru M, Innan H, Cano L, Kamoun S, Terauchi R.2012.Genome sequencing reveals agronomically important loci in rice using MutMap.Natutre Biotechnology, 30 (2) :174-178.
[]Cui J, Cheng J, Nong D, Peng J, Hu Y, He W, Zhou Q, Dhillon N, Hu K.2017.Genome-wide analysis of simple sequence repeats in bitter gourd (Momordica charantia) .Frontiers in Plant Science, 8:1103.
[]Cui J, Luo S, Niu Y, Huang R, Wen Q, Su J, Miao N, He W, Dong Z, Cheng J, Hu K.2018.A RAD-based genetic map for anchoring scaffold sequences and identifying QTLs in bitter gourd (Momordica charantia) .Frontiers in Plant Science, 9:477.
[]Dhillon N, Sanguansil S, Schafleitner R, Wang Y, Mccreight J.2016.Diversity among a wide Asian collection of bitter gourd landraces and their genetic relationships with commercial hybrid cultivars.Journal of the American Society for Horticultural Science, 141 (5) :475-484.
[]Fang E F, Ng T B.2013.The bitter fruit with sweet health benefits:a comprehensive synopsis of recent research progress on medicinal properties of Momordica charantia//Fang E F, Ng T B.Antitumor Potential and Other Emerging Medicinal Properties of Natural Compounds.Dordrecht:Springer:315-334
[]Kim Y, Schumaker K S, Zhu J K.2006.EMS mutagenesis of Arabidopsis.Methods Molecular Biology, 323:101-103.
[]Lu X, Liu J, Ren W, Yang Q, Chai Z, Chen R, Wang L, Zhao J, Lang Z, Wang H.2018.Gene-indexed mutations in maize (Zea mays) .Molecular Plant, 11 (3) :496-504.
[]Schaefer H, Renner S.2010.A three-genome phylogeny of Momordica (Cucurbitaceae) suggests seven returns from dioecy to monoecy and recent long-distance dispersal to Asia.Molecular Phylogenetics and Evolution, 54 (2) :553-560.
[]Urasaki N, Takagi H, Natsume S, Uemura A, Taniai N, Miyagi N, Fukushima M, Suzuki S, Tarora K, Tamaki M, Sakamoto M, Terauchi R, Matsumura H.2017.Draft genome sequence of bitter gourd (Momordica charantia) , a vegetable and medicinal plant in tropical and subtropical regions.DNA Research, 24 (1) :51-58
[]van Wyk B.2015.A review of commercially important African medicinal plants.Journal of Ethnopharmacology, 176:118-134.
[]Yang G, Li S, Wang S.2016.Research progress in enzyme activity and pharmacological effects of ribosome-inactivity protein in bitter melon.Toxin Reviews, 35:128-132





