摘 要: 大气中乙二醛是二次有机气溶胶的形成推进剂,氨是雾霾生成的促进剂.本论文采用高效液相色谱-质谱联用仪器、紫外可见分光光度计和傅立叶红外光谱仪探究乙二醛与氨的液相化学反应,研究乙二醛浓度、氨水的浓度和溶液pH值等环境因素对反应产物的影响.结果发现,乙二醛与氨液相反应主要生成的是2,2'-联咪唑,利用紫外可见分光光度计在287 nm附近测得有较强的吸收峰.乙二醛与氨混合能快速反应生成2,2'-联咪唑,反应后溶液的吸光度随着乙二醛浓度增大呈现先增大后缓慢减小的趋势.随氨水浓度的增大,反应产物溶液吸光度先增大后不变.此外,强酸性的条件不利于2,2'-联咪唑的生成.
关键词: 乙二醛; 氨水; 2,2'-联咪唑; 二次有机气溶胶;
Abstract: In the atmosphere, glyoxal is the propellant of secondary organic aerosol(SOA), and ammonia is the accelerator for the formation of haze. In this paper, the liquid phase reaction of glyoxal and ammonia was investigated by high performance liquid chromatography-mass spectrometry, the UV-Visible spectrophotometer and Fourier infrared spectroscopy. The influences of environmental factors such as the concentration of glyoxal, the concentration of ammonia and the pH value of the solution on the reaction products were studied. It was found that 2,2'-bisglyoxaline mainly generated from the reaction of glyoxal and ammonia, and a strong absorption peaks near 287 nm was detected by UV-Vis spectrophotometer. The mixture of glyoxal and ammonia can produce 2,2'-benzimidazole quickly. The absorbance of the solution after the reaction increased first and then decreased slowly with the increase of the concentration of glyoxal. With the increase of ammonia concentration, the absorbance of the product solution increased first and then remained unchanged. In addition, it is adverse to the formation of 2,2'-bisglyoxaline in the presence of strong acid in the liquid phase.
Keyword: glyoxal; ammonia; 2,2'-bisglyoxaline; SOA;
乙二醛含有两个醛基,是最简单的脂肪族二元醛,具有一些特殊的化学性质[1,2],它在医药、建材等行业都得到了广泛运用[3,4].大气中的乙二醛主要来源于生物质燃烧的直接排放、生物源(森林)和人为源(汽车尾气、化石燃料)排放的挥发性有机物(VOCs)的氧化作用产生的[5].大气中乙二醛的排放量约为45 Tg/年,其中55%由异戊二烯等生物源光氧化产生,20%来自生物质燃烧[6].乙二醛具有一定的毒性,除了会刺激人体皮肤、眼睛外,还具有致癌性、致突变等遗传毒性[7,8].排放到大气中乙二醛能与OH自由基等氧化剂发生光化学反应形成二次有机气溶胶(SOA)粒子.此外,乙二醛能溶于云层、水雾并发生液相反应产生半挥发性和难挥发性产物,待水分蒸发后,这些产物保留在颗粒相中形成SOA粒子[9,10].SOA是大气细颗粒物(PM2.5)的主要成分,它们能够吸收、散射太阳光,降低大气的可见度,其对空气质量、气候变化和人体健康有着显着的影响[11,12].因此,乙二醛的液相化学反应得到了人们的广泛关注.
畜牧养殖业和农业活动等,会直接或者间接释放出大量氨气[13,14].氨气是一种有强烈的刺激性气味的无色气体,极易溶于水.在空气中,它会刺激人和动物的呼吸系统.人体吸入氨气后,氨气刺激、腐蚀眼结膜、皮肤粘膜,导致组织发炎,减弱人体对各种疾病的抵抗能力[15,16].在大气中的氨气会溶于水,与硫酸和硝酸反应生成颗粒状的硫酸铵和硝酸铵.生成的这两种铵盐是雾霾颗粒物的主要成分.所以大气中的氨气对雾霾颗粒物的生成有重要作用[17].李京海等[18]利用乙二醛和氨水合成联咪唑.但是,关于环境因素对乙二醛和氨的液相化学反应产物影响的研究却鲜见报道.
本文主要研究乙二醛与氨的液相反应产物,探究环境因素对乙二醛与氨液相化学反应产物的影响.此次实验研究主要利用高效液相色谱-质谱联用仪器、紫外-可见分光光度计和傅立叶红外光谱仪定性定量的测量乙二醛与氨的液相反应的反应产物,用紫外可见分光光度计测量在不同的乙二醛浓度、不同的氨浓度、不同的溶液pH值以及不同的金属离子环境中反应产物的吸光度,分析其规律.这些规律可帮助我们进一步了解醛类物质与氨污染的大气液相反应,为雾霾治理提供实验依据.

1、 实验部分
1.1、 仪器与试剂
紫外可见分光光度计(UV-6100s型,上海Mapada公司),液相色谱-质谱联用仪器(AgilentXCT,安捷伦科技有限公司),红外光谱仪(Thermo NICOLET iS 10,Thermo Fisher Scientific,America),pH计(上海雷磁PHS-3C).
本实验所用的分析纯级试剂包括浓氨水(NH3,AR,25%~28%)、乙二醛(C2H2O2,AR,40%)、盐酸(HCl,AR,36.0%~38.0%)、氢氧化钠(NaOH,AR,≥96.0%),甲醇(GR,≥99.7%)和正己烷(GR,≥98%),均购于西陇化工股份有限公司.
1.2、 实验内容
由于乙二醛具有较高的Henry常数,水溶性强,易溶于雨水、雾滴等水相中,大气雨水、雾滴中乙二醛的浓度为0.01~0.2 mmol/L[19].为了更好的模拟大气水相中乙二醛和氨液相反应,将乙二醛的浓度配制配制为0.05 mmol/L,氨的浓度配制配制为0.10 mmol/L,使乙二醛和氨的浓度配比为1︰2,让乙二醛反应完全.在250 mL容量瓶中配制0.05 mmol/L乙二醛和0.1 mmol/L氨混合溶液250 mL,用盐酸调节pH为7后转移到500 mL试剂瓶中.尽管氨和乙二醛具有一定的挥发性,但是实验配制的浓度低,又是保存在试剂瓶中,因而可以忽略其挥发损失.为了更好模拟大气液相反应过程,混合溶液未搅拌,而是静置让其缓慢反应.每隔1天取少量溶液稀释10倍后用紫外可见分光光度计测量吸收光谱.静置10天后,将反应溶液稀释10倍,采用高效液相色谱-质谱联用仪器、紫外可见分光光度计和傅立叶红外光谱仪测量液相反应产物.
乙二醛浓度实验中,在9个250 mL容量瓶中保持氨水的浓度(0.1 mmol/L)不变,依次在容量瓶中配制0、0.01、0.05、0.1、0.2、0.4、0.6、0.8和1.0 mmol/L乙二醛,用盐酸将得到0.1 mmol/L氨和不同浓度乙二醛的混合溶液pH调节为7后转移到500 mL试剂瓶.氨浓度因素实验中,在9个250 mL容量瓶中保持乙二醛的浓度(0.05 mmol/L)不变,依次在容量瓶中配制0、0.01、0.05、0.1、0.2、0.4、0.6、0.8和1.0mmol/L氨,用盐酸将得到0.05 mmol/L乙二醛和不同浓度氨的混合溶液pH调节为7后转移到500 mL试剂瓶.pH因素实验中,在9个250 mL容量瓶中保持0.05和0.1 mmol/L乙二醛和氨不变,分别用0.1 mol/L HCl和NaOH溶液依次调节溶液,采用pH计测量溶液的pH值,使其pH为1、3、5、9、11、13后转移到500mL试剂瓶中.上述各因素实验,混合溶液静置10天,待反应完全后将溶液稀释10倍,用紫外可见分光光度计测量吸收光谱.
2、 实验结果与讨论
2.1、 乙二醛与氨液相反应产物的测量
以去离子水作为参比,采用UV-6100s型紫外-可见分光光度计(上海Mapada公司)测量乙二醛与氨液相反应产物在200~500 nm范围内的吸收情况.图1是10天后,乙二醛、氨水以及两者混合反应溶液的紫外-可见吸收光谱图.由图1可知,波长在200~400 nm之间,乙二醛、氨水溶液没有吸收峰存在;而乙二醛和氨水混合10天后的反应溶液在214 nm、287 nm附近有吸收峰出现,这说明有新物质生成.Kampf等[20]利用紫外可见光谱测量乙二醛和硫酸铵的液相反应产物时也观察到214 nm和287 nm的吸收峰.他们认为乙二醛与铵离子反应形成的2,2'-联咪唑分子中C=C双键π→π*的电子吸收跃迁产生了214 nm的吸收峰,而C=N双键n→π*的电子吸收跃迁则产生了287 nm的特征吸收峰.根据Liu等[21]的实验结果,铵离子失去氢离子后,NH3分子N原子孤对电子更容易亲核进攻乙二醛羰基上的氧原子,因而氨比铵离子具有较强的反应活性,乙二醛与氨的液相反应生成了2,2'-联咪唑.
图1 10天后乙二醛、氨水及两者混合反应溶液的紫外-可见吸收光谱图
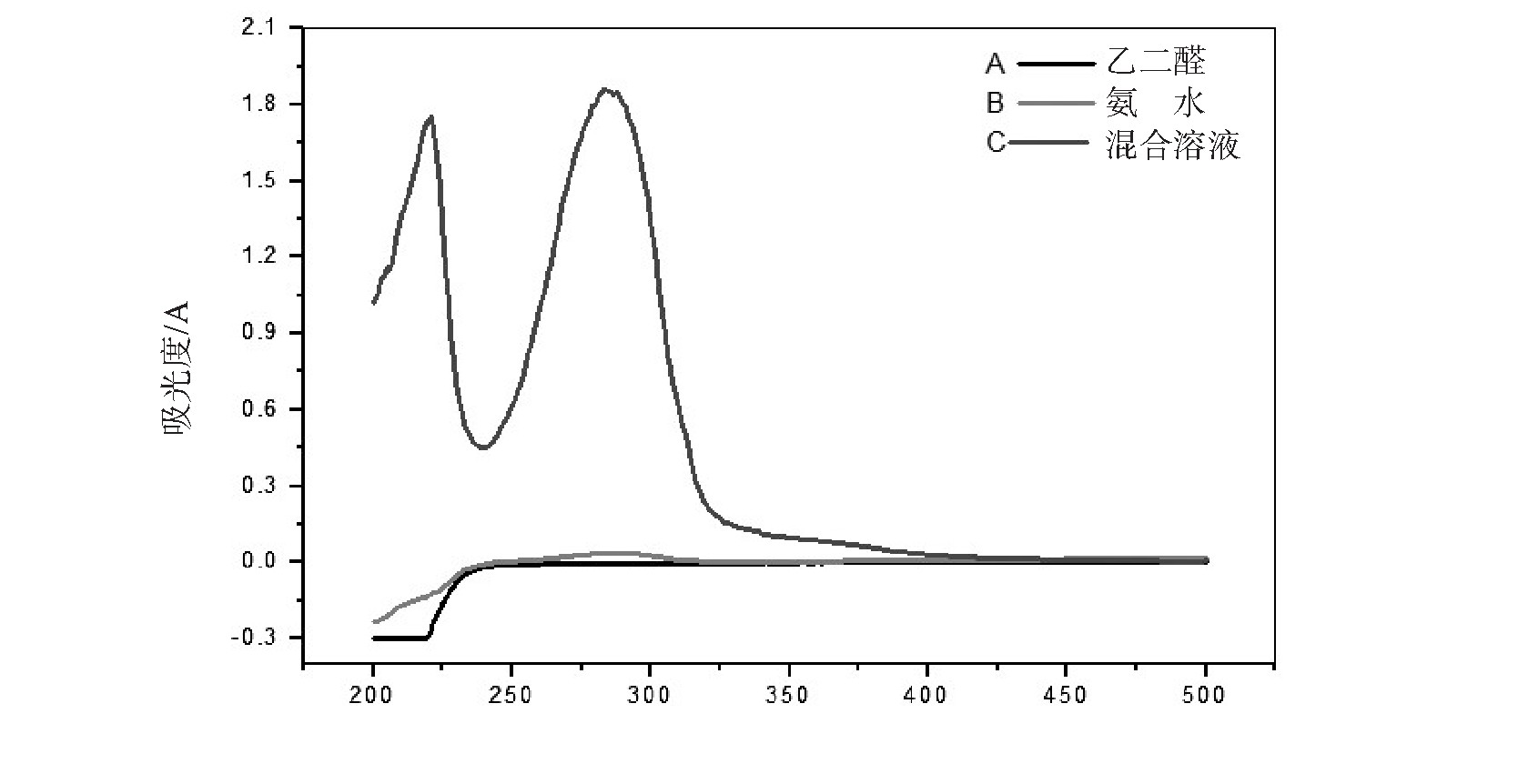
Fig.1 Ultraviolet-visible absorption spectra of glyoxal,ammonia and the mixed reaction solution after 10 days
反应产物溶液在287 nm的吸光度随静置天数的变化情况如图2所示.随着静置天数的增加,反应时间的延长,产物溶液在287 nm的吸光度随之增大,静置10天时,吸光度达到最大值1.832.而10天后吸光度基本保持不变,这表明静置10天,乙二醛与氨反应完全.为了验证生成的主要产物是联咪唑,利用红外光谱仪对反应10天后的溶液进行测量,得到红外光谱图如图3所示.参照Liu等[21]的指认方法,图3所示的红外谱图中,在3 137 cm-1、2 985、2 896 cm-1有吸收峰,说明有咪唑环的存在;1 685 cm-1处有吸收峰,表明液相反应产物存在N-H键;在1 514 cm-1、1 388 cm-1处有吸收峰,表明液相反应产物存在C=C键;在1 360~1 000 cm-1有较强的吸收,说明液相反应产物中存在C-N键.在874 cm-1有吸收峰,表明液相反应产物存在C=N键;根据红外吸收谱图,符合2,2'-联咪唑的特征.
图3 乙二醛与氨液相反应产物的红外光谱图
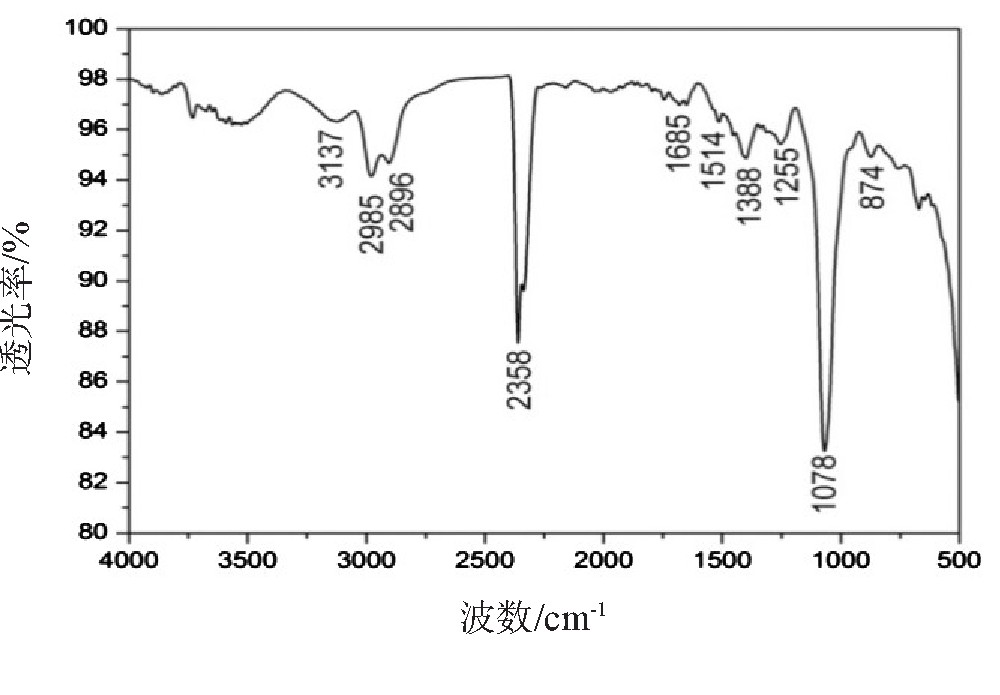
Fig.3 Infrared spectra of the reaction products of glyoxal and ammonia in liquid phase
图2 乙二醛与氨液相反应产物溶液在287 nm处的吸光度随反应时间关系图
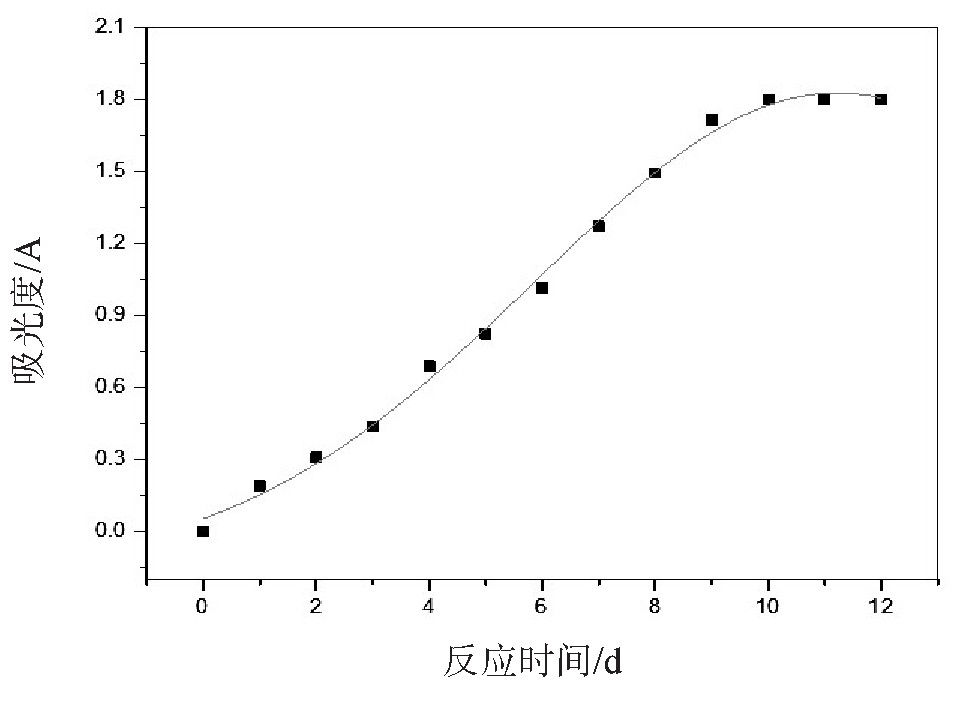
Fig.2 The relationship between the absorbance of the reaction product of glyoxal and ammonia at 287 nm and the reaction time
利用安捷伦科技有限公司生产的AgilentXCT高效液相色谱质谱仪乙二醛与氨的液相反应产物.该质谱仪采用电喷雾(ESI)电离,以甲醇和正己烷的混合溶液作为流动相,其体积比为2︰3,流速为0.20 mL/min.测得的正离子质谱图如图4所示.正离子质谱图存在最大的离子峰,其质荷比m/z 134,也存在质荷比m/z 28,41,67等碎片离子峰.根据前期的文献实验结果和NIST数据库的对照,可以验证乙二醛与氨的液相产物为2,2'-联咪唑(C6H6N4).m/z 134对应为2,2'-联咪唑的分子离子峰(C6H6N4+),m/z 28,41和67依次对应为分子离子峰断裂产生的CH2N+,C2H3N+和C3H3N2+特征碎片离子[22,23].综上,可以确认乙二醛与氨的液相反应产物为2,2'-联咪唑.值得注意的是,实验未检测到高分子量的缩聚产物,这可能是因为实验中使用的氨的浓度(0.01~1 mmol/L)远小于Nozière等[24]的使用硫酸铵的浓度(0.5~4 mmol/L),不会发生铵根离子引起的缩聚反应.
图4 乙二醛与氨液相反应产物的正离子质谱图
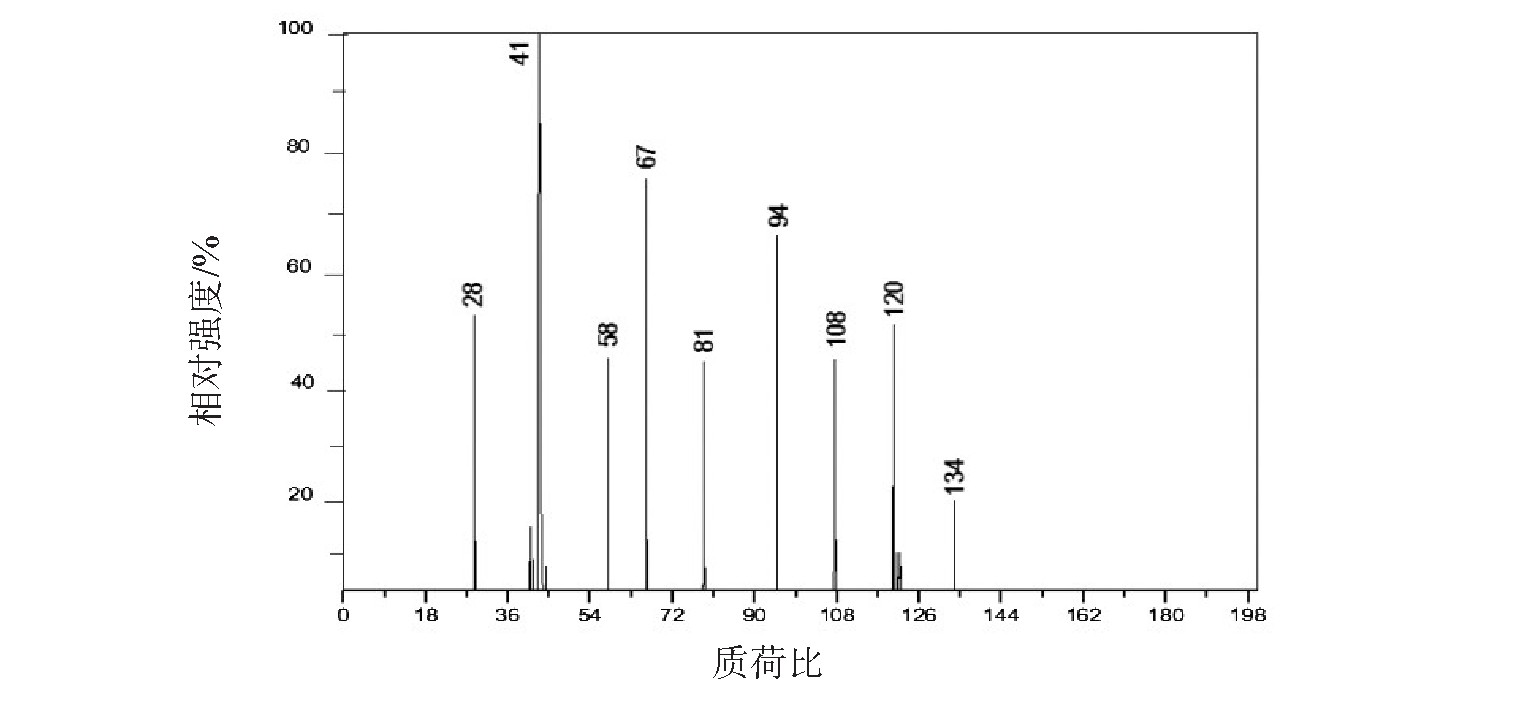
Fig.4 Positive ion mass spectrometry of the reaction product of glyoxal and ammonia in liquid phase
2.2 、乙二醛浓度对反应产物的影响
随着乙二醛浓度的变化,乙二醛与氨液相反应产物溶液的紫外可见吸收光谱图如图5所示.不同乙二醛浓度条件下,产物溶液在287 nm处吸收峰的位置基本不变.乙二醛浓度从0 mmol/L递增至0.05 mmol/L时,反应产物在287 nm处的吸光度逐渐增大;当乙二醛浓度大于0.05 mmol/L时,反应产物在287 nm处的吸光度随乙二醛浓度的增大而缓慢减小.根据Kampf等[20]提出的液相反应机理,乙二醛与氨按如下反应形成联咪唑产物,
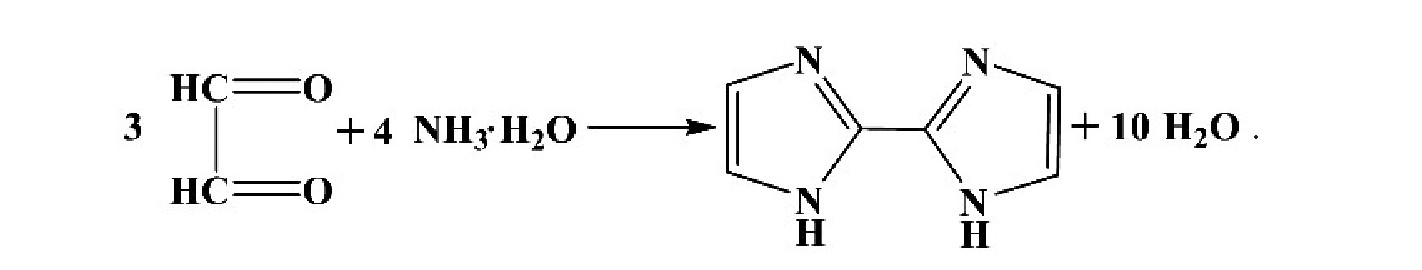
乙二醛与氨以3︰4的物质的量反应形成联咪唑.实验中保持氨的浓度(0.1 mmol/L)不变,当乙二醛的浓度小于0.05 mmol/L时,乙二醛和氨物质的量比小于3︰4,乙二醛全部转化为联咪唑,产物溶液在287 nm处的吸光度随乙二醛浓度的增大而逐渐增大.当乙二醛的浓度为0.05 mmol/L时(乙二醛和氨物质的量比为1︰2),产物溶液在287 nm处的吸光度达到最大值.而当乙二醛的浓度大于0.05 mmol/L,乙二醛与氨的物质的量之比大于3︰4,氨被消耗完毕,而溶液中还有乙二醛.根据Kampf等人[20]的实验结果,当乙二醛过量,乙二醛与氨物质的量比大于1︰1时,生成的少量联咪唑继续与乙二醛水化物反应产生联咪唑缩聚物,导致其浓度缓慢下降,对应于287 nm处吸光度缓慢减小.
图5 不同乙二醛浓度下反应产物溶液的紫外-可见吸收光谱图
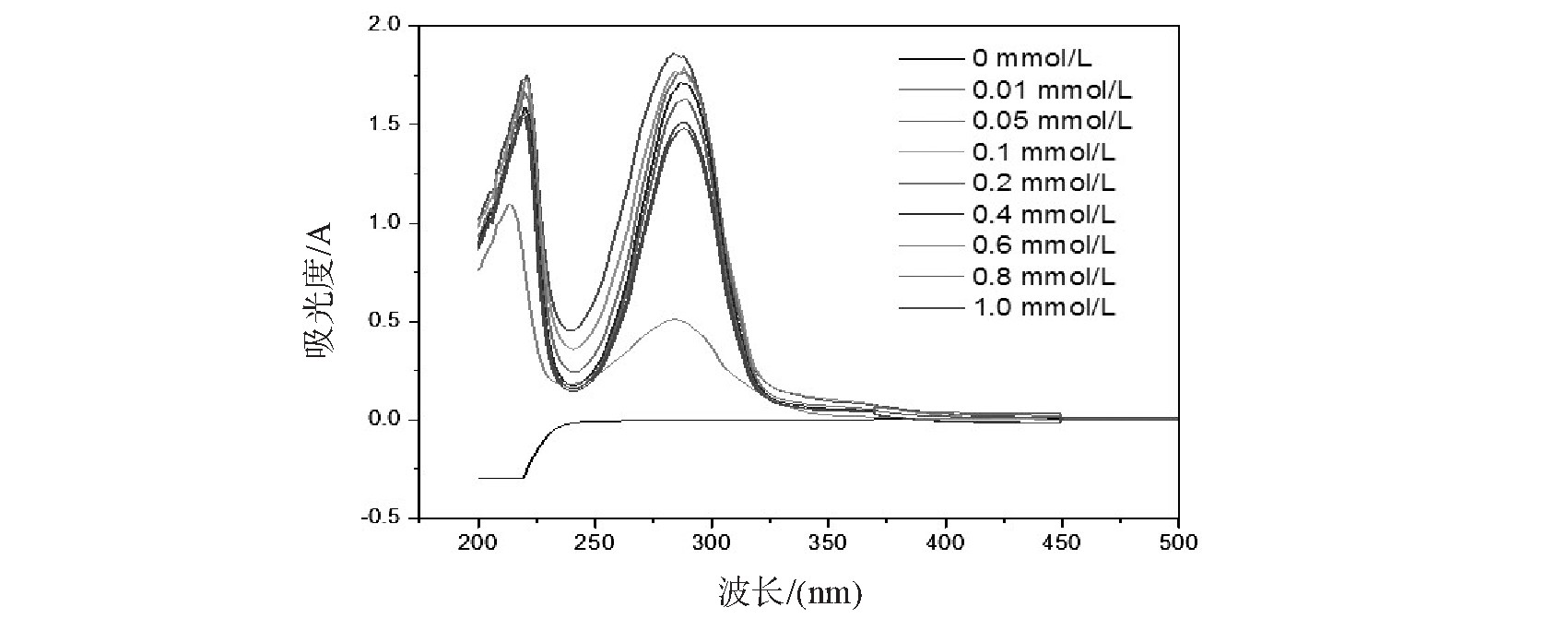
Fig.5 Ultraviolet-visible absorption spectra of reaction products solution with different concentration of glyoxal
2.3、 氨浓度对反应产物的影响
不同浓度的氨与乙二醛混合溶液的液相反应产物在287 nm处吸光度随氨浓度变化情况如图6所示当氨浓度从0 mmol/L递增至0.1 mmol/L,反应产物2,2'-联咪唑的吸光度逐渐增大.当氨的浓度大于0.1 mmol/L时,反应产物的吸光度变化不明显.实验中保持乙二醛的浓度(0.05 mmol/L)不变,当氨的浓度比较低时(0.01 mmol/L),生成的2,2'-联咪唑的浓度较低,因此产物的吸光度较小.随着氨浓度不断,产物溶液在287 nm处的吸光度随之增大,并在氨的浓度为0.1 mmol/L时(乙二醛和氨物质的量比为1︰2),产物溶液在287 nm处的吸光度达到最大.而当氨的浓度大于0.1 mmol/L时,乙二醛和氨物质的量比大于3︰4,乙二醛被消耗完毕,溶液中没有乙二醛与之反应产生2,2'-联咪唑,所以吸光度几乎不变.
图6 乙二醛与氨液相反应产物在287 nm的吸光度与氨水浓度的关系图
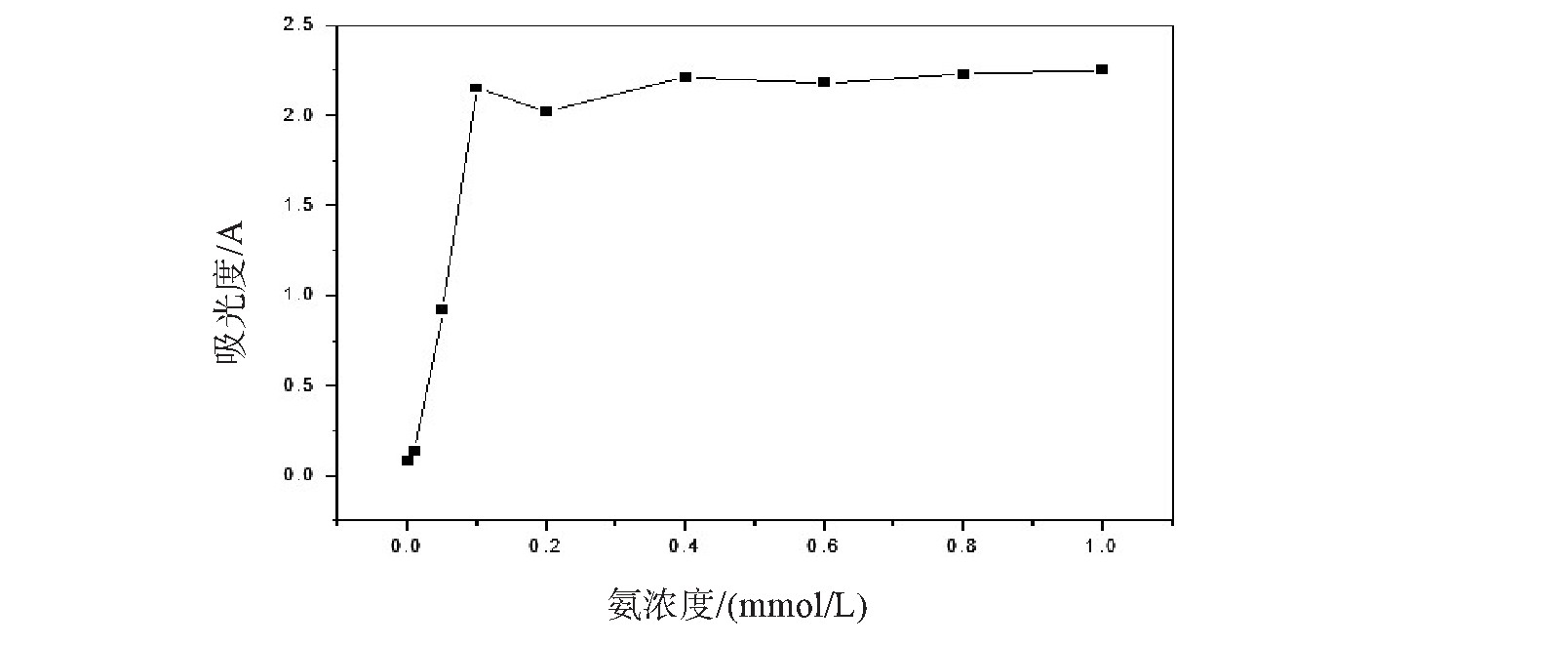
Fig.6 The relationship between the absorbance of the reaction product of glyoxal and ammonia at 287 nm and ammonia concentration
2.4、溶液pH值对反应产物的影响
图7为在287 nm处乙二醛与氨液相反应产物的吸光度与溶液pH的关系图.由图7可知,在强酸性的条件下(pH=1),287 nm处的吸光度最小.2,2'-联咪唑在pH=7时,287 nm处吸光度最大;当pH>7时,287 nm处的吸光度随着pH增大而逐渐减小,但是减小幅度很小.这表明强酸性溶液不利于2,2'-联咪唑的产物的形成.这主要是因为NH3分子N原子孤对电子亲核进攻乙二醛羰基上的氧原子形成二亚胺中间产物,二亚胺再经过一系列反应形成2,2'-联咪唑产物[21].而在强酸性条件下,氨与H+离子结合形成铵根离子,N原子孤对电子与氢离子形成共价键,亲核进攻能力显着降低,因而不利于2,2'-联咪唑的产物的形成.
图7 乙二醛与氨液相反应产物在287 nm的吸光度与溶液pH的关系图
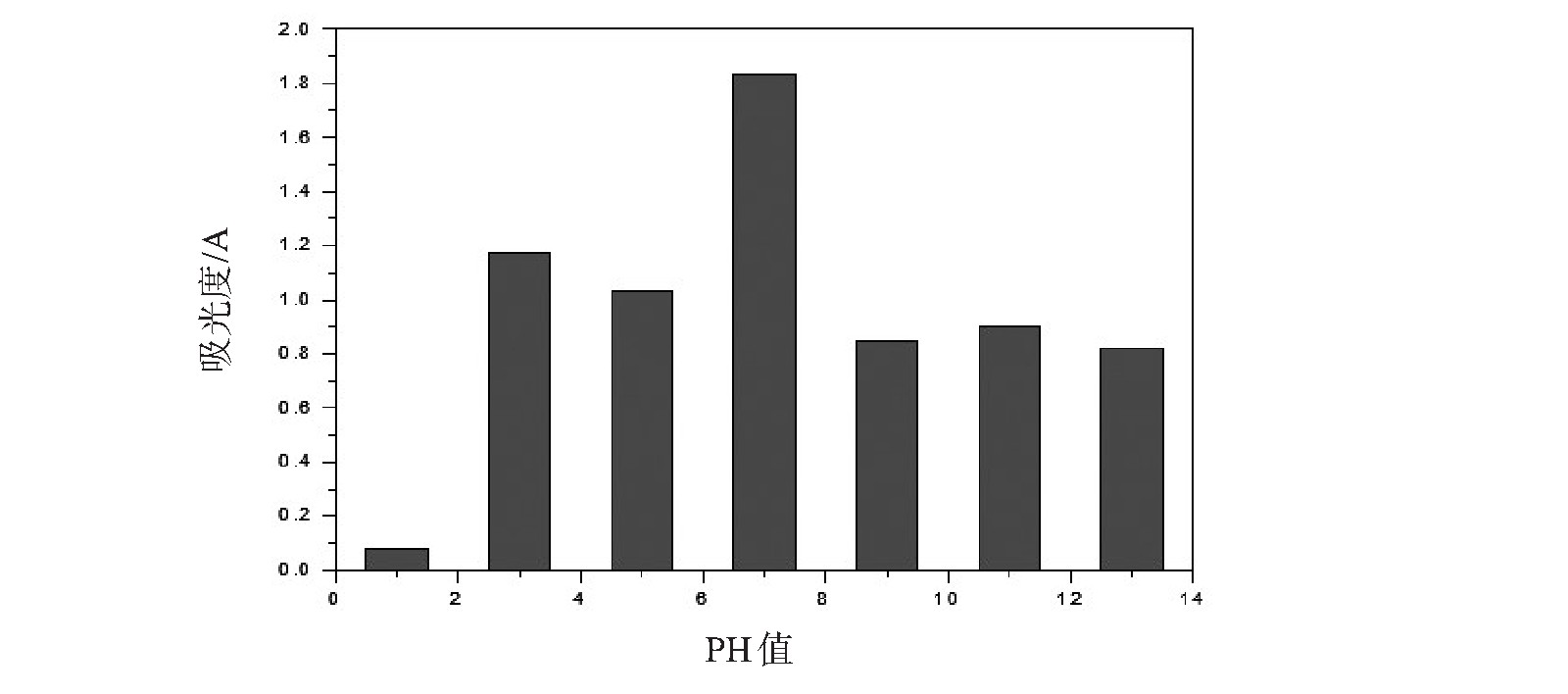
Fig.7 The relationship between the absorbance of the reaction product of glyoxal and ammonia at 287 nm and the pH of the solution
3 、结论
本论文主要采用高效液相色谱-质谱联用仪器、紫外可见分光光度计和傅立叶红外光谱仪探究乙二醛与氨的液相反应,测得主要产物是2,2'-联咪唑,其在287 nm附近有较强的吸收峰.反应产物溶液的吸光度随着乙二醛浓度增大呈现先增大后缓慢减小的趋势.随氨水浓度的增大,反应产物溶液吸光度先增大后不变.溶液的pH值虽然可以改变NH3的形态,但是强酸性条件抑制2,2'-联咪唑的产生.
参考文献
[1] LU X W,LIANG L X,PIZZI A,et al.Bioresourced pine tannin/furanic foams with glyoxal and glutaraldehyde[J].Biochimicaet Biophysica Acta,2018,1862(9):1938-1947.
[2] 沈仕亮,王珊珊,周斌.基于差分光学吸收光谱法的大气甲醛和乙二醛研究[J].光谱学与光谱分析,2016,36(8):2384-2390.
[3] LACOSTE C,BASSO M C,LIU J W,et al.Development and characterization novel bio-adhesive for wood using kenaf core(Hibiscus cannabinus)lignin and glyoxal[J].International Journal of Biological Macromolecules,2019,122(1):713-722.
[4] 朱凯棋,李美真.盐酸水解淀粉/乙二醛对棉织物抗皱整理的研究[J].国际纺织导报,2017,45(7):32,34-36.
[5] ZARZANA K J,MIN K E,WASHENFELDER R A,et al.Emissions of glyoxal and other carbonyl compounds from agricultural biomass burning plumes sampled by aircraft[J].Environmental Science&Technology,2017,51(20):11761-11770.
[6] MITSUISHI K,IWASAKI M,TAKEUCHI M,et al.Diurnal variations in partitioning of atmospheric glyoxal and methylglyoxal between gas and particles at the ground level and in the free troposphere[J].ACS Earth and Space Chemistry,2018,2(9):915-924.
[7] ARCANJO N M O,LUNA C,MADRUGA M S,et al.Antioxidant and pro-oxidant actions of resveratrol on human serum albumin in the presence of toxic diabetes metabolites:glyoxal and methyl-glyoxal[J].Biochimica et Biophysica Acta,2018,1862(9):1938-1947.
[8] CHEN H C,LIU C T,LI Y J.Correlation between glyoxal-induced DNA cross-links and hemoglobin modifications in human blood measured by mass spectrometry[J].Chemical Research in Toxicology,2019,31(1):179-189.
[9] GOMEZ M E,LIN Y,GUO S,et al.Heterogeneous chemistry of glyoxal on acidic solutions.An oligomerization pathway for secondary organic aerosol formation[J].Journal of Physical Chemistry A,2015,119(19):4457-4463.
[10] BERKE A E,BHAT T A,MYERS H,et al.Effect of short-chain alcohols on the bulk-phase reaction between glyoxal and ammonium sulfate[J].Atmospheric Environment,2019,198:407-416.
[11] BALTENSPERGER U.Aerosols in clearer focus[J].Science,2010,329:1468-1470.
[12] CHEN D,ZHAO Y,LYU R T,et al.Seasonal and spatial variations of optical properties of light absorbing carbon and its influencing factors in a typical polluted city in Yangtze River Delta,China[J].Atmospheric Environment,2019,199:45-54.
[13] CHANG Y H,ZOU Z,ZHANG Y L,et al.Assessing contributions of agricultural and nonagricultural emissions to atmospheric ammonia in a Chinese megacity[J].Environmental Science&Technology,2019,53(4):1822-1833.
[14] LI S Y,LANG J L,ZHOU Y,et al.Trends in ammonia emissions from light-duty gasoline vehicles in China,1999-2017[J].Science of The Total Environment,2020,700(134359):1-9.
[15] HOSEINI S M,YOUSEFI M Y,HOSEINIFAR S H,et al.Antioxidant,enzymatic and hematological responses of common carp(Cyprinus carpio)fed with myrcene-or menthol-supplemented diets and exposed to ambient ammonia[J].Aquaculture,2019,506:246-255.
[16] XING H J,PENG M Q,LI Z,et al.Ammonia inhalation-mediated mir-202-5p leads to cardiac autophagy through PTEN/AKT/m TOR pathway[J].Chemosphere,2019,506:858-866.
[17] PAN Y P,TIAN S L,ZHAO Y H,et al.Identifying ammonia hotspots in China using a national observation network[J].Environmental Science&Technology,2018,52(7):3926-3934.
[18] 李京海,王建龙,王中洋,等.联咪唑合成及工艺优化[J].河北化工,2012,35(12):21-22,35.
[19] TAN Y,PERRI M J,SEITZINGER S P,et al.Effects of precursor concentration and acidic sulfate in aqueous glyoxal-OHradical oxidation and implications for secondary organic aerosol[J].Environmental Science&Technology,2009,43(21):8105-8112.
[20] KAMPF C J,JAKOB R,HOFFMANN T.Dentification and characterization of aging products in the glyoxal/ammonium sulfate system-implications for light absorbing material in atmospheric aerosols[J].Atmospheric Chemistry and Physics,2012,12(14):6323-6333.
[21] LIU Y,LIGGIO J,STAEBLER R,et al.Reactive uptake of ammonia to secondary organic aerosols:kinetics of organonitrogen formation[J].Atmospheric Chemistry and Physics,2015,15(23):13569-13584.
[22] POWELSON M H,ESPELIEN B M,HAWKINS L N,et al.Brown carbon formation by aqueous-phase carbonyl compound reactions with amines and ammonium sulfate[J].Environmental Science&Technology,2014,48(2):985-993.
[23] MAXUT A,NOZI?RE B,FENET B,et al.Formation mechanisms and yields of small imidazoles from reactions of glyoxal with NH4+in water at neutral p H[J].Physical Chemistry Chemical Physics,2015,17(31):20416-20424.
[24] NOZI?RE B,DZIEDZIC P,C?RDOVA A.Products and kinetics of the liquid-phase Reaction of glyoxal catalyzed by ammonium ions(NH4+)[J].Journal of Physics Chemistry A,2009,113(1):231-237.





