转基因技术的问世给世界带来了经济、社会、生态等多方面的效益,成为新一代绿色革命的利器,是农业近代史上发展最快的新技术。国际农业生物技术应用服务组织( International Servicefor the Acquisition of Agri-biotech Applications,ISAAA) 2013 年报告指出,全球有 27 个国家种植了转基因作物,种植面积比 2012 年增加了 500 万hm2。自 1996 年种植以来的 18 年间,从最初的170 万 hm2增加到 1. 75 亿 hm2,增长速度惊人。
可见,转基因技术的发展呈现不可阻挡的趋势。
但随着该技术的发展,其安全性问题备受瞩目,其中花粉介导的基因飘流及其可能引起的环境后果是人们关注的焦点之一。研究者们为降低转基因向其他物种的飘流做过许多尝试,包括物理隔离和众多生物学措施,各种措施因物种和基因本身等性质有其各自的优缺点,目前尚未明确哪种措施最简单有效,且具有通用性。
基因拆分技术是建立在内含肽 intein 及其介导的蛋白质剪接的基础上发展起来的,将目的基因拆分成两个片段,分别与 intein 两个剪接域的基因序列结合,形成融合基因,翻译后形成的两个融合蛋白通过 intein 介导的蛋白质剪接功能,将intein 从前体蛋白中切除,同时将两个基因片段编码的蛋白质序列连接起来,形成一个完整的、有功能的蛋白质。基因拆分技术的提出为通过生物学措施控制转基因飘流提供了新的思路和途径。
1 基因拆分技术的理论基础
1. 1 Intein 的概念及分类
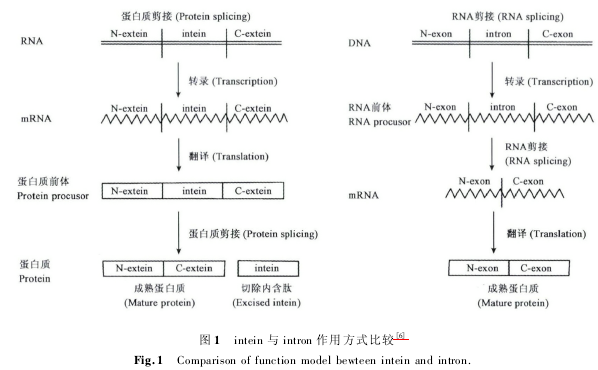
内含肽 intein 是存在于蛋白质前体中的一段氨基酸序列,与两侧的外显肽( extein) 存在于同一个表达框中,同时表达成前体蛋白,在前体蛋白成熟的过程中,intein 通过自剪接的方式将自身从中切除出去,同时将两端的外显肽以肽键的形式连接起来,该过程也被称为蛋白质的自我剪接。与 RNA 内含子( intron) 类似,蛋白质内含肽属于可以移动的遗传元件,内含肽的剪接反应发生于蛋白质水平,而且反应过程不需要任何辅助因子的参与( 图 1)。
1990 年,intein 首次在研究酿酒酵母液泡H+-ATPase 基因 TGPl 时被发现。其后的 20几年里,intein 的研究和应用发展非常迅速。截至2010 年,在 Inbase 数据库中注册的内含肽达 585 个,其中112 个在真核生物中,290 个在细菌中,另外 183个属于古细菌。目前仅在单细胞真核生物中发现intein,而在高等动、植物,甚至低等多细胞真核生物中都没有发现内含肽的存在。
关于内含肽的分类有很多说法,常见的是根据内含肽中间结构域的类型将内含肽分为经典内含肽、微小内含肽和断裂内含肽。经典内含肽的中间结构域为归巢核酸内切酶结构域,微小内含肽的中间结构域仅为一个连接结构域,而断裂内含肽在中间结构域的特定位点断开,在基因组中不同的位置独立表达。经典内含肽与微小内含肽的中间结构域有共价连接,因此也叫做顺式剪接内含肽( cis-splicing intein) ; 断裂内含肽的中间结构域无共价键连接,也叫做反式剪接内含肽( trans-splicing intein) 。Ssp DnaE 内含肽( Syne-chocystis sp. PCC6803 DnaE intein) 是发现的第一个天然存在的断裂内含肽,存在于编码 DNA 聚合酶Ⅲ的催化亚基 α 的 DnaE 基因中,包括 123 个氨基酸残基的 In ( Intein N 端) 和 36 个氨基酸残基的 Ic ( Intein C 端) 两个结构域,In 和 Ic 在基因组上相距 745 kb。与人工合成的 intein 相比,DnaE intein 催化的蛋白质剪接具有反应效率高和反应条件温和等特点。实验证明 Ssp DnaEintein 在离体、活体条件下均能进行蛋白质的剪接反应,使分开的两个基因片段表达后的蛋白质片段重新组装成有功能的完整蛋白质。
众多研究证明,内含肽的自我剪接并不依赖于其两侧外显肽的种类,也就是说,当外显肽被外源蛋白质替换掉时,该剪接作用依然可以发生。同时,内含肽自剪接反应是自发进行的,甚至可以在体外进行。这给利用intein 进行更多的蛋白质工程和植物基因工程研究提供了崭新的思路。
1. 2 Intein 的剪接机制
根据内含肽的保守性及其特点,多数内含肽被分为10 个模块,从 N 端到 C 端依次是存在于 N端的 A、N2、B 和 N4,位于核酸内切酶结构域的C、D、E 和 H,以及位于 C 端的 F 和 G。经研究,普遍认为 A、B、F 和 G 是 intein 维持结构或进行剪接反应所必需的。在对众多 intein 的保守性氨基酸的研究中发现,有 4 个高度保守的位点对intein 剪接功能有重要作用,包括: A ∶ 1 位置的Ser、Thr 或 Cys; G 末端的 Asn; C-extein 的第一氨基酸 Ser、Thr 或 Cys,以及 intein 的倒数第二个氨基酸 His。后来的研究也认为 B∶ 10 位的 His对剪接过程也有很重要的影响。目前对内含肽的剪接机制已经研究的非常透彻,普遍认为内含肽的自我剪接分为四个阶段,分别是:
①N-X酰基转移反应( X 代表 O 原子或 S 原子,后同) : 这是第一个酰基转移反应,A∶ 1 位的 S 或 O原子攻击其上游肽键的 C 原子,使 N 端的外显肽转移到 N 端剪接域的 Ser 氧原子或 Cys 硫原子上,形成带有酯键或硫酯键的中间产物。大多数intein N 端的第一个氨基酸残基为 Cys 或 Ser。②转酯反应: C 端剪接域的亲核残基攻击 N 端在第一步形成的酯键或硫酯键,进行转酯反应,至此,N-extein 转移到 C 端剪接域的 Ser( Thr) 的 O 原子或 Cys 的 S 原子上,C 端剪接域的第一个氨基酸残基可以是 Cys、Ser 或 Thr。③Asn 环化反应: C端剪接域的 Asn 环化使内含肽与 C-extein 之间发生断裂,将内含肽剪切下来。④X-N 酰基转移反应: 这是第二个酰基转移反应,通过酯键或硫酯键连接的两个 extein 经过重排形成肽键,内含肽脱离,形成成熟蛋白质。
1. 3 Intein 衍生的新技术
内含肽的发现和研究给蛋白质工程研究提供了众多便利条件。利用内含肽的剪接作用,可以进 行 蛋 白 质 的 纯 化、表 达 蛋 白 的 连 接( EPL)、蛋白质的环化、毒蛋白的大量合成,以及多聚体蛋白合成等。在人们广泛关注的转基因安全问题中更是具有巨大的潜力。利用基因拆分技术将外源基因在植物体内拆分表达后再组装成有功能的蛋白,在很大程度上限制了该基因向近缘物种的飘流,基因拆分技术的研究很可能为安全转基因提供强大的技术支撑。
2 基因拆分技术在限控转基因飘流中的应用
断裂内含肽的发现为利用基因拆分技术限控转基因飘流提供了有用的工具。但基因拆分技术能否作为一项有效措施用于限控转基因飘流,这取决于基因拆分后在植物体内重新组装成有功能蛋白质的效率及限控转基因飘流的效果。
2. 1 基因拆分后在植物体内的重新组装效率
Chin 等把耐除草剂基因 epsps 分成 N 端和C 端两部分,N 端与叶绿体定位信号和 Ssp DnaEintein 的 In 融合形成 EPSPSn-In,并通过农杆菌介导法将 EPSPSn-In 整合到烟草核基因组中; C端与 Ssp DnaE intein 的 Ic 融合形成 Ic-EPSPSc,利用基因枪法将 Ic-EPSPSc 整合到含有 EPSPSn-In 烟草的叶绿体基因组中。结果同时含有 EP-SPSn-In 和 Ic-EPSPSc 的转基因烟草表现出了抗草甘膦的特性,证明了 intein 介导的蛋白转剪接可以在植物叶绿体中发生。Yang 等将 β-葡糖醛酸苷酶基因 gus 的 N 端和 C 端分别与 Ssp DnaEIntein 的 In 和 Ic 连接形成融合基因 GUSn / In 和Ic / GUSc,利用共转化或有性杂交的方法将 GUSn / In和 Ic/GUSc 导入到拟南芥基因组中,同时含有两个基因片段的转基因拟南芥成功表达了 GUS 活性。
Gils 等利用 intein 介导的 Barnase 蛋白重新组装系统创立了一种全新的制备小麦雄性不育系的方法,首次通过杂交使杂交种中同时含有 N、C 两个片段,并得到产生不可育花粉的植株。2009 年,Kempe 等也在小麦中证实 intein 可在小麦中恢复拆分后的 Barnase 基因的功能,说明intein 介导的蛋白转剪接不仅在模式植物中,在单子叶植物中同样也能发挥功能。抗草甘膦的 G2-aroA 在 F295 / S296 位点拆分后,能够在 intein 介导的转剪接作用下组装成有活性的功能蛋白。
靳茜等根据 G2-aroA 基因的可拆分位点 F295/T296,利用 PCR 方法将 G2-aroA 基因分成 N 端和C 端两部分,并分别与 Ssp DnaE intein 的 N 端和C 端连接,形成融合基因片段 EnIn 和 IcEc,通过农杆菌介导法分别导入烟草核基因组中,通过杂交获得同时含有 2 个片段的转基因烟草,证明G2-aroA 基因拆分后在烟草叶绿体中重新组装成完整有功能的蛋白的效率可达到 100%。
2. 2 基因拆分技术限控转基因飘流的效果
基因拆分技术用于限控基因飘流的优势是它降低了目标基因从转基因植株向近缘野生种飘移的概率( 图 2) 。理论上,基因拆分技术限控转基因飘流的效果与两个基因片段的插入位点密切相关。根据孟德尔遗传规律,假如拆分后的两个基因片段插入到转基因植物的非同源染色体上,杂交后代产生的花粉中有 25% 同时含有两个基因片段; 当两个基因片段插入到同源染色体上时,如果不考虑染色体交换,杂交后代的花粉中同时含有两个基因片段的概率为0。靳茜等通过有性杂交的方法获得同时含有 EPSPSn-In 或 Ic-EPSPSc 的转基因烟草,自交试验证明了两个基因片段插入在非同源染色体上,回交试验结果表明后代中有 23. 61% 的植株具有草甘膦抗性,与两个基因片段插入非同源染色体上时 25% 为抗性苗的假设相符,证明了利用基因拆分技术培育的转基因植物中,其外源基因向有性杂交种的基因飘流频率至少能够降低 75%。
3 问题与展望
粮食发展的目标不仅要让人们吃得饱,还要吃得好、吃的安全,这为转基因技术在粮食作物上的应用提供了良好的契机,同时也让转基因技术承受了巨大的挑战,如何趋利避害,提供安全的、环境友好的转基因方案是当今生物科学界不得不面对的问题。
为了从根本上杜绝基因飘流,保障转基因产品的环境和食品安全,研究者们提出了一系列生物学措施来控制转基因飘流,包括叶绿体转化、可控转基因技术、闭花受精、基因删除、转基因削弱和雄性不育等。但每种措施都有其自身的特点和使用范围。如叶绿体为母系遗传,利用叶绿体转化培育的转基因植物,其基因飘流的风险大大降低,但有些植物的叶绿体不是母系遗传,而且叶绿体转化时同质化很困难,这都制约了叶绿体转化的应用。雄性不育能有效地控制父本的转基因飘流,但仍能作为母本与其有性可交配种杂交而产生转基因杂交种。转基因弱化技术能控制基因向杂草的飘流,但不能限制转基因向同物种的飘流。2010 年,Hüsken 等对这些措施各自的优缺点和当前的研究进展进行了详细的综述,并指出没有哪种措施能够百分百地控制转基因飘流,只有多种措施结合使用才能获得理想的限控转基因飘流的效果。
基因拆分技术为限控转基因飘流上提供了新的思路。如上所述,已有包括 gus、G2-aroA、和 ALSⅡ等基因在内的多个基因拆分后利用此技术在拟南芥、烟草和小麦等植物中恢复目标蛋白功能,而且在烟草中也明确了基因拆分后在植株水平上的重新组装效率可高达 100%,能降低至少 75% 的转基因飘流频率,因此,基因拆分技术可能具有很好的通用性。而且通过筛选,获得拆分后的基因片段位于同源染色体的转化体,就有可能完全控制转基因植株的基因飘流。但基因拆分技术的普遍应用,还需要解决以下两个问题: 一是基因有效可拆分位点的筛选,二是建立从分子水平上明确基因拆分后的重新组装效率的技术。相信随着分子生物学的发展,相关新方法、新技术的涌现,基因拆分技术在防控转基因飘流中会拥有广阔的应用前景,并将进一步促进转基因产品的商业化进程。
参 考 文 献
[1] 李阳生,朱英国. 转基因技术———新的绿色革命的利器[J]. 植物生理学报,2013,( 7) : 603 -607.
[2] James C. 2013 年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2014,34( 1) : 1 -8.
[3] 马三梅,王永飞. 降低转基因植物外源基因扩散的分子策略[J]. 遗传,2004,( 4) : 556 -559.
[4] 孔 宁,王旭静,唐巧玲,等. 生物学措施限控基因漂流的研究进展[J]. 中国农业科技导报,2008,10( 3) : 24 -30.
[5] Perler F B,Davis E O,Dean G E,et al. . Protein splicingelements: inteins and exteins———a definition of terms andrecommended nomenclature [J]. Nucleic Acids Res. ,1994,22( 7) : 1125 -1127.
[6] 魏新元. 内含肽的研究及应用进展[J]. 西北农林科技大学学报: 自然科学版,2008,( 05) : 171 -178.
[7] Kane P M,Yamashiro C T,Wolczyk D F,et al. . Proteinsplicing converts the yeast TFP1 gene product to the 69-kDsubunit of the vacuolar H( + ) -adenosine triphosphatase [J].Science,1990,250 ( 4981) : 651 - 657.
[8] Hirata R,Ohsumk Y,Nakano A,et al. . Molecular structure ofa gene,VMA1,encoding the catalytic subunit of H ( + ) -translocating adenosine triphosphatase from vacuolar membranesof Saccharomyces cerevisiae [J]. J. Biol. Chem. ,1990,265( 12) : 6726 -6733.
[9] Evans T J,Xu M Q,Pradhan S. Protein splicing elements andplants: from transgene containment to protein purification [J].Annu. Rev. Plant Biol. ,2005,56: : 375 - 392.
[10] Wu H,Hu Z,Liu X Q. Protein trans-splicing by a split inteinencoded in a split DnaE gene of Synechocystis sp. PCC6803[J]. Proc. Natl. Acad Sci. USA,1998,95( 16) : 9226 -9231.
[11] Evans T J,Martin D,Kolly R,et al. . Protein trans-splicingand cyclization by a naturally split intein from the dnaE gene ofSynechocystis species PCC6803 [J]. J. Biol. Chem. ,2000,275( 13) : 9091 - 9094.
[12] Volkmann G,Mootz H D. Recent progress in intein research:from mechanism to directed evolution and applications [J].Cell Mol. Life Sci. ,2013,70( 7) : 1185 - 1206.。
[13] Cooper A A,Chen Y J,Lindorfer M A,et al. . Protein splicingof the yeast TFP1 intervening protein sequence: a model forself-excision [J]. EMBO J. ,1993,12( 6) : 2575 - 2583.
[14] Mills K V,Lew B M,Jiang S,et al. . Protein splicing in transby purified N- and C-terminal fragments of the Mycobacteriumtuberculosis RecA intein [J]. Proc. Natl. Acad. Sci. USA,1998,95( 7) : 3543 - 3548.
[15] Sun L,Ghosh I,Paulus H,et al. . Protein trans-splicing toproduce herbicide-resistant acetolactate synthase [J]. Appl.Environ. Microbiol. ,2001,67( 3) : 1025 - 1029.
[16] Xu M Q,Southworth M W,Mersha F B,et al. . In vitro proteinsplicing of purified precursor and the identification of abranched intermediate [J]. Cell,1993,75( 7) : 1371 - 1377.。
[17] Perler F B,Olsen G J,Adam E. Compilation and analysis ofintein sequences[J]. Nucleic Acids Res. ,1997,25 ( 6 ) :1087 - 1093.
[18] Du Z,Shemella P T,Liu Y,et al. . Highly conserved histidineplays a dual catalytic role in protein splicing: a pKa shiftmechanism [J]. J. Am. Chem. Soc. ,2009,131 ( 32 ) :11581 - 11589.
[19] Elleuche S,Poggeler S. Inteins,valuable genetic elements inmolecular biology and biotechnology [J]. Appl. Microbiol.Biotechnol. ,2010,87( 2) : 479 - 489.
[20] Vila-Perello M, Liu Z,Shah N H, et al. . Streamlinedexpressed protein ligation using split inteins [J]. J. Am.Chem. Soc. ,2013,135( 1) : 286 - 292.
[21] Muir T W,Sondhi D,Cole P A. Expressed protein ligation: ageneral method for protein engineering [J]. Proc. Natl. Acad.Sci. USA,1998,95( 12) : 6705 - 6710.
[22] Deschuyteneer G,Garcia S,Michiels B,et al. . Intein-mediatedcyclization of randomized peptides in the periplasm ofEscherichia coli and their extracellular secretion [J]. ACSChem. Biol. . 2010,5( 7) : 691 - 700.
[23] Evans T J,Benner J,Xu M Q. The cyclization andpolymerization of bacterially expressed proteins using modifiedself-splicing inteins [J]. J. Biol. Chem. ,1999,274 ( 26 ) :18359 - 18363.
[24] Evans T J,Benner J,Xu M Q. Semisynthesis of cytotoxicproteins using a modified protein splicing element [J]. ProteinSci. ,1998,7( 11) : 2256 - 2264.
[25] Chen Y Q,Zhang S Q,Li B C,et al. . Expression of a cytotoxiccationic antibacterial peptide in Escherichia coli using two fusionpartners [J]. Protein Expr. Purif. ,2008,57( 2) : 303 - 311.
[26] Karagoz G E,Sinnige T,Hsieh O,et al. . Expressed proteinligation for a large dimeric protein [J]. Protein Eng. Des.Sel. ,2011,24( 6) : 495 - 501.
[27] Vila-Perello M,Muir T W. Biological applications of proteinsplicin [J]. Cell,2010,143( 2) : 191 - 200.
[28] Chin H G,Kim G D,Marin I,et al. . Protein trans-splicing intransgenic plant chloroplast: reconstruction of herbicideresistance from split genes [J]. Proc. Natl. Acad. Sci. USA,2003,100( 8) : 4510 - 4515.
[29] Yang J,Fox G J,Henry-Smith T V. Intein-mediated assemblyof a functional beta-glucuronidase in transgenic plants [J].Proc. Natl. Acad. Sci. USA,2003,100( 6) : 3513 - 3518.
[30] Gils M,Marillonnet S,Werner S,et al. . A novel hybrid seedsystem for plants [J]. Plant Biotechnol. J. ,2008,6( 3) : 226- 235.
[31] Kempe K,Rubtsova M,Gils M. Intein-mediated proteinassembly in transgenic wheat: production of active barnase andacetolactate synthase from split genes [J]. Plant Biotechnol.J. ,2009,7( 3) : 283 - 297.
[32] Dun B Q,Wang X J,Lu W,et al. . Reconstitution of glyphosateresistance from a split 5-enolpyruvyl shikimate-3-phosphatesynthase gene in Escherichia coli and transgenic tobacco [J].Appl. Environ. Microbiol. ,2007,73( 24) : 7997 -8000.
[33] 靳 茜. 利用基因拆分技术限控转基因飘流的研究[D]. 北京: 中国农业科学院,博士学位论文,2012.
[34] Topilina N I,Mills K V. Recent advances in in vivo applicationsof intein-mediated protein splicing [J]. Mob. DNA,2014,5( 1) : 5.
[35] Maliga P. Plastid transformation in higher plants[J]. Annu.Rev. Plant Biol. ,2004,55: 289 - 313.
[36] Hüsken A,Prescher S,Schiemann J. Evaluating biologicalcontainment strategies for pollen-mediated gene flow [J].Environ. Biosafety Res. ,2010,9( 2) : 67 - 73.