
罗仙子原名家蝇蛆,又称五谷虫,为传统中药材之一.罗仙子具有多种治疗效果,如调节免疫功能、促进组织愈合、降血脂和抗菌等功效[1].本课题组前期研究发现罗仙子粉及其提取物均能有效治疗动脉粥样硬化(atherosclerosis,AS)[2].
目前研究认为炎症过程在AS的发病中扮演了重要作用,单核细胞和血管内皮细胞的黏附、迁移诱导了AS的 形 成.本 研 究 观 察 相 对 分 子 质 量30 000以下罗仙子提取物对单核细胞与血管内皮细胞黏附的影响,并简要探讨其机制.
1材料与方法
1.1细胞和培养 EA.hy926、THP-1细胞购买于中山大学实验动物中心.EA.hy926培养采用10%胎牛血清DMEM低糖培养基,THP-1培养采用10%胎牛血清RPMI1640培养基,细胞均置于37℃、5%CO2浓度的培养箱中静置孵育培养.EA.hy926待细胞融合度达到80%进行传代,THP-1每隔2~3d,培养基变黄后进行分瓶.
1.2试剂和仪器 罗仙子提取物自制;单核细胞趋化 蛋 白-1(MCP-1)、血 管 细 胞 黏 附 分 子-1(VCAM-1)ELISA试 剂 盒 (CUSABIO,中 国);MTT(Sigma,美国);PBS(博士德,中国);重组人TNF-α(PeproTech,美国);DMSO(Amresco,美国);DMEM低糖培养基(Hyclone,美国);RP-MI1640(Hyclone,美国);胎牛血清(Hyclone,美国);酶标仪(Bio-Rad,美国);倒置显微镜(Olym-bus,日本);CO2培养箱(HERAS,德国);超净台(江苏净化,中国).
1.3罗仙子提取物的制备 人工饲养家蝇幼虫,于2日龄采用冷热交替刺激后,次日对幼虫进行清洗、消毒处理后,按1∶3(m∶v)的比例加入单蒸水进行匀浆,匀浆液用200目的纱网过滤,得滤液;超 声 破 碎:工 作10s,暂 停5s,交 替 工 作15min;超高速冷冻离心机4℃,12 000r/min,工作30min后收集上清液;滤液在-80℃冰冻2h后,进行冷冻干燥,得到罗仙子粗蛋白质粉;蛋白粗粉重溶后分别通过100 000分子超滤膜和30 000分子滤膜获得相对分子质量30 000以下罗仙子提取物.
1.4内皮细胞活力检测 取对数期生长期的EA.hy926,接种于96孔 板,每 孔200μL(1×104/mL),细胞贴壁生长后48h更换培养液,按下列浓度加入系列浓度的相对分子质量30 000以下罗仙子提取物的培养液(0、4×102、4×101、4×100、4× 10-1、4× 10-2、4× 10-3、4×10-4μg/mL),每组设6个复孔,37℃及饱和湿度下培养24h.每孔内加入20μL(5mg/mLMTT)溶液,继续培养4h.吸取孔内液体,加入150μL DMSO,在酶标仪OD490nm处测量各孔的吸光度值[3].
1.5罗仙子提取物对单核细胞与TNF-α活化的血管内皮细胞黏附的影响 EA.hy926接种于96孔板,待细胞培养至单层后,更换含有10ng/mLTNF-α和不同浓度药物(200、100、50、25、12.5、6.25和3.12μg/mL)的培养基,其中模型组只添加含有10ng/mL TNF-α的培养基,空白对照组使用空白培养基,处理24h后,在每孔加入3×105个THP-1细 胞,37℃及饱和湿度下培养1h,用PBS洗去未黏附细胞,每孔加入10μL虎红(0.25%),室温下作用10min,用PBS洗去游离虎红,每孔加入200μL乙醇-PBS溶液(1∶1),作用1h后,采 用 酶 标 仪 测 定490nm的OD值[4].
1.6罗仙子提取物对血管内皮细胞黏附分子表达的影响.
EA.hy926接种于96孔板,待细胞培养至单层后,更换含有10ng/mL TNF-α和不同浓 度 药 物 (200、100、50、25、12.5、6.25和3.12μg/mL)的培养基,其中模型组只添加含有10ng/mL TNF-α的培养基,空白对照组使用空白培养基,每组3个复孔,处理24h后,收集培养上清液,离心去除细胞后采用ELISA试剂盒检测VCAM-1和MCP-1.
1.7统计学处理.
用SPSS 13.0软件进行统计分析,计量资料比较采用t检验,P<0.05为差异有统计学意义.
2结果.
2.1罗仙子提取物对内皮细胞活力的影响 4×102μg/mL罗仙子提取物具有促进EA.hy926增殖的作用(P<0.05),而低于该浓度,罗仙子提取物对EA.hy926未见明显的增殖或抑制作用(P>0.05).见表1.
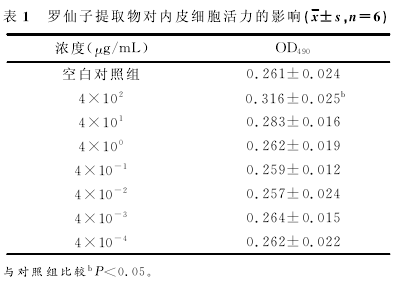
2.2罗仙子提取物对单核细胞与TNF-α活化的血管内皮细胞黏附的影响 通过TNF-α的诱导,黏附于EA.hy926的单核细胞THP-1显着增加(P<0.01);3.12μg/mL罗仙子提取物可降低两细胞之间的黏附作用(P<0.05),而罗仙子提取物≥3.12μg/mL时,单核细胞与TNF-α活化的血管内皮细胞黏附均发生显着降低(P<0.01).
见表2.
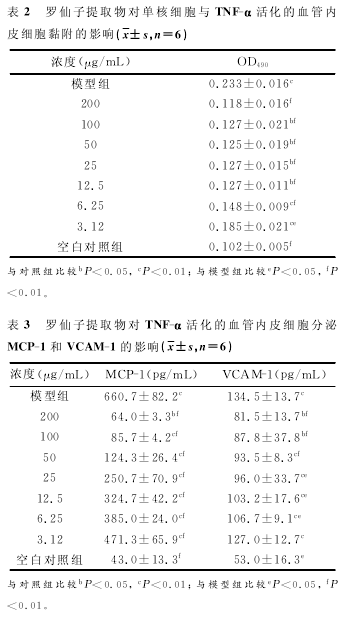
2.3罗仙子提取物对TNF-α活化的血管内皮细胞分泌 MCP-1和VCAM-1的影响与模型组比较,各给药浓度均能显着降低MCP-1的表达(P<0.01);与模型组比较,药物浓度≥50μg/mL时,VCAM-1发 生 显 着 的 降 低 (P<0.01),而50μg/mL≥药物浓度>3.12μg/mL,VCAM-1发生一定程度的降低(P<0.05).见表3.
3讨论
罗仙子作为传统中药,其具有多种药理药效.在本课题组的研究中发现罗仙子具有显着的抗AS作用,能有效地降低胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL),升高高密度脂蛋白(HDL),超氧化物歧化酶(SOD)活力升高,丙二醛(MDA)水平下降,具有良好的抗炎和抗氧化作用[5].进一步的研究中,对罗仙子进行了分离纯化,通过体内外研究发现罗仙子30 000以下成分为其最有效成分,其可通过抑制NF-κB信号通路从而减少下游相关炎症因子的表达、调控巨噬细胞与内皮细胞之间的相互关系及保护内皮细胞等作用发挥抗AS作用[6].现代研究认为AS病变的发生发展过程就是一系列由炎症细胞和炎症因子参与的炎症反应过程,多种炎症因子被确认为AS的 标 志 物,如TNF-α、IL-6和MCP-1等[7].TNF-α可使内皮细胞 活 化 产 生 一 系 列 黏 附 分 子 如VCAM-1、ICAM-1及MCP-1等,从而使单核细胞与血管内皮细胞发生黏附,并在多种因子的作用下分化为成熟的巨噬细胞或树突状细胞,而成熟的巨噬细胞由于吞噬氧化低密度脂蛋白转化为泡沫细胞,从而导致了AS斑块的形成[8].由此可见,有效抑制单核细胞与内皮细胞之间的早期黏附可有效抑制AS的产生.
本研究中发现TNF-α处理EA.hy926后与THP-1细胞的黏附作用显着增强,而不同浓度罗仙子提取物均能降低TNF-α诱导的EA.hy926后与THP-1细胞的黏附作用,说明罗仙子提取物可能通过降低单核细胞与血管内皮细胞之间的黏附作用从早期抑制AS斑块的形成.
TNF-α是人体重要的炎性细胞因子.活化单核巨噬细胞分泌TNF-α,后者与内皮细胞胞膜上的TNF-α受体(TNFR)相结合[9],发挥生物学效应,从而诱导内皮细胞的衰老和凋亡,此外血管内皮细胞在TNF-α作用下可分泌大量促炎性细胞因子[10].本研究中发现正常血管内皮细胞可低表达VCAM-1和MCP-1,而在TNF-α诱导下均发生显着的提高,不同浓度罗仙子提取物可浓度依赖性降低VCAM-1和MCP-1水平,这也可能是罗仙子提取物降低单核细胞与血管内皮细胞的之间的黏附作用的可能机制,但罗仙子提取物是否直接作用于TNFR受体或者影响TNFR下游NF-κB通路其确切机制有待进一步研究.
参 考 文 献
[1] 黄健,莫非.家蝇幼虫抗菌肽对幽门螺杆菌抗菌作用分析[J].中国人兽共患病学报,2013,29(10):981-985.
[2]Chu FJ,Jin XB,Ma Y,et al.Inflammatory Regula-tion Effect and Action Mechanism of Anti-Inflam-matory Effective Parts of Housefly(Musca domes-tica)Larvae on Atherosclerosis[J].Evid BasedComplement Alternat Med,2013,2013:340267.
[3] 陈丽,张建,汪思应,等.胡桃醌对血管形成的影响及其机制初探[J].中国临床药理学与治疗学,2010,15(4):403-410.
[4] 何秀娟,吕喆,龙军,等.疡愈涂剂对人白细胞与血管内皮细胞黏附影响的分子机制[J].首都医科大学学报,2010,31(6):752-755.
[5] 肖明珠.家蝇蛆粉对ApoE-/-小鼠抗动脉粥样硬化作用及其机制的探讨[D].广州:广东药学院,2011.
[6] 褚夫江.家蝇蛆粉抗高血脂与动脉粥样硬化的研究[D].广州:广东药学院,2009.
[7] 方海洋,吴延庆.4项动脉粥样硬化的相关因子研究进展[J]重庆医学,2013,(32):3958-3961.
[8] 陈丽红,管又飞.巨噬细胞移动抑制因子及其在动脉粥样硬化中的作用【J】.生理科学进展,2006,37(1):45-47.
[9] 方丽娟,刘乃丰.二甲双胍的心血管保护作用[J].中国临床药理学与治疗学,2011,16(2):232-236.
[10]崔广智,金树梅,赵桂峰,等.丹参酮ⅡA对TNF-α诱导的ECV304细胞NF-κB、IκB-α表达及黏附分子ICAM-1、VCAM-1mRNA表达的影响[J].中国药理学通报,2007,23(12):1671-1675





