
目前大量关于肾的毒理学、药物测试等研究需要肾小管上皮细胞株。但是,细胞株部分基因的变异或缺失与正常细胞存在差异,原代细胞在表达正常细胞生理状态下则更显优势[1],因此寻求一种有效的肾小管上皮细胞的原代培养尤为重要。目前多篇文献[1-7]对肾小管上皮细胞的原代培养都有各自见解,本实验将其简化并加以改良,在文献的基础上[2]优化实验条件,寻找经济材料以及合适的浓度以获得大量良好的肾小管上皮细胞。在试验中发现将第一次细胞换取液可再次利用,仍有大量高纯度的肾小管上皮细胞贴壁且贴壁良好。
1 材料与方法
1.1 材料
实验动物:SD 大鼠,雄性,4~5 周龄(徐州医学院实验动物中心);昆明小鼠,4~5 周龄(徐州医学院实验动物中心)。
1.2 主要试剂胎 牛 血 清(杭 州 四 季 青),DMEM-F12 1:1 培 养 基(Thermo),Ⅰ型胶原酶 ( 美国 Sigma),胰酶消化液,双抗(青霉素 - 链霉素溶液 100×),兔抗人角蛋白 CK18(Bioss),SABC免疫组化染色试剂盒(博士德生物),DAB 显色试剂盒(博士德生物)。
1.3 试验方法
1.3.1 肾小管节段分离
大鼠和小鼠实验前均禁食 12 小时,进水自由。脱臼处死,75% 乙醇中浸泡 5min.在超净台中取出肾,置于冷的含双抗的 PBS 溶液中,去除肾蒂和包膜,将肾皮质剪碎大小至1mm3,PBS 洗涤 3 次后,放置 80 目不锈钢筛网上,用 50ml灭菌注射器柄轻轻研磨,PBS 液充分清洗后的网下液转移至100 目不锈钢筛网中,将 100 目筛网倒置 PBS 冲洗取网上液。
取得的液体经 1500r/min 离心 8min,弃去上清液在沉淀中加入Ⅰ型胶原酶,分别 37℃振荡消化,振荡消化时间分三组,分别为 20min,25min,30min.双倍体积 DMEM-F12 培养基中和后,1500r/min 离心 8min.
1.3.2 肾小管上皮细胞的原代培养及传代
在 上 述 离 心 后 的 沉 淀 中 加 入 含 10% 胎 牛 血 清 的DMEM-F12 培养基,轻轻吹打混匀。接种到 25mL 培养瓶中。培养瓶静置于 37℃ 5% 的 CO2培养箱中培养。24h 后补加培养基。72h 后首次换液。之后隔天换液。原代培养 4~6 天,细胞贴满瓶底,用胰蛋白酶消化并传代培养。
1.3.3 首次换液后废液的有效利用
72h 首次换液时,将废液至于新的培养瓶中,添加适当的培养基,静置于 37℃ 5% 的 CO2 培养箱中培养。视细胞贴壁状态可于 48h 半换液,72h 全换液。
1.3.4 肾小管上皮细胞的鉴定1.3.4.1 倒置显微镜下对细胞的形态及生长进行观察1.3.4.2 免疫细胞化学法(SABC 法)细胞爬片后,PBS 轻轻冲洗。4% 多聚甲醛固定 60min.
吸去多聚甲醛后空气干燥 5min,加入 30%H2O2纯甲醇(1:50)混合液浸泡 30min,灭活内源性过氧化物酶,PBS 冲洗;加 5%BSA 封闭液,室温条件 20min,吸去多余液体;加兔抗人角蛋白 CK18(1:200),PBS 作为阴性对照。37℃下孵育 1h,PBS 洗涤 3 次。加入生物素化山羊抗兔 IgG(博士德生物)室温 20min,PBS 洗涤 3 次,加 SABC 37℃反应 20min,洗片,使用 DAB 试剂盒(AR1002)显色,苏木素轻度复染,中性树胶封片。
2 结果
2.1 SD 大鼠和昆明小鼠肾小管上皮细胞分离生长和传代的比较
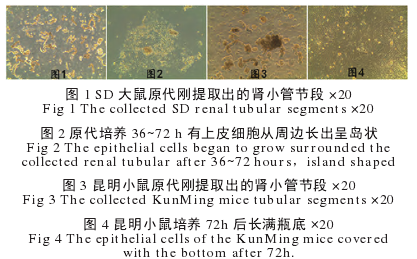
SD 大鼠刚分离的以肾小管节段以及单个游离肾小管上皮细胞,在倒置显微镜下圆形透亮,体积较大,强折光性好。( 图 1)12h 后部分细胞开始贴壁,以肾小管节段周围聚集密集。24h 后细胞大量贴壁且有少量上皮样细胞爬出,72h 细胞紧密衔接呈典型鹅卵石铺路样,折光性好。(图 2)SD 大鼠传代至第二代时开始有细胞漂浮,传代到第三代时大量凋亡。昆明小鼠刚分离的肾小管以肾小管节段居多,形态与大鼠相似。(图 3)贴壁速度比 SD 大鼠略慢,但生长速度快,培养 72h 已长满瓶底。(图 4)传代至第三代时依旧有大量细胞紧贴瓶底。
2.2 胶原蛋白不同时间的消化结果
SD 大鼠分离出的 100 目网上液,37℃环境下,胶原酶消化 20min 肾小管节段较多,于 36h 已开始贴壁,72h 后贴壁达45%,生长状态较好,纯度较高。细胞传代至第二代细胞活性降低,细胞开始凋亡漂浮。胶原酶消化 25min 肾小管节段以及游离细胞明显增多,24h 有部分细胞贴壁,原代培养 36-72 h 有上皮细胞从周边长出呈岛屿状,(图 5)细胞传代到第三代开始有少量细胞漂浮,生长缓慢。胶原酶消化 30min 游离肾小管上皮细胞居多,贴壁生长均缓慢。传代到第二代细胞呈老化状态。
2.3 首次细胞换取液中肾小管上皮细胞的培养和传代
昆明小鼠培养 72h 后,首次细胞换取液中存有大量肾小管节段和游离肾小管上皮细胞,形态与上述肾小管上皮细胞相似,还有少许杂质。(图 6)换取液培养 12h 后细胞开始贴壁,生长状态良好。(图 7)48h 后大量贴壁,换液后可见细胞呈岛屿状分布。3~4d 后细胞铺满瓶底,纯度稍低。(图 8)传代后的第一代和第二代贴壁生长较好,第三代细胞开始漂浮。

2.4 肾小管上皮细胞的鉴定
免疫细胞化学染色检测肾小管上皮细胞特异性表达的cytokeratin18,在镜下可见肾小管上皮细胞的胞核周围及胞质内有不均匀分布的棕褐色颗粒,(图 9)而阴性对照组未见到,(图 10)证明培养的是肾小管上皮细胞。CKl8 免疫细胞化学染色显示,细胞质中有棕黄色颗粒,分布不均,强弱不等,几乎全部细胞质均着色,显示为 CKl8 阳性。

3 讨论
近年,国外主要用 RTECs 株开展对肾小管上皮细胞的研究,但价格昂贵,国内获得困难[1].目前国内原代培养的肾小管上皮细胞主要采用流式细胞仪分离法[3],微镜下解剖分离法,免疫分离等方法能获得高纯度的肾小管上皮细胞,但需要具备严格的条件以及高要求高难度的分离操作。从对细胞的需求数量和需要的纯度考虑,机械研磨胶原酶消化法经济且应用广,分离方便。本实验肾小管上皮细胞分离的实验步骤进行探讨,通过大量实验对比,寻找操作简便可行且经济的方法。实验中获得以下几点经验:
(1)严格保持无菌,可在操作的试剂 PBS 以及培养基中加入双抗,双抗对细胞毒性小,可有效减少细胞感染率。细胞培养过程中,前三天在培养基中使用抗生素抗污染效果较好[4].解剖和肾提取过程中可将解剖台装有 PBS 液的培养皿置于冰上,尽量保持在 4℃左右。
(2)选择 1 型胶原酶,不采用含 EDTA 的胶原蛋白消化[2],消化时间在 25min 左右获得的肾小管上皮细胞数量多活性好。
(3)实验过程中发现将分离出的肾小管上皮细胞第一次接种时,添加少量培养基,细胞能更好的贴壁,培养 24 小时后适当添加培养基。
(4)进行 Pereoll 连续或不连续密度梯度分离法[5,6]纯度高,但分离液价格较贵,按要求吸取近管底第二层悬液后,所获得细胞数量明显减少,且反复离心增加对离体细胞的损害。这与另一篇文献中提到肾小管经过 80 目和 100 目孔径的不锈钢筛网分离后,其纯度可达到 90%以上,且获得的细胞数量较多[7]的观点一致。
(5)4~5 周的 SD 小鼠肾体积小,去除肾蒂和包膜较困难,故一次实验需两到三只小鼠才能分离出较多肾小管节。虽小鼠细胞贴壁速度慢,但生长速度快,传代能力强,经济实惠。
(6)在细胞生长观察中可发现细胞多呈群落样生长贴壁,当贴壁达 60% 换液后,已贴壁的细胞生长迅速,48h 后就可爬满瓶底。而贴壁过满再换液,由于细胞培养瓶内贴壁空间的限制以及细胞产生的废弃物影响细胞生长。
(7)机械研磨法分离肾小管上皮细胞多,培养 48h 后大量细胞贴壁,但培养瓶中还有大量未贴壁的肾小管节段及游离的细胞。将第一次换液后的废弃液继续培养,培养 48h 后依旧有大量肾小管上皮细胞贴壁,且贴壁快。首次换取液中细胞的纯度不影响对肾小管上皮细胞的研究。第一代传代细胞贴壁生长均较好,对细胞需求多的研究具实用价值,且经济方便。
8.在分离出的肾小管上皮细胞液中加入胰岛素,上皮生长因子,转铁蛋白等可以提高细胞活性,已有文章表明维生素 C 对肾小管上皮细胞体外培养时间起适度延长作用且对细胞活力有增强作用[8].
9.肾小管上皮细胞胞浆中特异性表达 CKl8,因此用cKl8 对原代和传代细胞分别进行鉴定[9].
参考文献
[1] 王林 , 卓丽玲 , 顾建红 , 等 . SD 大鼠近端肾小管上皮细胞的原代培养及鉴定 [J]. 中国兽医学报,2008, 28(12)。
[2] 吴国娟 , 杨明 , 王典仁 , 等 . 小鼠肾小管上皮细胞的原代培养及鉴定 [J]. 解剖学报,2007, 38(6)。
[3] Baer PC,Tunn UW, Nunez G Transdifferentiation of distal but notproximal tubular epithelial cells from human kidney in culture. ExpNephr01. 1999, 7(4): 306-313.
[4] Rudolfs K,Zalups D,Lawrence H,Methods in renal toxicology[M].Canada: CRC Press, 1996.
[5] 刘晓玲,邢淑华 . Percoll 法分离培养肾小管上皮细胞 [J]. 徐州医学院学报 , 2006, 26(2): 100-103.
[6] Sara Terryn, Francois Jouret, Frank Vandenabeele, et a1. A primaryculture of mouse proximal tubular cells.established on collagen-coatedmembranes. Am J Physiol[J], 2007, 293(2): F476-F485.
[7] 何锦园 , 曾国华 , 吴文起 , 等 . SD 大鼠肾小管上皮细胞的原代培养和鉴定 [J]. 东南大学学报 , 2010, 29(4): 395-399.
[8] 陈昕,赵雷,周余来 . 维生素C对大鼠肾小管上皮细胞增殖活力的影响 [J]. 中国实验诊断学,2013,17(3): 452-454.





