
细胞衰老是指细胞生长永久阻滞于细胞周期的G1期,出现形态、生化及表观遗传的变化特性,是正常细胞必然的归宿[1].衰老细胞的聚集会导致其所在组织或器官发生衰老相关性疾病,去除这些衰老细胞则会延缓疾病的发生,从而延缓整个生物体的衰老。此外,研究表明细胞衰老是继细胞 DNA修复和细胞凋亡之后的第三大癌症防御机制,与肿瘤的发生、发展以及治疗密切相关。
MicroRNA 是长约 21 ~ 23nt 的非编码 RNA,通过特异性抑制靶 mRNA 翻译或者降解 mRNA 来调节靶基因的表达[2].miRNA-17-92 家族位于人 13号染色体上,编码 miR-17-5p( miR-17) 、miR-17-3p、miR-18a、miR-19a,miR-20a、miR-19b 及 miR-92a 7个成熟的 miRNAs.近年研究发现,miRNA-17-92家族在心、肺、免疫系统的发育中发挥重要作用[3-4],并与前列腺癌、肺癌、乳腺癌及胃癌等多种肿瘤的发生密切相关[5-7].作为 Oncomirs 领域第一个被发现的癌基因,miR-17-92 家族的研究受到广泛的关注[8].Matthias 等[9]通过芯片分析发现,miR-17、miR-19b、miR-20a 和 miR-106a 在复制性衰老的细胞中表达下调,但具体机制尚未明确。本实验通过分离培养原代人包皮成纤维细胞( human foreskinfibroblasts,HFF) ,研究 miR-17 对原代细胞细胞周期的影响,初步探讨 miR-17 调节细胞衰老的分子机制。
1 材料与方法
1. 1 材料
1. 1. 1 细胞培养 包皮标本来源于山东大学齐鲁医院泌尿外科 l 例 7 岁健康男孩包皮环切术切除的包皮,患者签署知情同意书,同意包皮用于医学科学研究。本研究已获得山东大学医学院伦理委员会批准。HFF 传代培养于含 10% 小牛血清的 DMEM 高糖培养基,在 37 ℃、5%CO2细胞培养箱内培养。
1. 1. 2 主要试剂 DMEM 高糖培养基购自美国Hyclone 生物化学制品有限公司,小牛血清购自杭州四季青生物工程有限公司,聚凝胺( polybrene) 和嘌呤霉素( puromycin) 均购自美国 Sigma 公司,重组慢病毒 Lenti-miR-17 和 Lenti-NC 均购自上海吉玛制药技术有限公司,逆转录及 PCR 反应试剂盒购自日本 TaKaRa 公司,兔抗人波形蛋白( vimentin) 单克隆抗体购自北京中杉金桥生物技术有限公司,CCK-8试剂盒购自日本株式会社同仁化学研究所公司,衰老相关 β-gal 染色试剂盒购于美国 CST 公司,p21一抗购自武汉三鹰生物技术有限公司,cyclin D1 购自美国 Santacruz 公司,PVDF 膜购自美国 Millipore公司,ECL 试剂购自上海碧云天生物技术有限公司。
1. 2 方法
1. 2. 1 HFF 的分离和体外培养 手术剪去皮下组织和真皮网状层,剪成 1 mm3大小皮片; 用 PBS 反复漂洗 3 次; 加入胰酶,37 ℃温箱消化 1 ~2 h; 加入DMEM 培养基,轻轻吹打,200 目不锈钢滤网过滤,将细胞液 1 000 r/min 离心 10 min,弃上清,加入DMEM 培养基漂洗 2 次,每次离心 5 min,所得细胞用含 10%小牛血清的 DMEM 培养基混匀并转移至培养瓶中静置培养,每两天换一次; 待原代培养中长出的成纤维细胞接近或达到汇合,按 1∶3 的比例传代培养。
1. 2. 2 培养 HFF 细胞的鉴定 将原代 HFF 细胞接种在细胞爬片上,培养至细胞接近融合状态,以兔抗人波形蛋白( Vimentin) 单克隆抗体为一抗,用链酶亲和素 - 生物素 - 过氧化物酶( SABC) 法进行免疫细胞化学染色。显微镜下观察并拍照。
1. 2. 3 稳定表达 miR-17 成纤维上皮细胞系的建立与筛选 待 HFF 细胞长至 70% 左右,弃去原培养液,用 PBS 冲洗一遍,加入含 miR-17 重组慢病毒的DMEM 培养基 ( MOI = 50 ) ,同时加入 8 μg / mLpolybrene促进病毒的感染,将细胞放置 37 ℃ 孵箱孵育 24 h,弃去含病毒的培养基,改换 DMEM 培养基。24 h 后,消 化 病 毒 感 染 的 HFF,将 细 胞 接 种 至100 mm培养皿,同时加入 puromycin 进行筛选。荧光倒置显微镜观察 HFF-miR-17 及 HFF-NC GFP 表达。
1. 2. 4 qRT-PCR 检测 HFF 中 miR-17 的表达 Trizol抽提细胞 RNA,逆转录合成 cDNA,miR-17 检测引物( 扩增长度: 246 bp,Tm = 56 ℃) : 上游: 5'-CT-GTCGCCCAATCAAACTG-3',下游: 5'-GTCACAA-TCCCCACCAAAC-3'; GAPDH: 上游 5'-GCACCGT-CAAGGCTGAGAC-3',下游 5'-TGGTGAAGACGC-CAGTGGA-3'.qRT-PCR 反应条件按日本 TaKaRa公司 SYBR PrimeScript miRNA RT-PCR Kit 说明书操作。
1. 2. 5 细胞生长曲线测定 取 HFF-NC 和 HFF-miR-17 对数生长期细胞制成单细胞悬液,接种到 96孔板中,每孔 1. 5 ×103个细胞,每 24 h 取 3 个孔换液后加入含 10% CCK-8 的 DMEM 培养液,在培养箱内孵育 1 h,用酶标仪测定在 450 nm 处的 OD 值,连续计数 6 d.以 OD 值为纵坐标、时间为横坐标绘制生长曲线。
1. 2. 6 β-半乳糖苷酶染色 将 HFF-miR-17 细胞及其对照细胞用常规方法在 6 孔板中培养,细胞密度达到 60% ~ 80% 时开始染色,倒掉细胞培养基,PBS 冲洗一次,加 3% 的甲醛固定 5 min; PBS 冲洗,加入 1 mL /孔新鲜配置的 SA-β-gal 染液,用封口膜封住 6 孔板防止液体蒸发,37 ℃无 CO2培养箱中过夜; 倒置显微镜下观察是否有变蓝色的衰老细胞,并拍照保存。
1. 2. 7 流式细胞术检测细胞周期 待培养皿中细胞生长至对数生长期,向培养瓶内加入 10 pg /mL的博来霉素( Bleomycin) ,培养 24 h.终止培养,胰酶消化收集细胞,用细胞计数板进行细胞计数,据细胞数量调节每管细胞数为( 0. 5 ~1. 0) ×106个,PBS洗3 遍,弃上清,每管加入1 mL 70%预冷乙醇中,吹打均匀,4 ℃固定12 h 以上。PBS 洗涤去乙醇,1000r /min,5 min,离心半径 13. 5 cm,洗 2 遍。将细胞重悬于含 RNase A ( 70 μg /mL) 的 PBS-propidiumio-dide( PI,50 μg / mL ) ,避光反应 30 min.用流式细胞仪测定细胞周期,并用 FlowJo software 进行细胞周期分析。
1. 2. 8 Western blotting 检测 p21 和 cyclin D1 蛋白表达 冰上加裂解液裂解细胞,离心取上清,BCA法测蛋白浓度,蛋白上样 50 μg,经 10% SDS-PAGE垂直凝胶电泳后,移至 PVDF 膜上,5% 脱脂奶粉37 ℃ 摇床封闭 2 h,用特异性抗 p21,cyclin D1 和GAPDH 的一抗进行孵育,4 ℃ 过夜,经 TBST 冲洗10 min × 3 次后加入辣根过氧化物酶标记的二抗,37 ℃ 摇床孵育 1 h,TBST 冲洗 10 min × 3 次,ECL显影曝光。
1. 3 统计学处理 采用 GraphPad Prism 4. 0 软件,并在实验组间进行双因素方差分析检验。P <0. 05为差异有统计学意义。实验结果均重复 3 次。
2 结 果
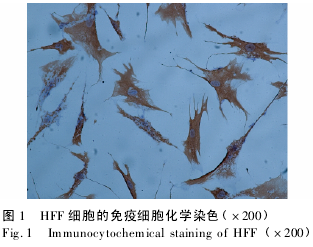
2. 1 HFF 细胞的鉴定 见图 1.由于波形蛋白为成纤维细胞内的特异性蛋白,实验组用兔抗人波形蛋白单克隆抗体作为一抗,采用 SABC 法对细胞进行免疫化学染色,显微镜下观察,细胞呈长梭形或多角形,细胞胞浆呈棕色,胞核为淡蓝色,显示为人皮肤成纤维细胞。
2. 2 感染效率鉴定及 miR-17 的表达 见图 2.荧光倒置显微镜下,绿色荧光分布于 HFF-miR-17 和HFF-NC 细胞内。与光学显微镜下同一视野对比,90% 以上细胞显示绿色荧光,提示感染成功。利用qRT-PCR 技术检测到 miR-17 在 HFF 细胞中过表达。


2. 3 miR-17 促进 HFF 增殖 见图 3.与对照细胞HFF-NC 相比,稳定表达 miR-17 的 HFF- miR-17 细胞增殖能力明显增强。
2. 4 miR-17 抑制 HFF 衰老 见图 4.HFF-miR-17细胞显示出较弱的 β-半乳糖苷酶染色,不到 1% 的细胞染色为阳性; 而对照细胞 HFF-NC 中有高达20% 的细胞染色结果为阳性。
2. 5 miR-17 对 HFF 细胞周期影响 见图 5.HFF-miR-17 细胞株与对照 HFF-NC 相比,停滞在 G1期的细胞明显减少( 81. 5% vs 72. 6%) ; 用 DNA 破坏物质 Bleomycin 处理细胞后,72. 9% 的 HFF-NC 细胞停滞在 G1期,仅有 2. 5% 的 HFF-NC 细胞能够越过 G1期进入 S 期,而 HFF-miR-17 细胞停滞在 G1期的显著减少( 54.6%) ,进入 S 期的增多( 10.2%) .


2. 6 miR-17 对 HFF 细胞周期相关蛋白表达的影响 见图 6.Western blotting 蛋白检测显示,与空白对照 HFF 细胞和阴性对照细胞 HFF-NC 相比,p21蛋白表达水平在 HFF-miR-17 中下调,而 cyclin D1蛋白表达水平显著升高。
3 讨 论
在肿瘤发生过程中,肿瘤发生的主要事件是肿瘤细胞逃逸衰老和死亡程序而进入永生化,因此诱导肿瘤细胞重新获得衰老特性是抑制肿瘤生长和增殖的重要途径。并且,衰老的肿瘤细胞也可能恢复细胞周期导致癌症的复发,因此肿瘤细胞衰老是目前研究相对热门的一种抗肿瘤机制[10].
HFF 是人二倍体原代细胞,其寿命短,可以用来作为研究细胞衰老的模型。本实验利用 HFF 细胞建立了细胞衰老的体外模型,进一步观察 miR-17抑制细胞衰老的作用及其机制。首先我们成功分离培养了 HFF 细胞,并且利用慢病毒包装系统进行感染,建立了稳定表达 miR-17 的 HFF 细胞系。由于HFF 细胞转染效率低,慢病毒对分裂细胞和非分裂细胞均具有感染能力,通过我们实验表明构建的Lenti-miR-17 慢病毒可有效感染原代细胞,为进一步实验奠定了基础。
本研究结果显示,miR-17 过表达可导致 HFF细胞增殖能力明显增强,并且 β-半乳糖苷酶染色阳性率显著降低,说明 miR-17 过表达抑制了原代人包皮成纤维细胞的衰老。近年有研究表明,miR-17-92家族成员在压力诱导的原代人二倍体细胞过早性衰老中的表达显著下调[11],且在人成纤维细胞 WI-38细胞中抑制 miR-17-5p 和 miR-20a 的表达会导致细胞周期停滞在 G1期,从而诱导细胞的衰老表型[12].
本研究用 DNA 破坏物质 bleomycin 处理 HFF-miR-17 及对照 HFF-NC 细胞,结果发现药物处理后,更多的 HFF-NC 细胞停滞在 G1期,进入 S 期的细胞减少,说明 DNA 损伤激活了 G1检测点,使细胞停滞在 G1期; 而 HFF-miR-17 细胞的 S 期细胞比例明显增加,提示 miR-17 表达能够促进细胞绕过细胞周期 G1期检测点,使更多的细胞进入 S 期,以使细胞摆脱由于 DNA 损伤而导致的细胞周期停滞,从而逃避细胞的衰老。
Cyclin D1 蛋白能够促进分裂期的细胞完成 G1期到 S 期的转换进入增殖阶段[13],本研究发现cyclin D1 表达在 HFF-miR-17 细胞中显著升高。P21 蛋白是肿瘤抑蛋白 p53 的下游靶标,它作为细胞周期蛋白依赖激酶( Cdks) 的抑制因子,能够通过抑制 Cdks 的活性诱导细胞周期的停滞[14].本实验结果显示,与空白对照 HFF 细胞和阴性对照 HFF-NC 细胞相比,p21 蛋白的表达在 HFF-miR-17 中有明显的降低,与文献报道一致[9,12].上述研究说明,miR-17 抑制原代细胞衰老的机制与其上调 cyclin D1蛋白、下调 p21 蛋白促进原代细胞的增殖有关,提示作为细胞周期负性调节因子 p21 可能负向调节cyclin D1[15],但尚需进一步研究。当前研究显示,miR-17 可能是通过作用于 p53-p21 途径,从而使HFF 越过 G1细胞周期检测点,抑制 HFF 的衰老。
参考文献:
[1]Kuilman T,Michaloglou C,Mooi WJ,et al. The essenceof senescence[J]. Gene Dev,2010,24 ( 22 ) : 2463-2479.
[2]Bartel DP. MicroRNAs: genomics,biogenesis,mecha-nism,and,function[J]. Cell,2004,116( 2) : 281-297.
[3]Jasinski-Bergner S,Mandelboim O,Seliger B. The roleof microRNAs in the control of innate immune response incancer[J]. J Natl Cancer Inst,2014,106 ( 10 ) . pii:dju257. doi: 10. 1093 / jnci / dju257. Print 2014 Oct.
[4]Gama-Carvalho M,Andrade J,Brás-Rosário L. Regula-tion of cardiac cell fate by microRNAs: implications forHeart Regeneration[J]. Cells,2014,3( 4) : 996-1026.
[5]Ma Y,Yang HZ,Dong BJ,et al. Biphasic regulation ofautophagy by miR-96 in prostate cancer cells under hypox-ia[J]. Oncotarget,2014,5( 19) : 9169-9182.





