
上皮间质转化(epithelial mesenchymal transition,EMT)在胚胎发育、组织发生中起重要作用,并存在于多种慢性疾病的发病过程及肿瘤的浸润转移过程中。在多数肿瘤的原位、恶性肿瘤细胞向周围组织侵袭和远处器官转移的过程中均存在EMT现象 。
EMT以上皮细胞极性的丧失及间质特性的获得为重要特征,伴有多个细胞分子标志改变:上皮细胞标志物如E-钙粘蛋白( E-cadherin)、β-连环素(β-catenin)等表达下调;间叶表型标记物如波形蛋白(Vimenin)、N-钙粘蛋白(N-cadherin) 等表达上调;诱导EMT的细胞因子和转录因子如Snail、Slug、Twist等表达上调 。
透明质烷合酶2(hyaluronan synthases-2,HAS-2)是透明质烷(hyaluronan, HA 合成酶之一,在大肠癌、乳腺癌、卵巢癌、口腔癌、子宫内膜癌等多种肿瘤中均有表达。有研究表明,HA与HAS1-3与肿瘤的生物学过程密切相关,HAS-2能够促进乳腺癌等肿瘤EMT的发生和发展 。本实验拟通过RNAi干扰技术沉默HAS-2,研究HAS-2沉默前后对大肠癌细胞EMT的影响。
1、 材料与方法
1.1 材料与试剂
人结直肠癌细胞株SW620购自中科院上海细胞生物学研究所细胞库;siRNA购自于上海吉玛基因公司;Lipofectamine LTX and PLUS Reagents、Opti-MEM培养基、RNA提取用Trizol试剂购自于InvitrogenTM公司;SYBR Premix Ex Taq II(Tli RNaseH Plus)、PrimeScript RT reagent Kit Perfect Real Time 购自于Takara公司;兔抗人E-Cadhrein、Vimentin、Slug抗体购自于CST公司;小鼠抗人HAS-2抗体购自于Santa Cruz公司;小鼠抗人GAPDH抗体及辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG二抗购自于北京中杉金桥公司。
1.2 细胞培养与转染
人结直肠癌细胞株SW620用含10%胎牛血清的L-15培养基,于37℃无CO 培养箱中培养传代,每22天换液1次,每3天传代1次。取生长状态良好的细5胞用于实验。转染前1天将2.5×10 对数期生长的细胞接种于6孔板,使细胞达到60~70%汇合。转染前1h用不含新鲜胎牛血清(FBS)的L-15培养基饥饿细胞1h。将细胞分为未转染组、转染negative controlsiRNA的阴性对照组及转染HAS-2 siRNA的实验组,转染4-6h后更换含10%FBS的L-15培养基。
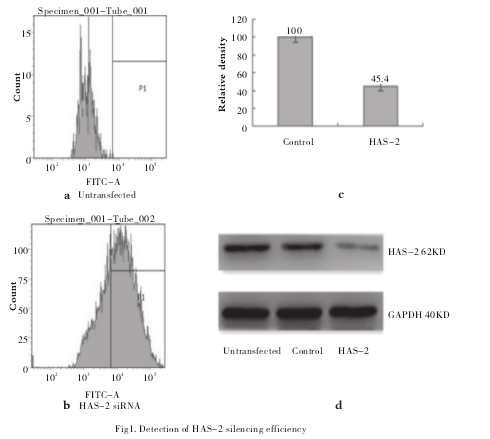
1.3 流式细胞仪检测转染效率
将带FAM荧光标记的阴性对照siRNA与LipofectamineLTX and PLUS Reagent按1:1、1:2、2:1的比例进行转染,转染后24h用0.25%胰酶消化细胞,1000转/分离心机离心5min, PBS洗涤沉淀3次后用PBS吹悬细胞沉淀,用流式细胞液检测转染效率,转染效率最高组用于以后实验。

1.4 Realtime PCR检测干扰效率
按转染效率最高组进行转染,转染后24h后按RNAiso Reagent试剂说明书提取细胞总RNA,用TMPrimeScript RT reagent Kit(Perfect Real Time)试剂盒进行逆转录获得cDNA,反应总体系为10μl 样品总RNA≤500ng 体系如下: 5×Prime Script Buffer2μl, PrimeScriptTM RT Enzyme Mix 0.5μl, Random 6mers 0.5 l, Oligo dT Primer 0.5 l。反应条件:37℃15min, 85℃ 5s。以看家基因β-actin为内对照,通过相对荧光定量PCR方法应用Mx3000P定量PCR仪对HAS-2进行检测, 计算出各组HAS-2的相对表达量,引物序列:Has-2上游引物:5' -CAGCCTCATCTGTGGAGATGGTAA-3',下游引物:5' -CCAGAGGTCCACTAATGCACTGAA-3';β-actin上游引物:5' -TGGCACCCAGCACAATGAA-3',下游引物:5' -CTAATM,μ μGTCATAGTCCGCCTAGAAGCA-3'。反应条件:95℃5min 1个循环;95℃ 10s,58℃ 30s,40个循环。反应结束后计算机自动分析出定量结果,重复实验3次,计算平均值。

1.5 Western blot检测干扰效率
用冷PBS洗转染后48h的细胞3次,在冰上用碧云天蛋白裂解液裂解细胞,30min内收集裂解液,12000rpm,4℃,离心15min,收集上清液中的总蛋白。应用碧云天BCA蛋白定量试剂盒对蛋白进行定量,取50 g总蛋白进行SDS-PAGE电泳,之后将蛋白应用湿式电转法转移到0.22 mPVDF膜上,用含5%脱脂奶粉的封闭液封闭后分别孵育HAS-2一抗及山羊抗小鼠IgG二抗,应用GAPDH作为内参,ECL发光液发光显像。
1.6 RealtimePCR检测E-Cadhrein, Vimentin, Snail mRNA表达
应用同前的方法,提取转染后24h细胞总RNA并反转录为cDNA,用相对荧光定量PCR法分别对E-Cadhrein、Vimentin、Snail、β-actin进行检测。引物设计合成于上海生工生物。引物序列如下:E-cadherin上游引物5' -GAGTG CCAACTGGACCATTCAGTA-3',下游引物:5'-AGTCACCCACCTCTAAGGCCATC-3';Vimentin上游引物:5' -AGGAACAGCATGTCCAAATCG-3',下游引物:5' -AAGGGCATCCACTTCACAGG-3';Snail上游引物:5' -CGAAAGGCCTTCAACTGCAAAT-3',下游引物:5' -ACTGGTACTTCTTGAACTCTG-3'。
1.7 Western blot 检测E-cadherin、Vimentin、Slug蛋白质表达
应用同前的方法分别封闭E-cadherin、Vimentin、Slug一抗,检测E-cadherin、Vimentin、Slug蛋白在各组细胞中的表达。
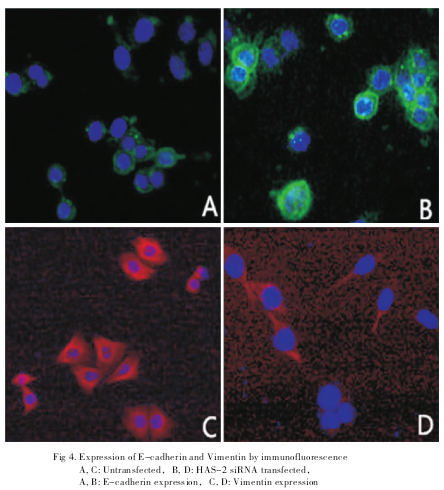
1.8 免疫荧光观察细胞E-cadherin、Vimentin的表达
取转染后48h的细胞爬片,冷PBS清洗3次,4%多聚甲醛冰上固定15min,冷PBS洗3次,0.5%Triton-PBS透膜5min,山羊血清封闭30min,分别于E-cadherin、Vimentin一抗4℃孵育过夜,次日取出复温孵育1h,PBS洗3次,避光处加荧光二抗,37℃避光孵育1h,PBS洗3次,加DAPI室温孵育2min,PBS洗3次,封片剂封片后荧光显微镜下照相。
统计学处理使用SPSS17.0完成,数据以均数±标准差, <0.05为差异具有统计学意义。
2、 结果
2.1 HAS-2干扰效率,μμ解剖科学进展 2014年第20卷第3期x±sP转染24h后用流式细胞仪检测出转染效率分别为66.7%、52%、68.1%。选择1: 1转染作为以后试验转染条件(图1a、1b)。
细胞转染24h后,与阴性对照组相比HAS-2siRNA转染组的HAS-2 mRNA表达水平明显下调,表达抑制率为 54.6±5.84 %(图1c)。在蛋白水平,HAS-2蛋白在转染后48h后表达水平亦明显下调,表达抑制率为(40.5±5.32)%(图1d)2.2 HAS-2 siRNA转染后各组E-Cadherin、Vimentin、Snail mRNA的表达。
以阴性对照组作为参照,E-Cadherin mRNA在实验组的相对表达量为(1.37±0.09),差别显著( <0.05);Vimentin mRNA在实验组的相对表达量为(0.64±0.06),差别显著( <0.05 ;SnailmRNA在H实验组的相对表达量为(0.49±0.04),差别显著( <0.05,图2)。
2.3 E-Cadherin、Vimentin、Slug蛋白表达水平的变化
HAS-2 siRNA转染48h后,E-Cadherin蛋白在未转染组、阴性对照组及实验组的相对表达量分别为1.02±0.09、1、1.39±0.02,差别具有统计学意义( <0.05);Vimentin蛋白在这三组的表达分别为。1.11±0.13、1、0.40±0.05,差别具有统计学意义( <0.05);Slug蛋白在上述三组的表达分别为0.97±0.12、1、0.30±0.09,差别具有统计学意义( <0.05,图3)。
2.4 免疫荧光观察结果
经饥饿处理后的爬片细胞行一抗及荧光二抗孵育及DAPI封片后经荧光显微镜观察,可见未转染组的细胞E-cadherin仅少量表达,实验组E-cadherin表达较未转染组细胞明显增多(图4A、4B),Vimentin在未转染组表达较多,而在实验组表达明显减少(图4C、4D)。
3、 讨论
大肠癌的侵袭与转移是大肠癌难以根治并引起高死亡率的主要原因。研究表明,EMT是肿瘤细胞获得侵袭和转移能力的最主要途径 。因此,研究诱导大肠癌发生EMT的关键分子及其可能的作用机制,从而研究出阻断其机制的有效措施对大肠癌的治疗及预后有着重要的临床价值。大肠癌的侵袭、转移是一个涉及多基因多步骤的复杂过程,HA与大肠癌的侵袭、转移过程密切相关,HAS-2作为HA合成过程中的关键酶在大肠癌的侵袭、转移中的作用不容忽视,其作用机制亦成为目前研究的热点问题。
本研究所见HAS-2沉默后24h后,E-CadhreinmRNA水平较阴性对照组上调,Vimentin、SnailmRNA表达水平下调,由此表明,HAS-2沉默在mRNA水平对大肠癌细胞的EMT有抑制作用。转染48小时后E-Cadhrein蛋白表达水平上调,Vimentin、Slug蛋白水平下调,证实在蛋白表达层面,HAS-2沉默同样能够抑制大肠癌细胞EMT。为了更进一步验证HAS-2沉默对大肠癌细胞EMT的抑制作用,本研究应用免疫荧光检测方法,同样发现了转染后E-Cadhrein表达上调,Vimentin表达下调,说明了HAS-2沉默对大肠癌细胞EMT具有抑制作用。综上所述,HAS-2沉默能够抑制大肠癌EMT的发生,从而发挥抑制大肠癌粘附、转移的作用。由此推测,HAS-2可能有促进大肠癌细胞EMT的作用,HAS-2可能通过促进大肠癌细胞EMT从而促进大肠癌细胞的粘附、转移。
HAS-2对大肠癌细胞EMT影响机制,尤其是细胞传导信号通路的研究还有待于进一步实验验证和分析。很多研究表明:TGF-β是调控EMT 的主要机制。TGF-β通过Smad信号通路激活很多转录因子,如ZEB1、SIP1、Snail、Slug、Twist等,这些核转录因子能够引起紧密连接蛋白如ZO-1和上皮生物标志物如E-cadherin等的表达下调,间质生物标志物Vimentin、N-cadherin等蛋白表达上调,使上皮来源的肿瘤细胞失去极性呈现纤维样表型,黏附能力下降,细胞迁移和侵袭能力增强。TGF-β还可以通过激活TGF-β活化激酶TAK1,进而激活下游的一连串的信号传导通路,如JNK、Erk、PI3K 及p38 MAPK激酶信号通路,并且独立于TGF-β/Smad信号通路而发挥作用,诱导EMT的发生。Porsch H等 用TGF-β刺激NMuMG细胞(小鼠乳腺上皮细胞),之后用Realtime RT-PCR检测出HAS-2 mRNA表达增加,而HAS-1、HAS-3的表达没有变化,这表明在乳腺上皮细胞中,HAS-2在TGF-β诱导HA合成的过程中起主要作用,另外Porsch H等还发现在TGF-β诱导EMT产生的过程中HAS-2亦起到重要作用,利用HAS-2 siRNA沉默HAS-2,将显著降低TGF-β所诱导的EMT。HAS-2在TGF-β诱导小鼠乳腺上皮细胞EMT中发挥了重要的作用,那么HAS-2在TGF-β诱导大肠癌细胞EMT中是否发挥了同样的作用呢?
相关研究还有待于进一步的实验求证,其发挥作用的主要通过信号传导通路仍需进一步研究与探讨。





