软组织多形性玻璃样变血管扩张性肿瘤诊断分析
时间:2018-09-03 来源:诊断病理学杂志 作者:吴涛,丁向东,张志魁 本文字数:3918字
关键词:软组织多形性玻璃样变血管扩张性肿瘤; 临床病理; 鉴别诊断; 预后;
软组织多形性玻璃样变血管扩张性肿瘤 (PHAT) 是一种罕见的发生于软组织、瘤细胞分化方向未定的肿瘤, 由Smith等[1]于1996年首次报道。肿瘤由梭形细胞和多形性细胞组成, 伴大量含铁血黄素沉积, 部分细胞可见核内包涵体, 间质内可见多少不等的炎细胞浸润, 核分裂象罕见。WHO (2013) 软组织和骨肿瘤分类将其归为分化不确定的肿瘤[2].ICD-O编码为8820/1, 属于一种中间性肿瘤。本研究收集广州金域医学检验中心病理部2014-2017年间经病理确诊的软组织多形性玻璃样变血管扩张性肿瘤2例, 回顾性分析和总结其临床病理特征, 结合文献讨论其诊断与鉴别诊断。

1、 材料与方法
1.1、 材料
例1女性, 27岁。因发现左膝关节肿块半个月就诊。外科检查示左膝关节外侧见一直径4 cm软组织肿块, 活动度中, 与周围组织边界尚清, 考虑神经鞘瘤的可能。行肿块单纯切除。
例2女性, 63岁。因发现右小腿中段肿块5个月就诊。超声检查示右小腿中段见一直径3.5 cm软组织肿块, CT示肿块密度不均。行肿块单纯切除。
1.2、 方法
2份标本均经4%中性甲醛液固定, 常规石蜡包埋, 4μm厚切片, HE染色, 光镜观察。免疫组化采用En Vision两步法。所用一抗SMA、desmin、vimentin、CD34、CD31、广谱CK、Cam5.2、S-100和CD68等均购自Leica公司, SOX10购自Santa公司, ERG购自北京中杉金桥生物技术有限公司。根据抗体说明书及实验室规范进行操作。常规设立阴性和阳性对照。
1.3、 结果判定
免疫组化抗体以细胞核和/或胞质、胞膜出现棕黄色颗粒为阳性细胞。阳性对照用已知阳性组织同时染色, 阴性对照用PBS代替一抗。
2、 结果
2.1、 巨检
例1:灰红色组织1块, 表面稍光滑, 无包膜, 大小4 cm×3 cm×2.6 cm, 切面暗红色、质软, 可见裂隙或小囊腔。例2:灰褐色不规则组织1块, 无包膜, 大小3.5 cm×3 cm×3 cm, 切面暗红色、质软, 可见大小不等囊腔, 内含血性液体。
2.2、 镜检
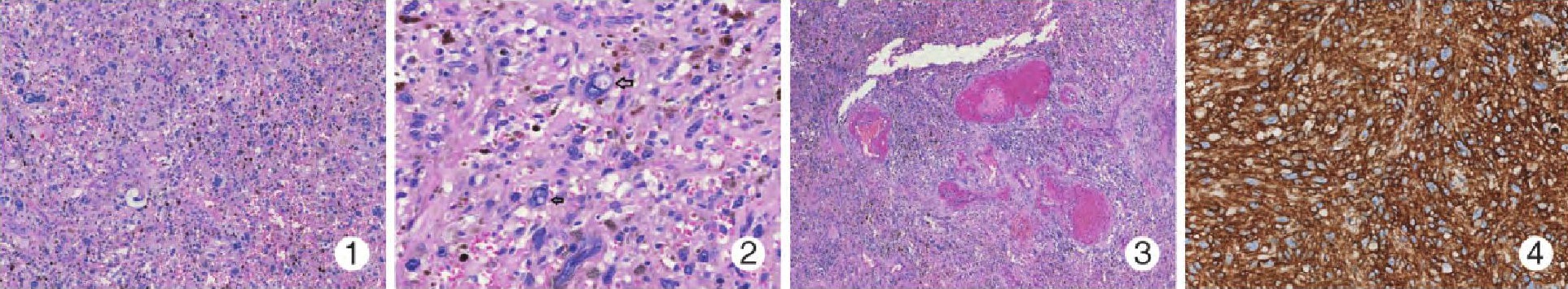
2例形态学改变类似。肿瘤边界清楚, 缺乏包膜, 低倍镜下被纤维组织分隔成结节状, 由梭形细胞和多形性细胞组成 (图1) , 伴大量含铁血黄素沉着, 部分细胞可见核内包涵体 (图2) .局部区域可见成簇分布且扩张的薄壁血管, 部分见血栓, 管壁周围见纤维素样物质沉积伴玻璃样变性 (图3) .部分梭形细胞呈栅栏状排列, 类似于神经鞘瘤或神经纤维瘤。间质内可见多少不等的炎细胞浸润, 核分裂象罕见。
2.3、 免疫组化
肿瘤细胞CD34 (图4) 和vimentin均 (+) , Ki-67增殖指数<3%, SMA、desmin、S-100、SOX10、CD31、ERG、CD68和广谱CK均 (-) .
病理诊断:软组织多形性玻璃样变血管扩张性肿瘤。
患者均接受单纯肿物切除术。例1术后随访44个月, 例2术后随访9个月, 一般情况均良好, 未见肿瘤复发或转移。
3、 讨论
PHAT为一种少见的软组织肿瘤, 生长缓慢, 瘤细胞分化方向不确定, 伴局部侵袭性的生物学行为[3].在PHAT命名之前, 多数病例被诊断为恶性纤维组织细胞瘤或古老型神经鞘瘤。截至目前, 英文文献报道<100例, 中文文献报道25例[5-11].本瘤好发于成年人, 但Folpe和Weiss[4]的最大宗41例报道显示, 患者年龄为10~79岁, 中位年龄为51岁, 无明显性别差异。最常见的发病部位为下肢皮下组织, 尤其是踝和足, 很少发生在深部软组织[2].临床表现为局部缓慢性生长的肿块, 临床诊断多为血肿、Kaposi肉瘤或其他良性肿瘤。
图1 散在核大深染的多形性细胞, 背景见较多含铁血黄素沉着图2偶见细胞核内包涵体 (箭头) 图3扩张的薄壁血管, 管壁见纤维素沉积, 伴玻璃样变性图4肿瘤细胞CD34强 (+) En Vision法
Folpe等[4]曾提出早期PHAT的概念, 认为某些前驱病变可以进展为PHAT.前驱病变主要为含铁血黄素沉着性纤维脂肪瘤样肿瘤 (HFLT) , 50%的PHAT病例周围可以见到类似HFLT的区域。Boland等[12]从遗传学的角度进一步证实两者的相关性, 两者都会出现TGFBR3和/或MGEA5基因重排。Michal等[13]发现, 在PHAT中可以见到类似黏液炎症性纤维母细胞性肉瘤 (MIFS) 的区域。Solomon等[14]从细胞遗传学上证实, HFLT可以向MIFT转化。PHAT、HFLT和MIFT可能属于同一瘤谱。
3.1、 诊断
本例肿瘤组织没有包膜, 低倍镜下边界清楚。但有文献报道, 该肿瘤呈浸润性生长, 可侵及周围正常组织[4].特征性的形态学改变包括: (1) 成簇的薄壁扩张血管, 管壁见纤维素沉着, 伴玻璃样变, 部分血管可见血栓; (2) 散在核大深染的多形性细胞, 但核染色质细腻, 部分细胞可见核内包涵体; (3) 大量含铁血黄素沉着; (4) 虽然可见较多“非典型”多形性细胞, 但核分裂象非常少见; (5) 间质见混合性炎症细胞浸润。免疫组化CD34和vimentin阳性, S-100、SMA、desmin、CD31、广谱CK、Cam5.2和CD68均阴性, Ki-67增殖指数<3%.结合组织学和免疫表型, 支持PHAT的诊断。
3.2、 鉴别诊断
3.2.1、 多形性未分化肉瘤 (UPS)
低倍镜下, PHAT极易与UPS混淆。UPS多发生于50~70岁中老年人, 极少发生于年轻人, 且多见于躯干 (包括腹膜后和盆腔) 、四肢等深部软组织。镜下由明显异型的梭形和多形性细胞混合组成, 常伴肿瘤性坏死, 可以见到出血、含铁血黄素沉着和囊性变, 核分裂象易见, 包括病理性核分裂。没有特异性免疫组化标记, 但Ki-67增殖指数非常高。结合临床及病理改变, 可以鉴别。
3.2.2、 神经鞘瘤
PHAT的部分区域可以见到梭形细胞排列成波浪状、栅栏状, 类似于神经鞘瘤, 加之可见到多形性细胞, 尤其需要和古老型神经鞘瘤鉴别。PHAT的S-100阴性, 而神经鞘瘤S-100阳性, 可与之鉴别。
3.2.3、 巨细胞型孤立性纤维性肿瘤 (SFT)
本病好发于眼睑, 常伴一些扩张的假血管样或血窦样腔隙, 周围可见散在核深染的多核巨细胞。巨细胞型SFT和PHAT均CD34阳性。SFT特征性表达STAT6, 且PHAT伴有其他特征性的形态学改变, 可相鉴别。
3.2.4、 滑膜肉瘤
好发于年轻人的高级别肉瘤, 常呈现双相分化。Gupta等[15]报道了1例形态学类似于PHAT, 且经FISH确诊的滑膜肉瘤。在黏液样变背景中, 主要由梭形细胞组成, 可见扩张的血管, 且伴纤维素沉着, 细胞轻度异型, 核分裂象少见。滑膜肉瘤通常上皮标记和vimentin阳性, 一般CD34阴性, 特征性地出现SYT基因易位, 可与PHAT鉴别。
3.2.5、 含铁血黄素沉着性纤维脂肪瘤样肿瘤
文献提示两者可能属于同一瘤谱[4].
3.3、 分子病理
PHAT、HFLT和MIFS可显示有t (1;3) (p31;q12) 和t (1;10) (p31;q25) 染色体易位[16].新近报道显示, 有TGFBR3和/或MGEA5基因重排[12].
3.4、 治疗与预后
对于PHAT, 宜采取局部广泛切除[3].Folpe等[4]统计的局部复发率为33%~50%, 但无远处转移, 且复发病例经再次局部广泛切除后, 可得到控制。本研究2例PHAT, 手术切除后分别随访44个月和9个月, 尚未见复发或转移。
参考文献:
[1]Smith ME, Fisher C, Weiss SW.Pleomorphic hyalinizing angiectatic tumor of soft parts.A low-grade neoplasm resembling neurilemoma[J].Am J Surg Pathol, 1996, 20 (1) :21-29.
[2]Fletcher CDM, Bridge JA, Hogendoorn PCW, et al.WHO of soft tissue and bone[M].Lyon:IARC Press, 2013.200.
[3]王坚, 朱雄增。软组织肿瘤病理学[M].第2版。北京:人民卫生出版社, 2017.1271-1276.
[4]Folpe AL, Weiss SW.Pleomorphic hyalinizing angiectatic tumor:analysis of 41 cases supporting evolution from a distinctive precursor lesion[J].Am J Surg Pathol, 2004, 28 (11) :1417-1425.
[5]王坚, 盛伟琪, 施达仁, 等。软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志, 2000, 16 (1) :1-3.
[6]张仁亚, 韩庶勇, 许艳梅。软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志, 2005, 21 (5) :612-614.
[7]董兵卫, 何会女, 张粉娟, 等。软组织多形性玻璃样变血管扩张性肿瘤的临床病理学观察[J].临床与实验病理学杂志, 2009, 25 (5) :465-469.
[8]陈海玲, 张帆, 王文军, 等。软组织多形性透明变性血管扩张性肿瘤2例报道[J].诊断病理学杂志, 2012, 19 (1) :58-59.
[9]黄剑。软组织多形性玻璃样变血管扩张性肿瘤临床病理分析[J].长江大学学报 (自然科学版) , 2013, 10 (18) :22-23.
[10]何娅, 丁文燕。颈部软组织多形性透明变性血管扩张性肿瘤临床病理观察[J].诊断病理学杂志, 2013, 20 (2) :94-96.
[11]奉孝荣, 郑蓉, 陈莉, 等。软组织多形性透明变性血管扩张性肿瘤1例报道[J].诊断病理学杂志, 2016, 23 (3) :220-221.
[12]Boland JM, Folpe AL.Hemosiderotic fibrolipomatous tumor, pleomorphic hyalinizing angiectatic tumor, and myxoinflammatory fibroblastic sarcoma:related or no[J]?Adv Anat Pathol, 2017, 24 (5) :268-277.
[13]Michal M, Kazakov DV, Hadravsky'L, et al.Pleomorphic hyalinizing angiectatic tumor revisited:all tumors manifest typical morphologic features of myxoinflammatory fibroblastic sarcoma, further suggesting 2 morphologic variants of a single entity[J].Ann Diagn Pathol, 2016, 20:40-43.
[14]Solomon DA, Antonescu CR, Link TM, et al.Hemosiderotic fibrolipomatous tumor, not an entirely benign entity[J].Am J Surg Pathol, 2013, 37 (10) :1627-1630
[15]Gupta N, Kenan S, Kahn LB.Synovial sarcoma mimicking pleomorphic hyalinizing angiectatic tumor of soft parts:a case report[J].Int J Surg Pathol, 2017, 1:1066896917723463.
[16]Wei S, Pan Z, Siegal GP, et al.Complex analysis of a recurrent pleomorphic hyalinizing angiectatic tumor of soft parts[J].Hum Pathol, 2012, 43 (1) :121-126.
软组织多形性玻璃样变血管扩张性肿瘤 (PHAT) 是一种罕见的发生于软组织、瘤细胞分化方向未定的肿瘤, 由Smith等[1]于1996年首次报道。肿瘤由梭形细胞和多形性细胞组成, 伴大量含铁血黄素沉积, 部分细胞可见核内包涵体, 间质内可见多少不等的炎细胞浸润, 核分裂象罕见。WHO (2013) 软组织和骨肿瘤分类将其归为分化不确定的肿瘤[2].ICD-O编码为8820/1, 属于一种中间性肿瘤。本研究收集广州金域医学检验中心病理部2014-2017年间经病理确诊的软组织多形性玻璃样变血管扩张性肿瘤2例, 回顾性分析和总结其临床病理特征, 结合文献讨论其诊断与鉴别诊断。

1.1、 材料
例1女性, 27岁。因发现左膝关节肿块半个月就诊。外科检查示左膝关节外侧见一直径4 cm软组织肿块, 活动度中, 与周围组织边界尚清, 考虑神经鞘瘤的可能。行肿块单纯切除。
例2女性, 63岁。因发现右小腿中段肿块5个月就诊。超声检查示右小腿中段见一直径3.5 cm软组织肿块, CT示肿块密度不均。行肿块单纯切除。
1.2、 方法
2份标本均经4%中性甲醛液固定, 常规石蜡包埋, 4μm厚切片, HE染色, 光镜观察。免疫组化采用En Vision两步法。所用一抗SMA、desmin、vimentin、CD34、CD31、广谱CK、Cam5.2、S-100和CD68等均购自Leica公司, SOX10购自Santa公司, ERG购自北京中杉金桥生物技术有限公司。根据抗体说明书及实验室规范进行操作。常规设立阴性和阳性对照。
1.3、 结果判定
免疫组化抗体以细胞核和/或胞质、胞膜出现棕黄色颗粒为阳性细胞。阳性对照用已知阳性组织同时染色, 阴性对照用PBS代替一抗。
2、 结果
2.1、 巨检
例1:灰红色组织1块, 表面稍光滑, 无包膜, 大小4 cm×3 cm×2.6 cm, 切面暗红色、质软, 可见裂隙或小囊腔。例2:灰褐色不规则组织1块, 无包膜, 大小3.5 cm×3 cm×3 cm, 切面暗红色、质软, 可见大小不等囊腔, 内含血性液体。
2.2、 镜检
2例形态学改变类似。肿瘤边界清楚, 缺乏包膜, 低倍镜下被纤维组织分隔成结节状, 由梭形细胞和多形性细胞组成 (图1) , 伴大量含铁血黄素沉着, 部分细胞可见核内包涵体 (图2) .局部区域可见成簇分布且扩张的薄壁血管, 部分见血栓, 管壁周围见纤维素样物质沉积伴玻璃样变性 (图3) .部分梭形细胞呈栅栏状排列, 类似于神经鞘瘤或神经纤维瘤。间质内可见多少不等的炎细胞浸润, 核分裂象罕见。
2.3、 免疫组化
肿瘤细胞CD34 (图4) 和vimentin均 (+) , Ki-67增殖指数<3%, SMA、desmin、S-100、SOX10、CD31、ERG、CD68和广谱CK均 (-) .
病理诊断:软组织多形性玻璃样变血管扩张性肿瘤。
患者均接受单纯肿物切除术。例1术后随访44个月, 例2术后随访9个月, 一般情况均良好, 未见肿瘤复发或转移。
3、 讨论
PHAT为一种少见的软组织肿瘤, 生长缓慢, 瘤细胞分化方向不确定, 伴局部侵袭性的生物学行为[3].在PHAT命名之前, 多数病例被诊断为恶性纤维组织细胞瘤或古老型神经鞘瘤。截至目前, 英文文献报道<100例, 中文文献报道25例[5-11].本瘤好发于成年人, 但Folpe和Weiss[4]的最大宗41例报道显示, 患者年龄为10~79岁, 中位年龄为51岁, 无明显性别差异。最常见的发病部位为下肢皮下组织, 尤其是踝和足, 很少发生在深部软组织[2].临床表现为局部缓慢性生长的肿块, 临床诊断多为血肿、Kaposi肉瘤或其他良性肿瘤。
图1 散在核大深染的多形性细胞, 背景见较多含铁血黄素沉着图2偶见细胞核内包涵体 (箭头) 图3扩张的薄壁血管, 管壁见纤维素沉积, 伴玻璃样变性图4肿瘤细胞CD34强 (+) En Vision法

3.1、 诊断
本例肿瘤组织没有包膜, 低倍镜下边界清楚。但有文献报道, 该肿瘤呈浸润性生长, 可侵及周围正常组织[4].特征性的形态学改变包括: (1) 成簇的薄壁扩张血管, 管壁见纤维素沉着, 伴玻璃样变, 部分血管可见血栓; (2) 散在核大深染的多形性细胞, 但核染色质细腻, 部分细胞可见核内包涵体; (3) 大量含铁血黄素沉着; (4) 虽然可见较多“非典型”多形性细胞, 但核分裂象非常少见; (5) 间质见混合性炎症细胞浸润。免疫组化CD34和vimentin阳性, S-100、SMA、desmin、CD31、广谱CK、Cam5.2和CD68均阴性, Ki-67增殖指数<3%.结合组织学和免疫表型, 支持PHAT的诊断。
3.2、 鉴别诊断
3.2.1、 多形性未分化肉瘤 (UPS)
低倍镜下, PHAT极易与UPS混淆。UPS多发生于50~70岁中老年人, 极少发生于年轻人, 且多见于躯干 (包括腹膜后和盆腔) 、四肢等深部软组织。镜下由明显异型的梭形和多形性细胞混合组成, 常伴肿瘤性坏死, 可以见到出血、含铁血黄素沉着和囊性变, 核分裂象易见, 包括病理性核分裂。没有特异性免疫组化标记, 但Ki-67增殖指数非常高。结合临床及病理改变, 可以鉴别。
3.2.2、 神经鞘瘤
PHAT的部分区域可以见到梭形细胞排列成波浪状、栅栏状, 类似于神经鞘瘤, 加之可见到多形性细胞, 尤其需要和古老型神经鞘瘤鉴别。PHAT的S-100阴性, 而神经鞘瘤S-100阳性, 可与之鉴别。
3.2.3、 巨细胞型孤立性纤维性肿瘤 (SFT)
本病好发于眼睑, 常伴一些扩张的假血管样或血窦样腔隙, 周围可见散在核深染的多核巨细胞。巨细胞型SFT和PHAT均CD34阳性。SFT特征性表达STAT6, 且PHAT伴有其他特征性的形态学改变, 可相鉴别。
3.2.4、 滑膜肉瘤
好发于年轻人的高级别肉瘤, 常呈现双相分化。Gupta等[15]报道了1例形态学类似于PHAT, 且经FISH确诊的滑膜肉瘤。在黏液样变背景中, 主要由梭形细胞组成, 可见扩张的血管, 且伴纤维素沉着, 细胞轻度异型, 核分裂象少见。滑膜肉瘤通常上皮标记和vimentin阳性, 一般CD34阴性, 特征性地出现SYT基因易位, 可与PHAT鉴别。
3.2.5、 含铁血黄素沉着性纤维脂肪瘤样肿瘤
文献提示两者可能属于同一瘤谱[4].
3.3、 分子病理
PHAT、HFLT和MIFS可显示有t (1;3) (p31;q12) 和t (1;10) (p31;q25) 染色体易位[16].新近报道显示, 有TGFBR3和/或MGEA5基因重排[12].
3.4、 治疗与预后
对于PHAT, 宜采取局部广泛切除[3].Folpe等[4]统计的局部复发率为33%~50%, 但无远处转移, 且复发病例经再次局部广泛切除后, 可得到控制。本研究2例PHAT, 手术切除后分别随访44个月和9个月, 尚未见复发或转移。
参考文献:
[1]Smith ME, Fisher C, Weiss SW.Pleomorphic hyalinizing angiectatic tumor of soft parts.A low-grade neoplasm resembling neurilemoma[J].Am J Surg Pathol, 1996, 20 (1) :21-29.
[2]Fletcher CDM, Bridge JA, Hogendoorn PCW, et al.WHO of soft tissue and bone[M].Lyon:IARC Press, 2013.200.
[3]王坚, 朱雄增。软组织肿瘤病理学[M].第2版。北京:人民卫生出版社, 2017.1271-1276.
[4]Folpe AL, Weiss SW.Pleomorphic hyalinizing angiectatic tumor:analysis of 41 cases supporting evolution from a distinctive precursor lesion[J].Am J Surg Pathol, 2004, 28 (11) :1417-1425.
[5]王坚, 盛伟琪, 施达仁, 等。软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志, 2000, 16 (1) :1-3.
[6]张仁亚, 韩庶勇, 许艳梅。软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志, 2005, 21 (5) :612-614.
[7]董兵卫, 何会女, 张粉娟, 等。软组织多形性玻璃样变血管扩张性肿瘤的临床病理学观察[J].临床与实验病理学杂志, 2009, 25 (5) :465-469.
[8]陈海玲, 张帆, 王文军, 等。软组织多形性透明变性血管扩张性肿瘤2例报道[J].诊断病理学杂志, 2012, 19 (1) :58-59.
[9]黄剑。软组织多形性玻璃样变血管扩张性肿瘤临床病理分析[J].长江大学学报 (自然科学版) , 2013, 10 (18) :22-23.
[10]何娅, 丁文燕。颈部软组织多形性透明变性血管扩张性肿瘤临床病理观察[J].诊断病理学杂志, 2013, 20 (2) :94-96.
[11]奉孝荣, 郑蓉, 陈莉, 等。软组织多形性透明变性血管扩张性肿瘤1例报道[J].诊断病理学杂志, 2016, 23 (3) :220-221.
[12]Boland JM, Folpe AL.Hemosiderotic fibrolipomatous tumor, pleomorphic hyalinizing angiectatic tumor, and myxoinflammatory fibroblastic sarcoma:related or no[J]?Adv Anat Pathol, 2017, 24 (5) :268-277.
[13]Michal M, Kazakov DV, Hadravsky'L, et al.Pleomorphic hyalinizing angiectatic tumor revisited:all tumors manifest typical morphologic features of myxoinflammatory fibroblastic sarcoma, further suggesting 2 morphologic variants of a single entity[J].Ann Diagn Pathol, 2016, 20:40-43.
[14]Solomon DA, Antonescu CR, Link TM, et al.Hemosiderotic fibrolipomatous tumor, not an entirely benign entity[J].Am J Surg Pathol, 2013, 37 (10) :1627-1630
[15]Gupta N, Kenan S, Kahn LB.Synovial sarcoma mimicking pleomorphic hyalinizing angiectatic tumor of soft parts:a case report[J].Int J Surg Pathol, 2017, 1:1066896917723463.
[16]Wei S, Pan Z, Siegal GP, et al.Complex analysis of a recurrent pleomorphic hyalinizing angiectatic tumor of soft parts[J].Hum Pathol, 2012, 43 (1) :121-126.
- 相关内容推荐
- 乳腺癌GRB7蛋白与HER2基因及蛋白表达2018-09-03
相近分类:
推荐阅读





