药物分析论文名师推荐10篇之第四篇:抗体类药物的生物分析方法
摘要:抗体类药物因其靶向性、高度特异性、低毒性等优点成为临床治疗众多疾病的首选药物,但在生物体内的处置机制有其特殊性和复杂性,极大地增加了生物检测的难度,因此必须建立灵敏、准确、可重复的测定方法。本文主要针对该类药物的生物分析方法,介绍酶联免疫吸附分析、电化学发光技术、液质联用技术、流式细胞术以及一些新技术方法的特点和应用概况,以期为研究此类药物提供参考。
关键词:单克隆抗体; 生物分析方法; 液质联用技术; 流式细胞术;
Abstract:
Antibody drugs have become the first choice for clinical treatment of many diseases due to their advantages of targeting, high specificity and low toxicity. However, the disposal mechanism in vivo has its particularity and complexity, which greatly increases the difficulty of biological detection. Therefore, to establish the sensitive, accurate and repeatable methods is urgent. This paper mainly focuses on the bioanalytical methods of this kind of drugs, introduces the characteristics and application of enzyme-linked immunosorbent assay, electrochemiluminescence, liquid chromatography-mass spectrometry, flow cytometry and some new techniques, in hope of providing a reference for the study of related drugs.
Keyword:
monoclonal antibody; bioanalytical methods; LC-MS/MS; flow cytometry;

随着生物技术的快速发展,越来越多的单克隆抗体药物被开发用于临床治疗。相比于以往的小分子药物,抗体药物具有特异性强、活性高、生物功能明确、毒性低、半衰期长、有利于临床应用等优点。调查显示,近几年单克隆抗体获得市场批准的速度是小分子药物的两倍[1].截至2018年9月,全球已上市的单克隆抗体药物有133个。
抗体类药物具有与内源性分子相似、相对分子质量大、分子类型多样和部分用药剂量小等特点,在生物体内的处置机制有其特殊性和复杂性,极大地增加了生物检测的难度。因此选用具有更高特异性、灵敏度、回收率、重现性以及更宽线性范围,并且能将进入体液的药物及其降解产物和代谢产物与内源性、外源性干扰物区别开来的分析方法是非常重要的。与典型的酶联免疫吸附测定法对多种不同靶点单抗的测定参数比较(Tab.1),各种分析手段都存在着各自的优缺点。因此,本文就目前进行该类药物的生物分析方法做一概述。
1 酶联免疫吸附分析(ELISA)
酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术,目前这种方法已经成为免疫分析领域"最通用"的分析方法。此方法是以酶标抗原或酶标抗体为主要试剂,通过复合物中的酶催化底物呈色而对被测物进行定性或定量的标记免疫技术,具有操作简单、快速、灵敏、经济并且适用于批量处理等优点[1].目前已广泛应用于各种抗体类药物的药代动力学研究中,如阿达木单抗及其生物仿制药[2]、PD-L1单抗[3]、抗体偶联药物[4]等。但是此方法也存在着一些不足:(1)涉及多个孵育和洗涤步骤;(2)有限的动态范围;(3)不能同时测定生物技术药物及其代谢产物;(4)易受内源性和外源性物质干扰;(5)高度依赖特异性高,亲和力强的高品质单克隆抗体试剂等。由此可见,ELISA 作为目前应用最为广泛的免疫分析法,仍需要不断完善及改进。
Tab.1 Characteristics of analyzed platforms
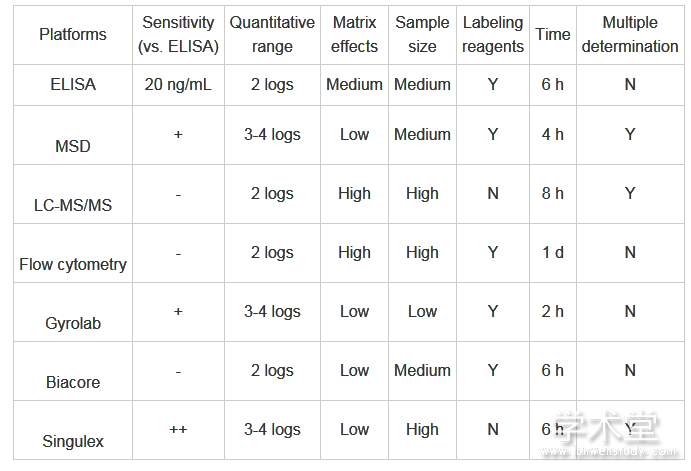
2 基于MSD技术平台的电化学发光技术(ECL)
电化学发光技术(electrochemiluminescence,ECL)是一个抗原与用电化学发光剂三联吡啶钌标记的抗体特异性结合,根据电极上的发光强度而对待测物进行定量分析,提供药物代谢动力学(pharmacokinetic,PK)研究的独特平台[5,6,7,8].其免疫分析格式类似于典型的ELISA格式,但将其线性范围扩大至1 000倍以上,灵敏度提升100倍,为目前一些疾病样本中低剂量待测蛋白浓度的测定提供了更好的选择。雷珠单抗(ranibizumab)是一种用于治疗新生血管性年龄相关性黄斑变性的药物,ELISA的灵敏度仅为20 ng/mL,而ECL可以在低至300 pg/mL的浓度下可靠地量化此单抗[7].赵小平[9]进行乙型肝炎病毒感染血清学标志物检测方法对比的结果显示ECL比ELISA方法操作更加简单,反应时间更短,准确度更高。Teimouri等[10]使用ECL检测人血清抗弓形虫IgG的灵敏度和特异性均高于ELISA,但其存在专业读取器增加测定成本的缺点。此外,MSD技术平台通过点阵技术可在96孔石墨电极板实现10个指标/孔的检测。Sumathi等[11]使用MSD平台上的多重免疫测定法准确地测量了血清样品中REGN3470,REGN3471和REGN3479的总浓度,并且特异性地定量每种抗埃博拉病毒单克隆抗体的浓度而不受其他抗体的干扰。因此,ECL方法具有线性范围宽、灵敏度高和可进行多重检测等优于ELISA方法的特点,但在吞吐量和工作流程方面没有太大改进。所以在成本预算较高的情况下,ECL方法可为ELISA提供高灵敏度,可重复性,同源性和血清耐受性的替代方法。
3 液质联用技术(LC-MS/MS)
配体结合试验(ligand binding assay,LBA)如ELISA、ECL等,由于低成本、操作简单和高通量等特征已成为蛋白质生物分析的标准检测方法。然而,该技术存在一些局限性,包括交叉反应性,高剂量钩状效应,自身抗体的存在会产生错误结果等。近年来,由于LC-MS/MS技术的改进,它已成为定量生物基质中蛋白质和抗体的有前景的替代技术。尤其是在早期的单克隆抗体开发阶段,LC-MS/MS方法的出现弥补了传统LBA开发时间长,缺乏特异性试剂,基质效应因物种而异的缺陷。目前已有诸多文献报道LC-MS/MS用于单克隆抗体临床和非临床的药代动力学研究[12,13,14].
在非临床研究中,可通过计算机搜索出抗体候选物的重链和轻链恒定区的可能序列,过滤动物物种的血浆蛋白质组的这些序列的肽,实现LC-MS/MS分析方法的通用性。Li等[15]使用一种通用的同位素标记特征肽技术和免疫捕获技术,对不含临床前物种氨基酸序列的4种人源化IgG1单抗和4种人源化IgG2单抗进行了大鼠体内的药代动力学研究,与ELISA方法之间的时间-浓度曲线显示出良好的一致性,实现了IgG2和IgG1的分析方法通用性。但在临床研究中此方法的通用性仍处于探索阶段[16].LC-MS/MS也具有可检测降解产物和翻译后修饰物质,免除高免疫原性对PK/TK分析存在干扰的优势。Kang等[17]报道了一种有效的LC-MS/MS法,可以同时测定胰高血糖素样肽1-Fc融合蛋白(GLP1-Fc)的母体药物和两种活性代谢物。Law和Wang等[18,19]均得到了LC-MS/MS法测得的抗体药物浓度始终高于ELISA法的结论,并证明了是由于抗药性抗体的存在而导致的。此外,分析物富集、色谱分离和多反应监测技术提供了多个选择维度,使LC-MS/MS适用于多重分析。Lanshoeft等[20]成功地运用LC-MS/MS的多重分析同时定量多种不同人类IgG1抗体。由此可见,LC-MS/MS具有线性动态范围宽、方法开发快、多组分分析、可同时量化母体和代谢物等优点。
LC-MS/MS法可使单克隆抗体大小的蛋白质(~150 000)的定量下限达到50 ng/mL[21],灵敏度稍低于ELISA,但此水平足以在大多数情况下对抗体药物进行定量。并且随着更多尖端技术的出现,包括免疫捕获(IC)在内的样品制备过程的改进,灵敏度得到了显著提高,但可重复性差这一问题尚未解决。
4 流式细胞术(flow cytometry)
在免疫分析方法中,通常需要精制的抗原以及特异性的单克隆抗体用于生物基质中被分析物的捕获与检测,流式细胞术则可基于空间结构近乎于天然存在形式的细胞表面抗原来定量检测生物基质中的抗体。RhD是在Rh血型系统中存在于红细胞表面的D抗原,Yver等[22]使用流式细胞术成功地对一种人重组单克隆抗RhD抗体roledumab进行了定量。抗体-药物偶联物(antibody-drug conjugate,ADC)的抗原是具有复杂蛋白质结构的膜蛋白,其可溶性表达仍然是一个难题。奥法木单抗(OFA)是一种抗CD20单克隆抗体,用于治疗非霍奇金淋巴瘤和慢性淋巴细胞白血病。Zhao等[23]建立了基于流式细胞术的奥法木单抗ADC(OFA-HL-MMAE)药物测定分析方法,并利用这种新方法定量测量了小鼠血清中OFA-HL-MMAE的浓度。邓承莲等[24]采用ELISA与流式细胞术两种方法对抗CD20单抗进行定量分析,结果表明两种方法均具有良好的特异性、精密度和准确度,但其灵敏度与ELISA相比相差约两个数量级。由此看出,此方法不受可溶性抗原表达问题的限制,还扩展了LBA方法的应用范围,对于量化临床ADC样品和以细胞表面抗原为靶点的单克隆抗体具有很高的价值。但存在着可重复性差、灵敏度低的缺点,而且适用性及通用性也需要我们进一步的探究。
5 新型检测技术
5.1 微流控免疫分析平台(Gyrolab)
典型的Gyrolab免疫测定是将分析试剂和研究样品从聚丙烯微量滴定板全自动转移到一系列含有纳升级链霉亲合素蛋白柱的光盘(CD)微结构上,通过测量来自每个柱的荧光信号定量药物浓度。可在5 h内完成单个5 CD运行以获得560个最大样品量,以允许在有限的时间内进行快速的分析方法开发[25].具有试剂消耗低,动态范围宽,基质效应低,样品体积小和自动化等优点。已被提议作为传统的基于微量滴定板的免疫测定的可行替代方法。
Liu等[25]使用Gyrolab平台对两种抗体的四个非临床毒理学和两个临床试验进行了验证,根据LBA方法的可接受标准,观察到分析批的通过率高达83%~100%,真实样品再分析的通过率高达94%以上,与传统的ELISA方法相比,样本测定时间缩短了1~2周,样品和试剂的消耗量低约10倍。此外,研究显示较短的孵育时间使非特异性相互作用最小化,从而使其基质效应比ELISA低10倍,比ECL低2倍[26].常规ELISA方法检测克罗恩病人中的单克隆抗体Etrolizumab时有着较强的基质干扰,Williams等[27]运用Gyrolab免疫测定法有效地消除了基质效应,并将其定量范围扩大了将近两个数量级。但此平台易发生污染和管道堵塞,需要较为频繁的清洁,而且每个Bioaffy CD的价格比ELISA板的价格高出约300倍,缓冲液和标记系统等也需要额外的费用[28,29].只有当分析时间作为一个考虑因素时,Gyrolab工作站最终比ELISA和ECL更具成本效益。
5.2 表面等离子共振技术(Biacore)
BIA(biomolecular interaction analysis)技术是基于一种称为表面等离子共振(surface plasmon resonance,SPR)的物理光学现象发展起来的新型生物传感分析技术。将一种生物分子固定在传感器的葡聚糖表面,与之相互作用的分子溶于流过芯片表面的溶液中,通过SPR共振角的变化检测器能跟踪检测溶液中的分子与芯片表面的分子结合、解离整个过程的变化。此方法被广泛用于动力学常数和样品浓度的测定[30]、分析分子的相互作用模式[31]等方面。Alaedini等[32]用Biacore平台检测抗单唾液酸四己糖神经节苷脂(抗GM1)自身抗体,其灵敏度和特异性与经典的ELISA试验相当。Schlichtiger等[33]检测抗心磷脂抗体,Biacore平台显示出比传统ELISA更高的灵敏度,并允许分析结合动力学和亲和力。与常规ELISA相比,Biacore系统在免疫测定中具有样本需求量少、监测实时性、样品无需标记及快速自动化等突出优点。但此项检测技术还不够成熟,对蛋白纯度要求也较高。
5.3 单分子免疫检测技术 (single molecule counting,Erenna)
单分子计数(SMC)技术利用激光聚焦于爱里斑中单个荧光标记分子,首次实现了在单分子水平对蛋白进行计量。用洗脱液将检测抗体从基于珠或板的免疫复合物中解离下来,并送入Erenna系统的毛细管中,通过独特的软件拟合单个荧光素标记抗体在通过检测空间时产生的荧光闪烁输出信号,可实现宽动态范围和增强的灵敏度。
SMCTM技术采用了与传统ELISA技术十分相似的流程,但将灵敏度提高了三个数量级,并且具有多重检测的优势。Gilbert等[34]通过含有多个激光器的Erenna系统一次性准确地测量三种分析物的亚pg/mL含量,此多路复用可减少使用较小体积的样品来分析多个分析物所需的时间。但是SMCTM技术吞吐量相对较低,每个分析人员每天的检测通量不可能超过两个96孔板[35],存在着试剂残留的问题[36].测定成本也较高,但既可使用磁珠又可使用普通96孔板作为抗体包被介质的特点,使其在灵敏度和成本方面取得了巧妙平衡。
6 结论与展望
单抗药物凭借其靶向性强、毒性低,具有传统化学疗法无可比拟的优势,广泛应用于临床。伴随着生物技术的发展,又涌现出了各种更具疗效的抗体药物衍生物,如结构域抗体、双特异性抗体、肽抗体、抗体药物结合物等。虽然此类药物的生物分析技术已经获得了长足发展,有多种技术手段可供选择,但选择一个合适的生物分析平台是由多个因素决定的,不仅取决于灵敏度要求,还取决于平台可访问性、样本量可用性、方法开发容易性、平台灵活性和吞吐量需求。应根据这类药物性质特点、方法需求及可操作性等选择适合的分析方法或者多种分析手段联合使用。随着科技的进步,也将会有更灵敏、样本量需求更少、分析周期更短、重复性更高、全自动化等优点的生物分析技术被开发出来,为该类药物的药动学研究提供更可靠的数据。
参考文献
[1] Frese K,Eisenmann M,Ostendorp R,et al.An automated immunoassay for early specificity profiling of antibodies[J].mAbs,2013,5(2):279-287.
[2] Puri A,Niewiarowski A,Arai Y,et al.Pharmacokinetics,safety,tolerability and immunogenicity of FKB327,a new biosimilar medicine of adalimumab/Humira,in healthy subjects[J].Brit J Clin Pharmacol,2017,83(7):1405-1415.
[3] 李雪,史晶莹,董雪,等。一种人抗PD-L1单抗的间接ELISA方法的建立[J].生物技术,2017,27(6):552-556.
[4] 李萌,于传飞,王文波,等。抗体偶联药物抗HER2单抗-MCC-DMl质控方法的建立[J].药物分析杂志,2016,36(1):22-30.
[5] Soderstrom CI,Spriggs FP,Song W,et al.Comparison of four distinct detection platforms using multiple ligand binding assay formats[J].J Immunol Methods,2011,371(1/2):106-113.
[6] 夏明。ECLIA法检测血清促甲状腺激素受体抗体在自身免疫性甲状腺病中的诊断价值[J].中国医学工程,2015,23(1):160-162.
[7] Lowe J,Maia M,Wakshull E,et al.Development of a novel homogenous electrochemiluminescence assay for quantitation of ranibizumab in human serum[J].J Pharm Biomed Anal,2010,52(5):680-686.
[8] Smeraglia J,Silva JP,Jones K.Improving the sensitivity and specificity of a bioanalytical assay for the measurement of certolizumab pegol[J].Bioanalysis,2017,9(16):1217-1226.
[9] 赵小平。两种不同免疫检验方法检测乙型肝炎病毒感染血清学标志物的临床对比探讨[J].中外医学研究,2019,17(3):61-62.
[10] Teimouri A,Modarressi MH,Shojaee S,et al.Detection of toxoplasma-specific immunoglobulin G in human sera:performance comparison of in house Dot-ELISA with ECLIA and ELISA[J].Euro J Clin Microbiol,2018,37(8):1421-1429.
[11] Sumathi S,Mohamed K,Rabih S,et al.Safety,pharmacokinetics,and immunogenicity of a co-formulated cocktail of three human monoclonal antibodies targeting Ebola virus glycoprotein in healthy adults:a randomised,first-in-human phase 1 study[J].Lancet Infect Dis,2018,18(8):884-893.
[12] Peng X,Liu B,Li Y,et al.Development and Validation of LC-MS/MS Method for the Quantitation of Infliximab in Human Serum[J].Chromatographia,2015,78(7):521-531.
[13] Iwamoto N,Shimada T,Terakado H,et al.Validated LC-MS/MS analysis of immune checkpoint inhibitor Nivolumab in human plasma using a Fab peptide-selective quantitation method:nano-surface and molecular-orientation limited (nSMOL) proteolysis[J].J Chromatogr B,2016,1023-1024:9-16.
[14] 黄怡,李晓宇,田芳,等。质谱方法实现抗体类药物糖链修饰的鉴定与定量研究[J].中国生物工程杂志,2018,38(1):32-41.
[15] Li H,Ortiz R,Tran L,et al.General LC-MS/MS method approach to quantify therapeutic monoclonal antibodies using a common whole antibody internal standard with application to preclinical studies[J].Anal Chem,2012,84(3):1267-1273.
[16] Furlong MT,Titsch C,Xu W,et al.An exploratory universal LC-MS/MS assay for bioanalysis of hinge region-stabilized human IgG4 mAbs in clinical studies[J].Bioanalysis,2014,6(13):1747-1758.
[17] Kang L,Camacho RC,Li W,et al.Simultaneous catabolite identification and quantitation of large therapeutic protein at the intact level by immunoaffinity capture liquid chromatography-high-resolution mass spectrometry[J].Anal Chem,2017,89(11):6065-6075.
[18] Law WS,Genin JC,Miess C,et al.Use of generic LC-MS/MS assays to characterize atypical PK profile of a biotherapeutic monoclonal antibody[J].Bioanalysis,2014,6(23):3225-3235.
[19] Wang SJ,Wu ST,Gokemeijer J,et al.Attribution of the discrepancy between ELISA and LC-MS/MS assay results of a PEGylated scaffold protein in post-dose monkey plasma samples due to the presence of anti-drug antibodies[J].Anal Bioanal Chem,2012,402(3):1229-1239.
[20] Lanshoeft C,Cianférani,Sarah,et al.Generic hybrid ligand binding assay liquid chromatography high-resolution mass spectrometry-based workflow for multiplexed human immunoglobulin G1 quantification at the intact protein level:application to preclinical pharmacokinetic studies[J].Anal Chem,2017,89(4):2628-2635.
[21] Kang L,Weng N,Jian W.LC-MS bioanalysis of intact proteins and peptides[J].Biomed Chromatogr,2020,34(1):e4633.
[22] Yver A,Homery MC ,Fuseau E,et al.Pharmacokinetics and safety of roledumab,a novel human recombinant monoclonal anti-RhD antibody with an optimized Fc for improved engagement of FCγRIII,in healthy volunteers[J].Vox Sanguinis,2012,103(3):213-222.
[23] Zhao WB,Qiu CX,Shen Y,et al.In situ,quantitative bioanalysis of monomethyl auristatin E-conjugated antibody-drug conjugates by flow cytometry[J].Euro J Pharmaceut Sci,2018,120:89-95.
[24] 邓承莲,邹佳,欧伦,等。两种重组抗CD20人源化单克隆抗体定量分析方法的比较及其在药代动力学研究中的应用[J].分析化学,2014,42(3):337-342.
[25] Liu R,Hoffpauir B,Chilewski SD,et al.Accelerating regulated bioanalysis for biotherapeutics:case examples using a microfluidic ligand binding assay platform[J].AAPS J,2017,19(1):82-91.
[26] Chilewski SD,Mora JR,Gleason C,et al.Addressing matrix effects in ligand-binding assays through the use of new reagents and technology[J].Bioanalysis,2014,6(8):1059-1067.
[27] Williams K,Erickson R,Fischer SK.Overcoming disease-specific matrix effect in a clinical pharmacokinetic assay using a microfluidic immunoassay technology[J].Bioanalysis,2017,9(16):1207-1216.
[28] Roman J,Qiu J,Dornadula G,et al.Application of miniaturized immunoassays to discovery pharmacokinetic bioanalysis[J].J Pharmacol Toxicol Methods,2011,63(3):227-235.
[29] Mora JR,Obenauer-kutner L,Patel VV.Application of the GyrolabTM platform to ligand-binding assays:a user's perspective.[J].Bioanalysis,2010,2(10):1711-1715.
[30] 马春梅,刘莉。基于Biacore T200 分析系统研究阿达木单抗生物学活性[J].世界临床药物,2016,37(5):308-313.
[31] Winzor DJ.Interpretation of results from the competitive Biacore procedure for characterizing immunochemical interactions in solution[J].J Mol Recognit,2018,31(7):e2702.
[32] Alaedini A,Latov N.A surface plasmon resonance biosensor assay for measurement of anti-GM1 antibodies in neuropathy[J].Neurology,2001,56(7):855-860.
[33] Schlichtiger A,Baier C,Yin MX,et al.Covalent attachment of functionalized cardiolipin on a biosensor gold surface allows repetitive measurements of anticardiolipin antibodies in serum[J].Anal Bioanal Chem,2013,405(1):275-285.
[34] Gilbert M,Livingston R,Felberg J,et al.Multiplex single molecule counting technology used to generate interleukin 4,interleukin 6,and interleukin 10 reference limits[J].Anal Biochem,2016,503:11-20.
[35] Fraser S,Dysinger M,Soderstrom C,et al.Active glucagon-like peptide 1 quantitation in human plasma:A comparison of multiple ligand binding assay platforms[J].J Immunol Methods,2014,407:76-81.
[36] Fischer SK,Joyce A,Spengler M,et al.Emerging technologies to increase ligand binding assay sensitivity[J].AAPS J,2015,17(1):93-101.





