问卷调查论文第三篇:研究河北省乳腺癌HER-2检测及判读问卷调查
摘要:目的 了解河北省乳腺癌HER-2检测及判读现状,发现潜在问题,提升市县级医院HER-2检测及判读水平。方法 使用网络问卷对河北省多家医院中乳腺癌HER-2检测及判读问题进行调查,并进行统计分析。结果 全国10余省市169位医师参加了调查,67.5%(114/169)为河北省病理医师,74.0%(125/169)的医院为三甲医院,35.5%的医院乳腺癌每年的病例多于500例,调查显示不同医院HER-2的阳性率差异较大,阳性率为15%~25%的医院占40.8%(69/169),多因素Logistic回归分析显示影响HER-2阳性率的主要因素为标本离体到固定的时间(χ2=36.662,P=0.013)、免疫组化方法(χ2=26.207,P=0.003)和HER-2抗体选择(χ2=32.755,P=0.036)。HER-2检测范围的实现较理想:96.4%(163/169)的医院在乳腺癌术前穿刺和术后标本行常规HER-2检测,治疗过程中出现复发灶和转移灶,87%(147/169)的医院常规进行HER-2检测。84.6%(143/169)和91.1%(154/169)医院分别对多中心性乳腺癌和乳腺微浸润性癌常规进行HER-2检测。结论 标本离体到固定的时间、免疫组化方法及抗体的选择对于HER-2检测阳性率影响明显,建议标本及时固定,选用规范化试剂盒及检测方法流程,对于提高河北省乳腺癌的HER-2检测及判读水平具有重要意义。
关键词:乳腺肿瘤; HER-2;判读;问卷调查;
随着我国《乳腺癌HER-2检测指南(2019版)》(简称2019版指南)[1]的更新,刘月平等[2]对指南进行阐述,我国乳腺癌HER-2检测及判读得以规范和提升。目前,河北省基层医院病理科乳腺癌HER-2检测及判读仍存在较多问题,河北省抗癌协会乳腺癌专业委员会病理协作组通过网络问卷形式对以河北省为主的病理医师进行问卷调查,旨在了解河北省乳腺癌HER-2检测及判读现状,发现潜在问题。本文旨在提升市县级医院HER-2检测及判读水平,并解决病理医师HER-2判读中的疑惑。
1 材料与方法
1.1 材料
通过以河北省为主的省、市、县级医院的病理医师填写腾讯网络问卷,了解河北省乳腺癌HER-2检测及判读情况。
1.2 方法
使用腾讯网络问卷,重点对河北省乳腺癌HER-2检测及判读问题进行调查:(1)HER-2检测标本:对于术前穿刺和术后标本、复发灶和转移灶标本、多中心性乳腺癌、微浸润癌的HER-2检测程度。(2)HER-2检测方法:统计每年乳腺癌HER-2检测例数、标本固定及处理、检测方法等。(3)HER-2判读问题:细胞膜染色完整性与染色强度哪个更重要?病理医师对数字病理(如线上WSI)判读的接受程度。此外,本次问卷设置开放性问题,病理医师自主提出乳腺癌HER-2判读中问题,并进行归纳总结。
2 结果
2.1 调查结果
本次调查共回收有效问卷169份,调查对象为病理科医师填写的HER-2检测及判读情况,每个医院由1名病理医师代表参与。74.0%(125/169)为三甲医院,河北省病理医师占67.5%(114/169)。
2.2 HER-2检测及判读问题统计结果
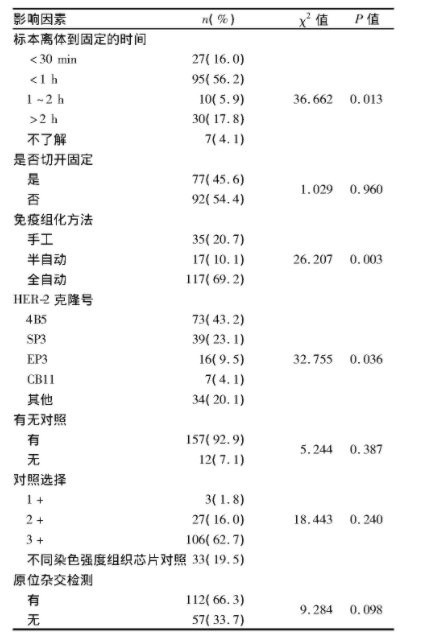
HER-2检测基本情况:35.5%(60/169)的医院乳腺癌﹥500例/年;HER-2阳性率范围较大,阳性率为15%~25%占40.8%(69/169)。72.2%(122/169)标本可在1 h内固定,但仅有45.6%(77/169)的单位标本送到病理科已切开固定。69.2%(117/169)的医院免疫组化法为全自动方法,HER-2抗体克隆号为4B5的占43.2%(73/169),92.9%(157/169)的单位HER-2检测设置阳性对照,阳性对照多选用3+标本(62.7%,106/169),66.3%(112/169)的单位对于HER-2 2+常规行FISH检测。多因素Logistic回归分析显示影响HER-2阳性率的主要因素为标本离体到固定的时间(χ2=36.662,P=0.013)、免疫组化方法(χ2=26.207,P=0.003)和抗体的选择(χ2=32.755,P=0.036,表1)。HER-2检测范围:问卷调查结果显示,2019版指南中建议的HER-2检测范围实现较为理想。96.4%(163/169)单位乳腺癌术前穿刺和术后标本常规行免疫组化,87%(147/169)的单位常规对乳腺癌复发灶和转移灶行HER-2检测。84.6%(143/169)单位对多中心性乳腺癌常规行HER-2检测,91.1%(154/169)对乳腺微浸润癌常规行HER-2免疫组化评估。HER-2判读问题:84.6%(143/169)的病理医师认为细胞膜完整性与染色强度同样重要,13.6%(23/169)认为细胞膜完整性更重要(图1A)。病理医师对于数字病理判读的接受程度:62.1%(105/169)认为数字病理判读不可以替代线下显微镜HER-2判读。66.3%(112/169)认为人工智能辅助对于乳腺癌HER-2免疫组化判读有帮助(图1B)。
表1 影响HER-2阳性率的多因素Logistic回归分析
3 讨论
本组对问卷中病理医师提出较多的问题进行总结及解答。HER-2免疫组化2+判读及染色强度的问题:多数病理医师提出HER-2 2+判读较为困难,认为免疫组化染色强、中、弱、微弱界定不明确,判断难以量化。文献报道显示HER-2 2+判读一致性较差[3,4]。多数病理医师更易将有异质性,染色弱不完整的HER-2 1+判定为2+,导致HER-2 2+过多,原位杂交阳性率较低[5]。有文献报道可通过目镜辅助判读染色强度的方法:强着色为在2~5倍目镜下即能观察到的膜着色,弱~中等着色为在10~20倍目镜下观察到的染色,微弱着色为只在40倍目镜下观察到的染色[6,7]。HER-2异质性的问题:多名病理医师对于有异质性的乳腺癌HER-2免疫组化判读提出疑问。2009年美国病理医师学院(College of American Pathologists, CAP)定义HER-2基因异质性为同一肿瘤中5%~50%的浸润肿瘤细胞HER-2/CEP17比值>2.2[8]。2013年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)/CAP建议使用免疫组化评估中的10%阈值解决HER-2异质性问题,将HER-2异质性定义为存在不同HER-2拷贝数,和(或)不同HER-2/CEP17比率的浸润癌细胞至少占同一肿瘤细胞的10%。此外,指南建议在这种情况下至少应对其中20个细胞进行单独计数[9]。因此,10%的界定对于HER-2蛋白表达和基因的异质性都非常重要。实际工作中对于10%的面积难以判断的情况,必要时可增加蜡块进行检测,以便给出完整全面的HER-2检测结果。此外,10%的阈值判断也关系到HER-2免疫组化0和1+的区分,Lambein等[10]研究显示HER-2免疫组化1+的HER-2拷贝数明显高于免疫组化0组。因此在HER-2免疫组化中,0和1+的区分,有助于不同临床亚组的区分。近来指出“HER-2低表达”的概念,即HER-2免疫组化1+及2+原位杂交扩增阴性的患者,推荐可使用新型Trastuzumab deruxtecan(T-DXd, DS-8201a)治疗[3,11]。因此,区分HER-2免疫组化0和1+具有重要意义。
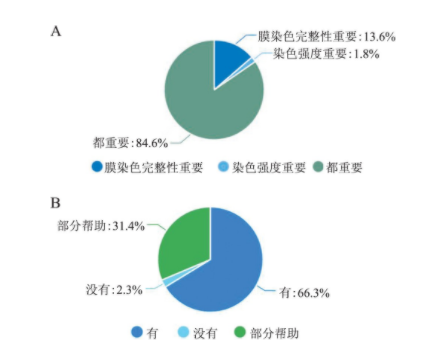
图1 A.病理医师对于HER-2免疫组化判读细胞膜染色完整性与染色强度的重要性选择;B.病理医师认为人工智能辅助对于乳腺癌HER-2免疫组化判读的帮助程度
微浸润性乳腺癌HER-2判读:关于微浸润性乳腺癌HER-2判读,2019版指南指出应尽可能判断微浸润癌的HER-2状态。如果HER-2切片上浸润区域不明显,可备注浸润癌细胞太少,难以评估免疫组化状态[1,2]。对于病理医师提出的广泛导管原位癌同时存在多灶性浸润癌弱阳性时,应遵循导管内原位癌与微浸润性癌组织学形态和分级一致性原则,并可使用双蜡块进行检测,如果异质性明显,必要时可增加蜡块进行检测。对于HER-2原位癌区域染色强而完整,但浸润性区较弱时,应建议进行浸润区原位杂交检测,以确定浸润区HER-2表达。其他特殊情况的HER-2判读:在浸润性微乳头状癌和部分有分泌现象的乳腺癌中,常呈特殊的基底及侧膜U型染色模式。2019版指南中指出若HER-2呈弱~中等强度细胞膜染色,应判为2+,并应行原位杂交检测明确HER-2状态。同样多项研究显示,若浸润性微乳头状癌细胞膜呈现强的U型染色,原位杂交扩增率均为100%[12,13]。因此2019版指南明确此种情况可判为免疫组化3+,比2018版ASCO/CAP指南[14]更明确。2018版ASCO/CAP指南及2019版指南均指出应重视组织学类型和分级与HER-2表达的一致性。在实际判读中应注意高级别浸润性癌伴黏液分泌的现象,此时HER-2可呈阳性,组织学不可误诊为浸润性黏液癌,应根据形态学,包括组织结构及细胞异型性结合免疫组化做出正确诊断。文献报道乳腺癌HER-2的阳性率为15%~25%[11,15],此次调查问卷显示HER-2阳性率符合标准的占40.8%,其中标本固定和免疫组化抗体和检测方法是目前影响HER-2阳性率的重要原因。因此,标本固定不合格的单位仍需按照2019版指南进一步完善。建议标本申请单上填写标本离体时间及固定时间,对于固定不及时的标本,可有效查找原因并解决问题。在标准化检测方面,问卷结果显示手工染色方法会影响HER-2阳性率,分析原因为手工检测各环节难以把握,不易达到标准化。但考虑到基层单位条件有限,因此强调手工染色检测流程应严格按标准作业程序(standard operation procedure, SOP)进行。免疫组化自动染色系统虽然更易达到标准化,但也应进行严格的比对试验和程序优化。无论采用全自动或手工免疫组化方法进行染色,都应在每张切片上设置阳性对照,有条件的单位宜使用包含HER-2免疫组化0、1+、2+、3+组织的组织芯片作为梯度对照。病理医师在判读过程中应通过内、外对照来判断染色成功与否,以避免染色失败造成的错误结果。此外,我国专家组建议科室每月或每季度统计HER-2免疫组化0、1+、2+、3+所占比例,以及免疫组化0、1+、2+、3+原位杂交阳性率[16],这对科室HER-2检测质量控制及阳性率问题分析具有重要意义。
在实际工作中,应综合临床病理特征进行HER-2判断,若出现原位杂交与免疫组化判读结果不一致时,首先应检查标本质量,其次检查免疫组化及原位杂交实验流程及方法,结合临床病理特征,必要时可与临床进行多学科病例讨论。
此次问卷调查还收到关于HER-2判读的希望和建议,较多病理医师希望指南内容更加详细,尤其对于免疫组化结果判读增加更多图例;此外,有病理医师提出希望指南细化人工智能辅助HER-2判读的内容。关于人工智能辅助HER-2判读,2019年CAP提出HER-2免疫组化定量图像分析指南,指出定量图像分析或人工智能可提高乳腺癌HER-2免疫组化结果的准确性和可重复性,但使用前必须经过验证,定期维护,并持续评估质控和检测结果,经定量图像分析辅助判读的结果和报告必须由有此专业知识的病理医师监督确认[17]。
总之,此次问卷调查进一步明确了河北省乳腺癌HER-2检测中的一系列问题,对于基层提升HER-2检测质量具有重要意义。但HER-2规范化检测及判读仍面临问题和挑战,需要病理科、临床科室等多方协作才能加以解决,进而为乳腺癌患者的规范化诊治提供保障。
参考文献
[1]杨文涛,步宏.乳腺癌HER2检测指南(2019版)[J] .中华病理学杂志, 2019,48(3):169-175 .
[2]刘月平,步宏,杨文涛.2019版中国乳腺癌HER2检测指南更新解读[J] .中华病理学杂志, 2019.48(3):182-185.
[3]Modi S,Park H,Murthy R K,et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER -2-low-expressing advanced breast cancer.results from a phase Ib study[J]J Clin Oncol,2020,38(17):1887-1896 .
[4]Dekker T.HER-2-targeted therapies in HER-2-low-expressing breast cancer[J]J Clinical Oncol,2020,38(28):3350-3351 .
[5]Helin H O,Tuominen V J,Ylinen O,et al.Free digital image analysis software helps to resolve equivocal scores in HER-2 immunohistoc hemistry[J].Virchows Archiv,2016. 468 (2):191-198.
[6]杨壹羚, 郭晓静,付丽.乳腺癌主要分子病理指标检测结果的解读与分析[J] .中华病理学杂志, 2020,49(5):526-528.
[7]Ruschoff J,Dietel M,Baretton G,et al.HER-2 diagnostics in gastric cancerguideline validation and development of standardized immunohistochemical testing[J].Virchows Archiv,2010,457(3):299-307.
[8]Vance G H,Barry T S,Bloom K J,et al.Genetic heterogeneity in HER-2 testing in breast cancer.panel summary and guidelines[J].Arch Pathol Lab Med,2009,133:611-612.
[9]Wolff A C,Hammond M E,Hicks D G,et al.Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American Society of CIinical Oncology/College of American Pathologists clinical practice guideline update[J]J Clin Oncol,2013,31(31):3997-4013.
[10]Lambein K,Van Bockstal M,Vandemaele L ,et al.Distinguishing score 0 from score 1+in HER-2 immunohistochemistry-negative breast cancer[J].Am J Clin Pathol,2013, 140 (4):561-566.
[11]Tarantino P,Hamilton E,Tolaney S M,et al.HER2-low breast cancerpathological and clinical landscape[J]J Clin Oncol,2020,38(17):1951-1962 .
[12]Zhou S,Yang F,Bai Q,et al.Intense basolateral membrane staining indicates HER-2 positity in invasive micropapillary breast carcinoma[J].Mod Pathol,2020,3(7):1275-1286 .
[13]杨文娟,魏兵,陈敏,等.乳腺浸润性微乳头状癌HER2免疫组织化学染色结果的判读方法探讨[J] .中华病理学杂志, 2015,44(1):48-52.
[14]Woff A C.Hammond M E H,Allison K H.et al.Human epidermal growth factor receptor 2 testing in breast cancer.American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update[J].J Clin Oncol,2018,36(20):2105-2122.
[15]Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours[J].Nature ,2012 ,490(7418):61-70.
[16]杨文涛,步宏.中国乳腺癌HER2检测指南(2014版)发布一年回顾[J] .中华病理学杂志, 2015,44(4):227-229.
[17]Bui M M,Riben M W.Allison K H.et al.Quantitative image analysis of human epidermal growth factor receptor 2 immunohistochemistry for breast cancerguideline from the college of American Pathologists[J].Arch Pathol Lab Med,2019, 143 (10):1180-1195.





